|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
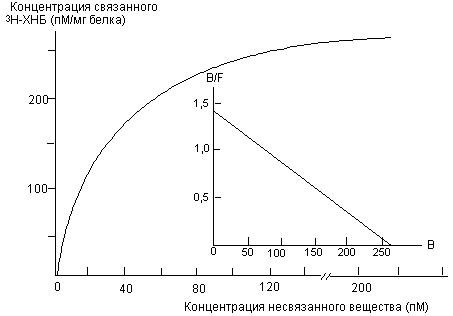
Радиолигандные методы изучения процесса взаимодействия токсиканта с рецепторамиПоскольку токсичность веществ во многом определяется их способностью взаимодействовать с рецепторами определенных типов, количественная оценка сродства конкретного вещества к конкретному рецептору порой имеет решающее значение для выявления механизма его токсического действия. Количественно оценить сродство токсиканта к рецептору можно с помощью радиолигандных методов исследования. При этом, однако, эффекты, развивающиеся вследствие взаимодействия, остаются вне поля зрения исследователя. Более того, в ходе работы не представляется возможным решить вопрос, является ли исследуемое вещество агонистом или антагонистом (активатором или ингибитором) данного рецептора. Тем не менее, сочетание метода с биохимическими и физиологическими методиками позволяет получить развернутую картину механизма действия токсиканта и формирования ответной реакции биосистемы. К числу основных методов относятся: а) с полным насыщением рецептора и б) методы замещения радиолиганда. а). Принцип метода с полным насыщением рецептора состоит в добавлении в инкубационную среду, содержащую рецептор, меченного изотопом токсиканта (радиолиганда) в возрастающей концентрации. Метод пригоден для исследования свойств веществ, прочно фиксирующихся на рецепторе (например, холинолитиков: скополамин, атропина, дитрана и т.д.). В ходе экспериментов с насыщением изучают зависимость количества образовавшегося радиолиганд-рецепторного комплекса (RL) от концентрации радиолиганда (L) при постоянном содержании в среде соответствующих рецепторов (R). После получения необходимых данных (как правило, представляемых в графической форме), можно рассчитать количественные характеристики процесса (константу диссоциации комплекса KD), используя общие положения закона действующих масс. KD = [ R] [ L] /[ RL] (1) Поскольку общая концентрация рецепторов, принимавших участие во взаимодействии, представляет собой сумму свободных и связавшихся рецепторов, т.е. RO = [ R] + [ RL] (2) преобразование уравнения (1) приводит к виду [ RL] = [ RO] [ L] /(KD + [ L]) (3) Полученное уравнение, по сути, идентично уравнению Михаэлиса - Ментен, используемому при описании кинетики ферментативных процессов. При концентрации свободного лиганда равной величине константы диссоциации комплекса лиганд-рецептор, имеем [ RL] = [ RO] [ L] /[ L] + [ L] = 0,5[ RO] (4) Таким образом, в упрощенной форме KD равна концентрации линганда, при которой половина рецепторов приняла участие в образовании лиганд-рецепторного комплекса. Незначительные преобразования уравнения (3) приводят к линейной зависимости между исследуемыми показателями, что значительно упрощает анализ: [ RL] /[ L] = -[ RL] /KD + [ RO] /KD (5) Часто для обозначения количества лиганда, связавшегося с рецептором (RL), используют символ (В); свободного лиганда (L) - (F); общего количества рецепторов (RO) - (BMAX). Представленное в этих символах выражение (5) выглядит следующим образом: B/F = -B/KD + BMAX/KD (6) Исходя из этого выражения, можно рассчитать величину KD: KD = (BMAX - B)F/B Зависимость, построенная в координатах (BMAX - B) - по оси "Х", B/F - по оси "У", как правило, носит линейный характер. Угол наклона прямой позволяет определить величину KD: B/F = 1/KD (BMAX - B) На рисунке 6 представлены данные радиолигандного исследования связывания мощного холинолитика хинуклидинилбензилата (меченного тритием) с холинорецепторами сердечной мышцы свиньи. Анализ кривых позволяет определить сродство токсиканта к рецепторам соответствующего типа.
Рисунок 6. Кривая связывания радиолиганда [ 3Н] -хинуклидинилбензилата (3Н-ХНБ) на солюбилизированных мускаринчувствительных холинорецепторах сердца свиньи (G.S. Herron et al., 1982) Уже в ходе таких простых исследований возникает проблема определения специфичности связывания лиганда. Неспецифическое связывание определяют путем внесения в среду 100 - 1000-кратного избытка не меченного изотопом вещества. Некоторые лиганды, особенно белковой природы, имеют свойство образовывать большое количество неспецифических связей с биосубстратом, иногда до 50% от общего количества образовавшихся комплексов. б). Исследования методом радиолигандного замещения открывают путь к изучению процесса взаимодействия рецепторов с лигандами, характеризующимся формированием нестабильного комплекса. Это, прежде всего, характерно для веществ-агонистов соответствующих нейромедиаторов (например, холиномиметиков: никотина, ареколин, карбахола и т.д.). Принцип метода состоит в добавлении в инкубационную среду, содержащую рецептор и радиолиганд-агонист, немеченого изотопом вещества-антагониста в возрастающих концентрациях, до тех пор, пока лиганд полностью не будет вытеснен из связи с рецептором. Концентрация лиганда в опыте должна быть близка величине константы диссоциации комплекса лиганд-рецептор. В ходе эксперимента обычно определяют концентрацию антагониста, необходимую для вытеснения из связи 50% агониста рецептора. Эта характеристика обозначается как IC50. Константа диссоциации комплекса антагонист-рецептор (К1) и величина IC50 определяются величиной константы диссоциации агонист-рецепторного комплекса. Если предположить, что количество связанного радиолиганда состовляет лишь незначительную часть вещества в инкубационной среде, а также, что константа диссоциации комплекс значительно превышает величину ВMAX, то имеем: К1 = IC50/(1 + F/KD) Сравнивая величины констант диссоциации веществ, оценивают их сродство к изучаемому рецептору. Дата добавления: 2015-02-06 | Просмотры: 893 | Нарушение авторских прав |