|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология
|
Диуретики в терапии сердечной недостаточности
В.Ю. Мареев
НИИ кардиологии им. А.Л.Мясникова РКНПК Минздрава РФ, Москва
Г лавным символом и основным симптомом сердечной недостаточности является задержка жидкости в организме и отеки, или, вернее, отечный синдром. Хотя, конечно, необходимо понимать, что это определенное преувеличение и не всегда при сердечной недостаточности, особенно I, да и II функционального класса (ФК), имеет место видимая задержка жидкости, и все-таки мочегонные средства, и более широко – дегидратационная терапия, занимают одно из ведущих мест в лечении подавляющего большинства пациентов с сердечной недостаточностью. Когда определилось, что я буду рассказывать о мочегонной терапии, то у меня было двоякое чувство – с одной стороны, нужно изложить самое основное, что необходимо знать каждому кардиологу и терапевту, с другой – в последнее время очень мало научных конференций и симпозиумов было посвящено новым исследованиям и разработкам в этой области. Считается, что здесь уже все хорошо знакомо, и за последние 30–40 лет революционных событий на фронте борьбы с отеками у больных с декомпенсацией не произошло. Попробую в данном сообщении показать, что далеко не все так очевидно, как кажется, и представить современные взгляды на особенности диуретической терапии больных с хронической сердечной недостаточностью (ХСН).
Патогенез развития отечного синдрома при ХСН
Как хорошо известно, до 50-х (в 1952 г. был синтезирован гидрохлоротиазид, первый тиазидный диуретик) – 60-х годов (в 1963 г. опробован первый так называемый петлевой диуретик – фуросемид) XX века, когда были созданы мочегонные средства, считалось, что чем хуже работает сердце, то тем быстрее у больного разовьется сердечная недостаточность. Казалось, что нужно подстегнуть сердце инотропными средствами, оно начнет хорошо сокращаться и симптомы сердечной недостаточности исчезнут. Выяснилось, что это не совсем так, и у части больных, несмотря на подстегивание работы сердца (инотропную стимуляцию), жидкость из организма не уходила. Поэтому в 60-е годы в представлениях врачей господствовала так называемая кардиоренальная модель патогенеза ХСН.
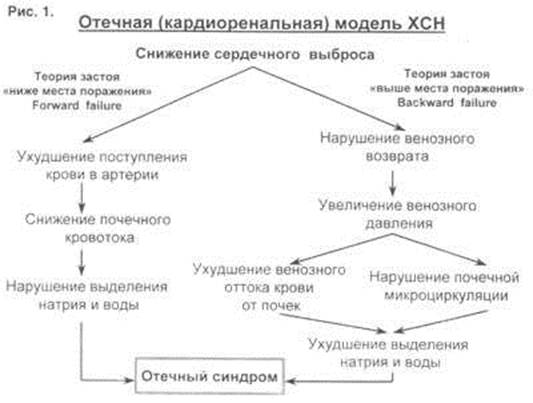
На рис. 1 представлена схема, объяснявшая пути формирования синдрома ХСН. Существовало две основные теории – что кровь застаивается ниже места поражения (forward failure) и теория застоя выше места поражения (backward failure).
Что такое теория застоя ниже места поражения? Предполагалось, что когда левый желудочек хуже качает кровь, кровь плохо поступает в артерии, снижается почечный кровоток, и с помощью активации внутри почечных механизмов нарушается выделение натрия и воды.
А застойная теория выше места поражения гласила, что если левый желудочек плохо качает кровь и его насосная функция нарушается, конечно-диастолическое давление растет, ухудшается опорожнение левого предсердия, кровь застаивается в венах, нарушается венозный возврат, повышается венозное давление, ухудшается венозный отток от почек, страдает почечная микроциркуляция и в итоге тоже нарушается выделение натрия и воды.
 Таким образом, в 60-е годы классикой в лечении ХСН стала считаться комбинация сердечного гликозида с диуретиком. Таким образом, в 60-е годы классикой в лечении ХСН стала считаться комбинация сердечного гликозида с диуретиком.
Много лет спустя, к середине 80-х годов удалось установить и исследовать четкую взаимосвязь между диуретическими возможностями больных с декомпенсацией и целым рядом сложных нейрогормональных сдвигов. Исследователи пришли к выводу, что в основе патогенеза сердечной недостаточности лежит дисбаланс нейрогормонов. Основные нейрогормональные системы можно сгруппировать как вазоконстрикторные антидиуретические и пролиферативные гормоны и противостоящие им системы, способствующие усилению диуреза, вазодилатации и блокаде пролиферации клеток и ремоделирования органов-мишеней. Мы знаем, при ХСН велик дисбаланс в сторону преобладания, первых, можно сказать, условно негативных нейрогуморальный субстанций, таких как ренин-ангиотензин-альдостероновая (РААС), симпатоадреналовая (САС) системы, эндотелин, вазопрессин, которые отвечают за задержку жидкости в организме. Защитная же роль условно положительных нейрогормонов (брадикинина, оксида азота, простациклина, натрийуретических факторов) при ХСН резко снижена.
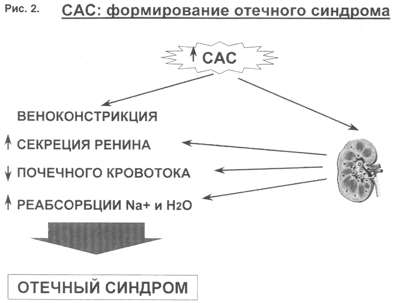
Поэтому, когда мы говорим о двух системах, которые усиливают задержку жидкости в организме, мы в первую очередь имеем в виду РААС и САС.
На рис.2 представлены основные воздействия САС на почки в организме больного с ХСН, приводящие к задержке жидкости в организме. Как видно, здесь и прямая констрикция почечных артериол, и повышение синтеза ренина, и ухудшение почечного кровотока и реабсорбция 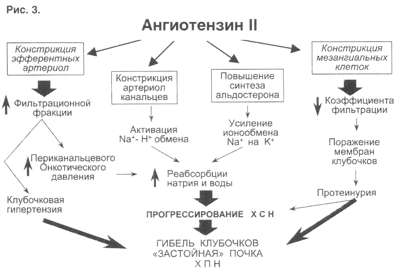 натрия с задержкой жидкости в организме. натрия с задержкой жидкости в организме.
Ну и конечно, как видно из рис 3, очень важную роль играет РААС и прежде всего ангиотензин II (АII). АII – это важнейший гормон, который влияет на ауторегуляцию почки и можно выделить по крайней мере пять разных механизмов этого воздействия:
- Констрикция отводящих артериол (vas efference). Сначала при снижении сердечного выброса это сопровождается компенсаторным повышением фильтрационной фракции, но затем длительная клубочковая гипертензия приводит к гибели клубочка. За счет большей фильтрации происходит относительное увеличение концентрации протеинов в капиллярах ниже клубочка, т.е. повышается периканальцевое онкотическое давление, что сопровождается реабсорбцией натрия и воды.
- Сужение артериол канальцев сопровождается активацией Na/H-обмена и следующей за этим повышенной реабсорбцией натрия и воды.
- Констрикция vasa recta, что приводит к ухудшению кровотока в мозговом слое почки и перераспределению кровотока на нефроны, обладающие повышенной натрийзадерживающей способностью.
- Повышение синтеза альдостерона, которое усиливает ионообмен натрия на калий в области дистальных почечных канальцев.
- И, наконец, констрикция мезангиальных клеток, что приводит к уменьшению "фильтрационных пор", в дальнейшем изменениям клубочковых мембран, протеинурии и гибели клубочков.
Как видно, существует много разных механизмов, по которым эти две системы – РААС и САС – активируют задержку натрия и воды в организме, обусловливая развитие отечного синдрома.
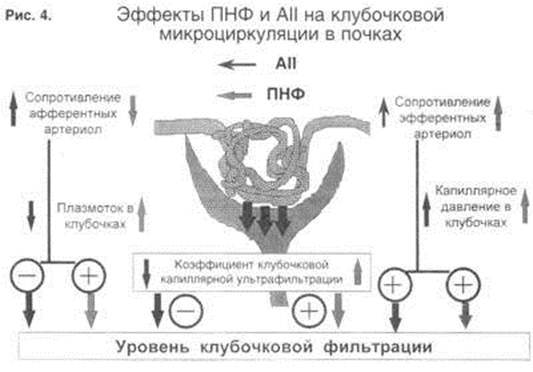
Что же этому противостоит? В основном роль "противовеса" играют натрийуретические пептиды – предсердный, мозговой, которые вырабатываются в клетках предсердий и желудочков при их перерастяжении и объемной перегрузке сердца, и Ц – концевой, синтезирующийся эндотелиальными клетками. Почечная фракция этих гормонов, получившая название "уродилатин", оказывает нормализующее действие на внутрипочечную функцию. Поэтому, когда мы оцениваем ситуацию в почке и то, как контролируется уровень клубочковой фильтрации у больного с ХСН, необходимо иметь в виду влияние двух основных эффекторов – это условно негативный AII и противостоящий ему условно позитивный натрийуретический фактор (НУФ).
Система "ауторегуляции" почек при ХСН
Как следует из рис. 4, действие АII и НУФ во многом, хотя и не во всем, разное. Например, тонус и сосудистое сопротивление афферентной артериолы повышается при применении AII и снижается при применении НУФ. Следовательно, плазмоток в почках может быть увеличен или уменьшен в зависимости от баланса этих субстанций. При выраженной ХСН и преобладании АII почечный плазмоток снижается. Аналогично, противоположный эффект имеют АII и НУФ на уровне клубочковой фильтрации: она повышается под действием НУФ и снижается под действием AII.
Однако на правой части рисунка, где представлена одна из главных систем ауторегуляции почки – на эфферентные артериолы, два столь разных нейрогормона, как АII и НУФ, действуют однонаправлено, синергистично и сужают отекающую артериолу. Благодаря этому они повышают давление в клубочках и тем самым могут контролировать давление фильтрации даже при сниженном сердечном выбросе. Этот феномен носит название ауторегуляции почки у больного с ХСН. Многие исследования, в том числе и нашей группы, показали, что при снижении минутного объема сердца до 30% от исходного уровня, фильтрация составляет 65%, т.е. вдвое выше доли почечного кровотока.
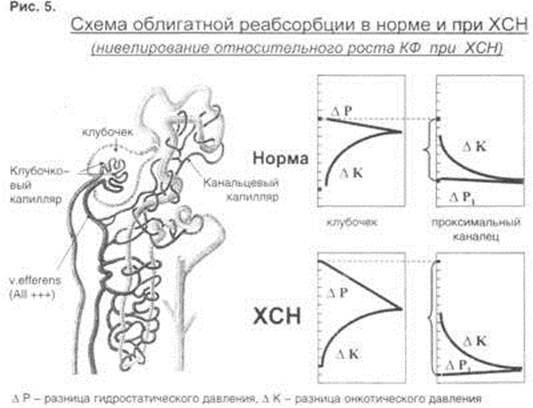
Однако увеличение фильтрации не коррелирует с выделением жидкости из организма. В ответ на рост фильтрации у больного с ХСН немедленно увеличивается облигатная реабсорбция (рис 5). Фильтрация определяется градиентом между гидростатическим давлением (D P) в клубочковых капиллярах (образуемом за счет того, что отводящая артериола имеет меньший диаметр и спазмирована больше, чем приводящая), с одной стороны, и онкотическим (D K) и коллоидно-осмотическим давлением – с другой. Жидкость проходит через капиллярно - клубочковую мембрану, а белок нет. Поэтому гидростатическое давление постепенно снижается, а онкотическое растет. Когда разница между гидростатическим и онкотическим давлением на протяжении клубочкового капилляра исчезает, фильтрация прекращается. Поскольку канальцевые капилляры являются непосредственным продолжением клубочковых, онкотическое давление в них окажется точно таким же, как в момент окончания фильтрации, гидростатическое же давление "ниже" спазмированной отводящей артериолы будет ниже, чем в капиллярах, и жидкость начнет обратное движение из канальца в капилляры, т.е. начнется проксимальная реабсорбция. Эта реабсорбция в проксимальных канальцах составляет до 80% от всего объема обратного движения первичной мочи и носит название облигатной, т.е. зависящей от фильтрации. На верхней части схемы представлена ситуация в норме, а на нижней – при ХСН. Как мы только что говорили, за счет совместного действия AII и НУФ на тонус vas afference, гидростатическое давление в капиллярах повышенное, что сопровождается увеличением фильтрации и объема образующейся первичной мочи. Однако, учитывая, что спазм отводящей артериолы гораздо сильнее, чем в норме, то гидростатическое давление в капиллярах канальцев существенно снижено, градиент между онкотическим и гидростатическим давлением увеличен и реабсорбция повышается, "съедая" почти все выгоды увеличенной фильтрации. При этом нагрузка на клубочковые мембраны колоссальна, что сопровождается их поражением и в итоге гибелью клубочков.
Таким образом, у многих больных сердечной недостаточностью, даже тогда, когда появляется отечный синдром, увеличена как фильтрация, так и связанная с ней облигатная проксимальная реабсорбция. Поэтому применение препаратов, увеличивающих почечный кровоток и фильтрацию (гликозидов, эфедрина, эуфиллина), слабо влияет на выраженность задержки жидкости.
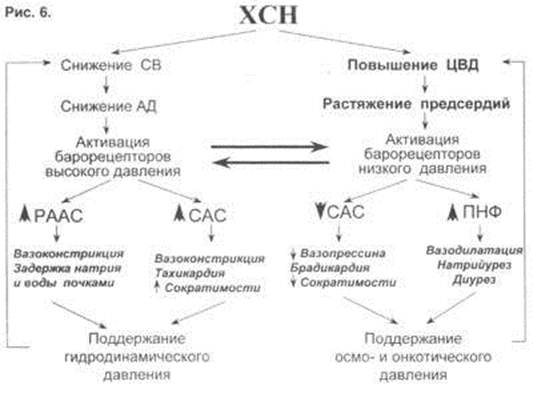
И еще последний момент из теории – что сердечная недостаточность – это процесс активации двух типов барорецепторов высокого и низкого давления (рис.6). Барорецепторы высокого давления, расположенные в дуге аорты, реагируют на сниженный при ХСН сердечный выброс и ответственны за регуляцию вазоконстрикторных и антидиуретических систем (РААС и САС), которые поддерживают высокое гидродинамическое давление в периферических сосудах вплоть до мелких артериол и прекапилляров. С другой стороны, из-за развития застойных явлений при растяжении предсердий происходит активация барорецепторов низкого давления. Эта реакция является защитным механизмом – она повышает выработку НУФ и снижает активность САС, поддерживая осмо- и онкотическое давление.
При сердечной недостаточности этот баланс нарушается, как видно на рис. 6: слева – норма, а справа – сосуд при сердечной недостаточности.
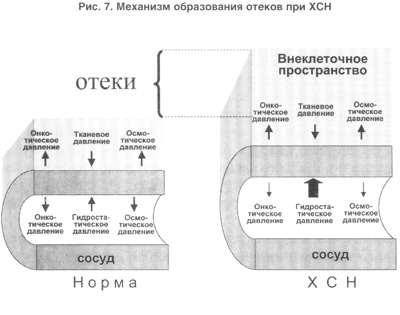
В норме (рис. 7, левая часть) существует баланс между гидростатическим давлением, "выдавливающим" жидкость из сосуда в перисосудистое межклеточное пространство, и онкотическим и осмотическим давлением, "удерживающим" жидкость в русле. При ХСН этот баланс нарушается. Гидростатическое давление резко возрастает из-за активности РААС и САС, а противостоящие им онко- и осмотическое давление резко падают. Поэтому жидкость уходит на периферию и задерживается в межклеточном пространстве, и образуются отеки. Теоретически говоря, для того чтобы устранить отеки, мы должны баланс этих сил нормализовать. Этого можно добиться тремя путями: нормализовать баланс нейрогормонов, снизить гидростатическое давление, повысить онкотическое давление.
Ситуация обостряется до предела, когда больной приходит с отеком легких или тяжелейшей одышкой, тогда стоит вопрос не только о том, каким образом, но и как немедленно убрать из организма избыточную жидкость. В этих случаях применяют диуретические или мочегонные препараты, которые призваны за счет уменьшения реабсорбции увеличить выделение натрия и воды из организма. Это снижает гидростатическое давление в капиллярах и постепенно прекращает пропотевание жидкости из капилляров в ткани, т.е. образование отеков.
Общая характеристика мочегонных
Классификация основных лекарственных средств, позволяющих усилить выведение воды из организма, т.е. тех, которые мы можем отнести к диуретикам или мочегонным средствам, традиционно строится исходя из локализации их действия в нефроне (рис. 8). Как видно, первой зоной воздействия может быть почечный клубочек (на рис. цифра1), хотя эти препараты, как мы уже говорили, лишь с известной долей условности можно отнести к мочегонным.
К основным диуретикам относятся препараты, влияющие на проницаемость канальцев для натрия и воды и способные блокировать процессы реабсорбции. Эти препараты за счет своего влияния на реабсорбцию ионов натрия и хлора получили наименование салуретиков.
Большинство современных диуретиков (за исключением урегита) являются дериватами сульфаниламидов, точнее сульфомоильной кислоты (рис. 9). Из рис. 9 видно, что остаток сульфомоильной кислоты (обведен прямоугольником) присутствует в молекулах ингибитора карбоангидразы (ацетазоламида или диакарба), тиазидов (гидрохлоротиазида или гипотиазида), петлевых диуретиков (фуросемида, буметанида или буфенокса). Как видно, разные по силе, механизму действия и локализации эффекта в нефроне диуретики не имеют принципиальных различий в химической структуре. В сером круге показана принципиально отличная форма этакриновой кислоты, являющейся активным компонентом петлевого диуретика урегита.
Различие в действии диуретиков зависит прежде всего от локализации их действия в нефроне и интимного механизма влияния на реабсорбцию.
Препараты, действующие в области проксимальных канальцев
В области проксимальных канальцев (зона 2 на рис. 8) реабсорбируется до 80% профильтровавшейся мочи, однако в основном этот процесс носит название облигатной (обязательной) реабсорбции, о чем мы уже подробно говорили. Этот участок нефрона проницаем и для воды, и для натрия, поэтому после его прохождения моча остается изотоничной по отношению к плазме.
В области проксимальных канальцев действуют осмотические диуретики и ингибиторы карбоангидразы.
Осмотические диуретики (маннитол) редко используют для лечения ХСН, а во многих руководствах даже отмечается, что они противопоказаны при тяжелой декомпенсации. Хотя опытные врачи, особенно в экстренных ситуациях, помнят об этом небезопасном, но в некоторых случаях последнем из возможных способов лечения критических больных с ХСН.
В действии осмотических диуретиков препаратов можно выделить три фазы:
1. При попадании в кровоток они увеличивают осмотическое давление, по типу "губки" втягивают жидкость из тканей в сосуды. На этом основано их применение у пациентов с отеком мозга, повышенным внутричерепным давлением, глаукомой. Процесс перемещения жидкости из тканей в русло может быть очень активным (лавинообразным) и трудно поддающимся контролю. При ХСН в этой фазе осмотические диуретики могут привести к отеку легких, что является главным ограничением к их использованию у этого контингента больных. В любой момент может появиться необходимость в экстренном применении петлевых диуретиков внутривенно (мы в нашей практике использовали внутривенную инфузию лазикса непосредственно перед или во время введения осмотических мочегонных). Более того, врач, применяющий маннитол при ХСН, должен быть уверенным, что он сможет достичь быстрого и эффективного диуреза и контролировать состояние гемодинамики малого круга. Проблема в основном состоит в том, что при хорошей реакции пациента на петлевые диуретики маннитол не используется. Как раз показанием к его назначению служит рефрактерный отечный синдром, осмотические диуретики у больного с ХСН – это обычно крик отчаяния.
2. После увеличения объема циркулирующей крови наступает вторая фаза действия, связанная с резким ростом фильтрации в почечных клубочках, причем осмотические диуретики свободно фильтруются, попадая в первичную мочу.
3. При попадании в проксимальные канальцы маннитол поддерживает высокое осмотическое давление первичной мочи. Это "связывает" с эквивалентным количеством растворенных электролитов и блокирует степень облигатной реабсорбции. В итоге достигается увеличение (иногда весьма значительное) диуреза.
В той же зоне проксимальных канальцев действуют и ингибиторы карбоангидразы, получившие свое название благодаря уникальному механизму действия. Из препаратов этой группы обычно используют ацетазоламид (диакарб).
Фермент карбоангидраза играет ключевую роль в метаболизме угольной кислоты в эпителии проксимальных канальцев и поддерживает равновесие между содержанием угольной кислоты, с одной стороны, и ионами водорода и бикарбоната – с другой. Ионы водорода движутся в просвет клубочка, обмениваясь на ионы натрия, которые реабсорбируются вместе с бикарбонатами. Блокада карбоангидразы останавливает этот ионообмен, приводя к накоплению ионов водорода и постепенному ацидозу. В итоге нарушается реабсорбция натрия и незначительно повышается диурез.
При нормальном кислотно-щелочном состоянии (при отсутствии алкалоза) активность этого процесса невелика, поэтому диуретическое действие диакарба весьма слабое. Кроме того, быстрое истощение бикарбонатных ионов и развитие ацидоза с переизбытком ионов водорода сильно снижает эффективность ингибиторов карбоангидразы после 3–4 дней непрерывного лечения. Иная ситуация при метаболическом алкалозе, когда имеется переизбыток бикарбонатных ионов. Диуретическое действие ингибиторов карбоангидразы усиливается и сопровождается активацией ионообмена натрия на водород, блокадой реабсорбции натрия и диурезом. В подобных случаях ингибиторы карбоангидразы становятся важным подспорьем в диуретической терапии декомпенсированных больных, о чем, к сожалению, обычно забывают практикующие врачи.
Диуретики, действующие на восходящую часть петли Генле
В настоящее время в основном применяют два класса мочегонных средств, действующих на восходящую часть петли Генле.
В этом разделе мы рассмотрим самые эффективные и популярные диуретические средства, которые и олицетворяют собой в сознании большинства практикующих врачей само понятие – мочегонные.
Это связано с тем, что именно этот участок канальцев проницаем для ионов натрия и именно здесь возможно максимальное влияние на его реабсорбцию. Причем на протяжении восходящей части петли Генле реабсорбируется до 30% натрия, из которых в кортикальном сегменте и дистальных канальцах не более 5–7% (см. рис. 8). Нисходящая часть петли Генле для ионов натрия непроницаема, но по осмотическому градиенту благодаря ионам натрия, реабсорбирующимся уже в мозговом слое восходящей части петли, диффундирует свободная вода (пунктирная линия на рис. 8). Этот процесс носит название противоточного реабсорбционного градиента (отмечено кругом на рис. 8). Моча становится гипертоничной по отношению к плазме. Однако после прохождения восходящей части петли Генле, получившего также название "разводящий" сегмент нефрона, в которой интенсивно реабсорбируется натрий и другие электролиты, моча становится гипертоничной по отношению к плазме (сплошная линия на рис. 8).
Тиазидные диуретики (гипотиазид, из более новых – индапамид) действуют на кортикальный сегмент петли Генле и в начальной области дистальных канальцев, блокируя активность специального натриево-хлорного транспортера. Их эффект на реабсорбцию натрия и, следовательно, диурез умеренный (до +30 – +50% от исходного) и наблюдается лишь при сохраненной функции почек (при клиренсе креатинина больше 30 мл/мин).
Наиболее мощными являются петлевые диуретики (фуросемид, урегит, буметанид), которые блокируют активность специального Na+ / 2 Cl- / K+ транспортера в клетках канальцев на протяжении всего восходящего сегмента петли Генле. Диуретическое действие этих препаратов наиболее сильное (прирост диуреза при адекватной дозе превосходит 100% от исходного) и сохраняется даже при сниженной функции почек (при клиренсе креатинина не ниже 5 мл/мин).
Дополнительными свойствами петлевых диуретиков является способность умеренно снижать активность карбоангидразы и стимулировать синтез почечных вазодилатирующих простаноидов, прежде всего простагландина E2 (PGE2). Увеличение синтеза PGE2 сопровождается дополнительным усилением натрия в восходящей части петли Генле и снижению реабсорбции свободной воды в собирательных трубочках. Благодаря такому комплексу эффектов петлевые диуретики по праву считаются незаменимыми в лечении выраженной ХСН.
Тем не менее между петлевыми и тиазидными диуретиками имеется ряд серьезных различий, о которых необходимо помнить. Во-первых, это несколько разная локализация действия в нефроне. Как видно из рис. 8, тиазидные диуретики влияют на реабсорбцию в кортикальном сегменте восходящей части петли Генле и эта зона "перекрывается" петлевыми мочегонными. Но, кроме того, тиазидные мочегонные влияют и на самую конечную часть петли Генле и начальную часть проксимальных канальцев, на которые действие петлевых мочегонных не распространяется. Во-вторых, точкой приложения действия в эпителиальных клетках канальцев являются различные электролитные транспортеры. Это говорит об особенностях каждого из рассматриваемых классов мочегонных и противоречит распространенной в России точке зрения, что тиазидные мочегонные вызывают большое число электролитных расстройств и являются лишь ослабленной версией петлевых диуретиков.
Регулярное применение активных мочегонных чревато электролитными расстройствами (потеря калия и магния) и развитием метаболического алкалоза. Активация синтеза нейрогормонов (прежде всего РААС) после обильного диуреза чревато новой задержкой жидкости в организме.
Диуретики, действующие в области дистальных канальцев
В области дистальных канальцев происходит активный ионообмен, в основном ионов натрия на калий, который регулируется прежде всего влиянием альдостерона на специфические рецепторы, расположенные в этой зоне. Поэтому диуретики, влияющие на дистальные канальцы, вызывают довольно слабый диурез (+ 20% к исходному) за счет блокады реабсорбции натрия. При этом замедляется выделение с мочой калия. Поэтому препараты, влияющие на дистальные почечные канальцы, получили название калийсберегающих мочегонных.
К этой группе в первую очередь относится единственный конкурентный антагонист альдостерона, доступный в широкой клинической практике, – альдактон.
Механизм действия альдактона – это оккупация рецепторов, на которые должен действовать альдостерон (зона 5 на рис.8). С сегодняшних позиций альдактон может быть охарактеризован как один из нейрогормональных модуляторов, блокирующих активность РААС, обладающий диуретическим эффектом.
Естественно, клинические свойства альдактона могут объясняться исходя из локализации рецепторов к альдостерону и тех эффектов этого гормона, которые удается подавить.
В 60-е годы считалось, что рецепторы, на которые действует альдостерон, располагаются в дистальных канальцах почек (см. рис. 8). Альдостерон, активируя рецепторы, усиливал ионообмен, происходящий в дистальных канальцах (показано цифрой 5). В итоге усиливалась реабсорбция ионов натрия и, частично, водорода в обмен на ионы калия и магния, выводившиеся из организма. Подобное действие сопровождалось, с одной стороны, задержкой жидкости в организме и усилением отеков, а с другой – потерей калия и магния, что могло вызывать или усугублять желудочковые нарушения ритма сердца.
Гораздо позже, уже в 80-е годы, было доказано наличие альдостероновых рецепторов в миокарде и эндотелии сосудов. Хроническая активация миокардиальных рецепторов сопровождается развитием фиброза и ремоделирования левого желудочка, что заканчивается прогрессирующим снижением пропульсивной способности сердца. Активация же эндотелиальных рецепторов к альдостерону и повышенное влияние на них этого гормона ведет к ремоделированию сосудов, что также характерно для декомпенсированных больных. В итоге повышенный уровень альдостерона у больных с ХСН имеет много негативных эффектов. В 1990 г. было впервые продемонстрировано, что высокий уровень альдостерона ассоциирован с негативным прогнозом больных ХСН, и от блокады повышенного уровня альдостерона стали ожидать многочисленных, не только диуретических эффектов. Однако в настоящей публикации мы оставим эти дополнительные свойства альдактона "за кадром" и сконцентрируемся на его диуретических свойствах.
Альдактон как калийсберегающий диуретик начали использовать в клинической практике с середины 60-х годов. Собственно мочегонное действие альдактона не очень сильное, так как в дистальных канальцах реабсорбируется малое количество натрия. Однако по правилу "загрузки" более дистальных отделов нефрона при применении активных мочегонных действие альдактона существенно усиливается при применении вместе с петлевыми и тиазидными мочегонными.
В этих случаях альдактон применяют в дозах 150–300 мг (6–12 таблеток), причем всю дозу лучше назначать утром, в крайнем случае в два приема в первой половине дня, когда уровень альдостерона в крови максимальный. Эффективность терапии контролируется по трем основным параметрам:
- включение альдактона в комплекс терапии вместе с активными диуретиками сопровождается увеличением диуреза в пределах 20%, что позволяет снизить дозы петлевых и(или) тиазидных диуретиков;
- показателем эффективности и успешности терапии альдактоном является исчезновение чувства жажды, сухости во рту и исчезновения специфического "печеночного запаха" изо рта, параллельно с положительным диурезом и снижением массы тела больного;
- концентрации калия и магния в плазме не должны снижаться, несмотря на активное применение мощных петлевых диуретиков.
Таким образом, сегодня не вызывает сомнения полезность и необходимость применения альдактона в высоких дозах в период обострения декомпенсации в комплексе с другими мочегонными средствами. Однако вопрос о длительном применении альдактона, особенно на фоне ингибиторов ангиотензинпревращающих ферментов (ИАПФ), вызывает сомнения. Так, в этом случае могут проявляться побочные эффекты, основные из которых гиперкалиемия, азотемия и гинекомастия. Сегодня доказано, что у тяжелых больных с ХСН III – IV ФК ХСН дополнительное к ИАПФ назначение малых доз альдактона (25 мг/сут) может положительно влиять на прогноз больных (исследование RALES). Однако целесообразность длительного применения больших доз препарата пациентам с начальной и умеренной ХСН не доказана.
Кроме того, в эту группу входят прямые блокаторы натриевых каналов в апикальных клетках дистальных почечных канальцев – триамтерен и амилорид. Эти препараты редко применяют в России, хотя триамтерен входит в состав популярного в недавнем прошлом диуретика триампур композитум.
Следует отметить, что при применении всех калийсберегающих мочегонных, рН плазмы крови возрастает, т.е. они вызывают развитие ацидоза.
Далее представлена характеристика и основные фармакологические свойства наиболее употребляемых диуретиков.
Гидрохлоротиазид (гипотиазид) – препарат выбора для лечения умеренной ХСН. В дозах до 25 мг вызывает минимум побочных эффектов и электролитных нарушений. В дозах выше 75 мг число побочных эффектов возрастает. Максимум эффекта через 1 ч после приема, длительность действия 12 ч. Усвояемость препарата (как и всех других диуретиков) снижается после приема пищи, поэтому рекомендуемое время приема – утром натощак. Оптимальная комбинация – с ИАПФ, позволяющая усилить диуретическое действие при снижении числа побочных эффектов.
Фуросемид (лазикс) – наиболее известный из мощных петлевых диуретиков, с началом эффекта через 15–30 мин после приема, максимумом через 1–2 ч и длительностью выраженного диуретического эффекта 6 ч. Выводится из организма почками в следующем соотношении: 60% – сам препарат и 40% – метаболиты. Применяют однократно (утром натощак). В случаях выраженной ХСН дозы варьируют от 20 до 500 мг и выше при рефрактерных отеках.
Урегит (этакриновая кислота) – также петлевой диуретик, применяемый с той же целью и по тем же показаниям, как и фуросемид. Обладает похожими фармакодинамическими свойствами, но влияет на другие ферментные системы в восходящей части петли Генле. Выводится почками в соотношении: 65% – сам препарат и 35% – метаболиты. Поэтому при упорных отеках замена фуросемида на урегит или их совместное применение могут дать дополнительный эффект. Обычные дозы 50–100 мг, которые при необходимости могут повышаться до 200 мг.
Буметанид (буфенокс) – сильный диуретик, нарушающий реабсорбцию натрия и хлора в толстом сегменте восходящей части петли Генле. Обычно используется в дозах 0,5–2 мг (максимальная доза 10 мг/сут). Назначают, как и все другие мочегонные, утром натощак. Начало диуреза через 15–30 мин, максимум через 1–2 ч, длительность до 6 ч. Выводится почками в соотношении: 60% – сам препарат и 40% – метаболиты. Можно заменять на фуросемид или урегит и применять в комбинации с ними у больных с упорным отечным синдромом при ХСН III – IV ФК.
Ацетазоламид (диакарб) – слабый диуретик из группы ингибиторов карбоангидразы, действующий в области проксимальных канальцев. Единственный из диуретиков, повышающий рН и подкисляющий среду. Применяют в качестве дополнительного средства при длительном назначении мощных диуретиков для восстановления pH и чувствительности к петлевым мочегонным. Доза препарата 250 мг 2–3 раза в сутки в течение 3–4 дней с последующей отменой (перерывом) в лечении.
Неконкурентный антагонист альдостерона триамтерен применяют в суточной дозе 50–150 мг, при этом он метаболизирует и диуретическим эффектом обладает в большей степени его стабильный метаболит канренон. Начало действия – 2 ч после приема, длительность – 12 ч. Диурез, натриемия возрастают в пределах 20% при одновременном уменьшении выделения калия (до 30%). Оптимальным является сочетание триамтерена с тиазидными диуретиками в соотношении 2: 1. На этой основе был сделан препарат триампур, содержащий в одной таблетке 12, 5 мг гипотиазида и 25 мг триамтерена. Минимальная доза при ХСН – 2 таблетки, оптимальная – 4, максимальная – 8 таблеток в сутки.
Отдельно необходимо отметить еще два препарата, которые, к сожалению, мало известны в России, но очень широко применяются в мировой практике лечения ХСН.
Торасемид (демадекс) – самый эффективный из современных петлевых диуретиков. Биоусвояемость торасемида в 2 раза выше, чем эталонного фуросемида (достигает 80–90% даже при ХСН). Препарат на 80% метаболизирует в печени, поэтому почечная недостаточность почти не влияет на его фармакодинамические свойства. В сравнительных исследованиях с фуросемидом на 234 больных торасемид на 52% снижал риск госпитализаций, связанных с обострением ХСН. Более того, результаты проспективного исследования, в котором 2303 больных с ХСН были рандомизированы в соотношении 1:1 получавших торасемид или фуросемид, продемонстрировали достоверное снижение сердечно-сосудистой (на 53%, р < 0,013) и общей (на 41%, р = 0,035) смертности (D.C.Brater, 2000).
Метолазон (зароксолин) – производное квиназолина по химической структуре и механизму действия принадлежит к группе тиазидных диуретиков. Метолазон – жирорастворимый препарат, легко проникающий в эпителиальные клетки кортикального сегмента восходящей части петли Генле, несмотря на выраженные явления почечной и сердечной недостаточности. Это положительно отличает его от остальных тиазидных диуретиков. Другим преимуществом метолазона является его длительный (до 24 ч) эффект. Все это сделало метолазон в сочетании с петлевыми диуретиками одной из наиболее эффективных комбинаций в лечении ХСН.
Выбор диуретиков при ХСН. При начальных стадиях сердечной недостаточности (I ФК; 1-я стадия ХСН по Российской классификации) диуретики применять не следует.
При умеренной ХСН (II, иногда даже III ФК; IIA стадия по классификации В.Х.Василенко и Н.Д.Стражеско) и сохраненной функции почек средством выбора могут быть тиазидные диуретики. Удивительно, но в России гипотиазид – крайне редкий гость в рекомендациях врачей-терапевтов для пациентов с ХСН. Наиболее популярным способом терапии считается использование петлевых диуретиков, даже тогда, когда клиническая ситуация этого не требует.
С нарастанием тяжести декомпенсации приходится переходить к применению более сильных петлевых диуретиков или комбинации двух препаратов и более. Всегда полезна комбинация тиазидных или петлевых диуретиков с ингибиторами карбоангидразы. После 2 нед лечения активными мочегонными развивается метаболический алкалоз. В этих условиях эффективность тиазидов и петлевых мочегонных падает, а диуретические свойства ингибиторов карбоангидразы увеличиваются. Поэтому назначение диакарба в дозе 0,25 3 раза в день в течение 3–4 сут может быть вдвойне полезным:
- за счет непосредственного диуретического эффекта;
- за счет изменения рН мочи в кислую сторону и восстановления хорошего эффекта активных мочегонных препаратов.
Очень выгодной может быть и комбинация активных диуретиков с калийсберегающими препаратами, действующими на дистальные канальцы. Альдактон или триамтерен предотвращают развитие электролитных расстройств и так же как ингибиторы карбоангидразы, подкисляют среду, что усиливает эффект активных диуретиков.
В самых тяжелых стадиях целесообразно сочетание петлевого диуретика с тиазидным (лучше всего с метолазоном) или двух петлевых мочегонных плюс антагонист альдостерона плюс 1 раз в 2 нед по 3 дня ингибитор карбоангидразы.
Тактика лечения диуретиками.
Лечение мочегонными препаратами больных с ХСН проходит две фазы – активную и поддерживающую.
Задачей активной фазы лечения является устранение избыточно накопленной в организме жидкости, проявляющейся в виде отеков. В этой фазе необходимо создать форсированный диурез с превышением выделяемой мочи над потребляемой жидкостью на 800 мл – 1 л в сутки. Параллельно масса тела должна ежедневно снижаться на 750 г –1 кг за сутки.
Принцип дозирования диуретиков – quantum satis или доза увеличивается до достижения требующегося эффекта. Терапия начинается с малых доз диуретиков (до 50 мг гипотиазида или 20–40 мг фуросемида, до 50 мг урегита или до 1 мг буфенокса), которые потом, при необходимости, могут быть увеличены. Необходимо помнить, что мочегонные препараты всегда целесообразно назначать на фоне АПФ. Такая комбинация (примером является препарат капозид) очень эффективна, причем оба компонента потенцируют и усиливают действие друг друга, и безопасна, так как позволяет избежать многих побочных реакций, свойственных диуретической терапии.
Исследования показали, что применение капозида (25 мг каптоприла и 12,5 мг в одной таблетке) эффективно и, самое главное, безопасно даже при лечении наиболее неблагоприятной группы пожилых больных, в том числе и с клинически выраженной ХСН. Применение этого препарата при начальных стадиях декомпенсации может стать разумной альтернативой подбору других диуретиков.
ИАПФ как раз являются теми препаратами, которые позволяют нормализовать баланс нейрогормонов, что наряду с увеличением диуреза и снижением гидростатического давления в капиллярах относится к приоритетным задачам борьбы с отеками.
Важную роль в адекватном применении мочегонных играют анамнестические сведения, позволяющие оценить успешность диуретической терапии в прошлом. Однако необходимо помнить, что анамнестические указания на применение петлевых диуретиков (например, у больных с умеренной декомпенсацией) не противоречат тому, что считающиеся более слабыми тиазидные препараты могут оказаться достаточно эффективными средствами дегидратационной терапии. С другой стороны, у больного с IV ФК ХСН, сообщающего о том, что он ежедневно принимает по 80 мг фуросемида без достаточного эффекта, пробовать применить 50 мг гипотиазида бессмысленно.
После достижения оптимальной дегидратации больного переходят к поддерживающей стадии лечения. В этот период количество выпитой жидкости не должно превышать объем выделяемой мочи (оптимально пациент должен выделять на 200 мл больше) и масса тела оставаться стабильной. Главным в этой фазе лечения является ежедневное применение подобранных мочегонных препаратов, позволяющих поддерживать стабильный диурез и массу тела больного. Практика назначения "ударных" доз мочегонных раз в несколько дней порочна и тяжело переносится больными. Лучше рекомендовать больному 12,5–25 мг гипотиазида в сутки, чем 40–80 мг лазикса 1 раз в 5 дней. В последнем случае пациент живет в порочном цикле: день приема диуретика он проводит около туалета из-за чрезмерно обильного диуреза. На второй день он полностью разбит, его мучит жажда, он страдает от электролитных потерь (вплоть до появления судорог). На третий день пациент начинает восстанавливаться. На четвертый он мог бы чувствовать себя бодрым, но за прошедшие три дня накопившаяся жидкость вновь вызывает гипергидратацию и одышку, что потребует на утро пятого дня повторения ударного диуреза. О каком высоком "качестве жизни" можно говорить при таком режиме диуретической терапии?
Характеристика рефрактерности к мочегонным
Поскольку, как уже говорилось, практически все современные диуретические препараты являются производными сульфомоильной кислоты, то имеются общие принципы развития рефрактерности (устойчивости) к терапии диуретиками и общие принципы выхода из создавшейся ситуации.
Принципиально, для того чтобы диуретик оказал свое действие, он должен:
1. Попасть в организм.
2. Абсорбироваться и попасть в кровоток.
3. Профильтроваться и попасть в почечные канальцы.
4. Активно влиять на специфические транспортеры (переносчики электролитов в апикальной мембране клеток почечных канальцев).
При появлении устойчивости к мочегонному препарату нарушается один или несколько указанных звеньев общего процесса. Например, при нарушении всасывания препарата мы можем сколько угодно повышать дозу мочегонного средства, назначаемого перорально, и не достигнуть успеха, а лишь перевод пациента на парентеральное диуретическое лечение обеспечит достижение адекватного диуретического ответа.
Причинами, которые приводят к рефрактерному отечному синдрому, являются:
1. Прогрессирование ХСН.
2. Появление и прогрессирование почечной недостаточности.
3. Гипотония.
4. Гиперактивация нейрогормональных систем.
5. Наличие дисбаланса электролитов и нарушения кислотно-щелочного состояния.
6. Дис- и гипопротеинемия.
7. Развитие толерантности к действию диуретика.
Эти процессы и модулируют нарушения на всех этапах от попадания диуретика в организм до достижения оптимального диуреза. Из-за отека слизистой желудка и кишечника диуретик плохо всасывается, из-за дис- и гипопротеинемии он недостаточно связывается с белками, из-за гипотонии и нарушения функции клубочков он плохо фильтруется, из-за длительного повторного применения самого диуретика развиваются электролитные, гормональные и кислотно-щелочные нарушения, при которых действие мочегонного препарата ослабевает.
Последний момент, связанный с опасностью развития рефрактерности к лечению мочегонными из-за их активного применения, почти не освещен в отечественной литературе. В то время как убедительно доказано, что имеются "ранняя" и "поздняя" рефрактерность к лечению мочегонными, связанные с изменениями в нефроне в ответ на активный диурез.
"Ранняя" рефрактерность получила название "торможение" и развивается буквально через несколько дней активной диуретической терапии. Причиной является резкая активация нейрогормонов (АII, альдостерона, катехоламинов, вазопрессина) и реакция на резко развивающуюся гиповолемию. Схема развития этого осложнения представлена на рис.10. Как видно, можно выделить два звена ранней рефрактерности – "ангиотензиновое" и "альдостероновое". Об особенностях влияния компонентов РААС мы уже говорили. В итоге происходит "рикошетная" задержка натрия, направленная на восстановление водного гомеостаза организма (Dormans и соавт.,1998; Brater, 1999). Опасность "ранней" рефрактерности тем выше, чем ретивее врач начинает дегидратировать своего пациента. Диурез с превышением количества мочи над выпитой жидкостью 2,5 л и более в сутки гарантирует получение "рикошетной" устойчивости к лечению. Для преодоления ранней рефрактерности необходимо сочетать мочегонные с ИАПФ. Причем в ответ на частое сетование врачей, что ИАПФ не всегда можно назначить тяжелому больному с ХСН из-за низкого уровня давления, имеются серьезные возражения. Специальные исследования показали, что даже крайне малые дозы ИАПФ (например 1,56 мг каптоприла или 1/16 стандартной таблетки в 25 мг) позволяют преодолевать рефрактерность к мочегонным и постепенно выводить пациентов из критического состояния (Motwani и соавт.,1992). Кроме того, как показали исследования нашей группы (М.О.Даниелян), влияние ИАПФ на прогноз больных с артериальным давлением (АД) ниже среднего составляло 35% (снижение риска смерти), в то время как у пациентов с АД выше среднего этот показатель составлял лишь 13%. Иными словами, эффект ИАПФ у гипотоников еще сильнее.
"Поздняя" рефрактерность к лечению мочегонными развивается спустя несколько месяцев непрерывного лечения и связана с гипертрофией эпителиальных клеток в ответ на постоянно повышенную абсорбцию электролитов (Kramer и соавт.,1999).
Преодоление рефрактерности к диуретикам
Для преодоления рефрактерности к лечению мочегонными средствами необходимо применять комплекс методов.
1. Строгое ограничение приема соли (а не жидкости!).
2. Назначение мочегонных средств только внутривенно.
3. Применение высоких доз мочегонных. Имеются сообщения о преодолении рефрактерности к терапии при назначении до 2000 мг лазикса. В особо сложных случаях рекомендуется болюсное введение лазикса внутривенно в дозе 40–80 мг с последующим капельным введением со скоростью 10–40 мг/ч в течение 48 ч.
4. Создание условий для нормализации давления:
- отказ от приема вазодилататоров, наиболее часто – это нитраты, назначаемые без показаний, лишь из-за диагноза ИБС;
- при необходимости использование стероидных гормонов (преднизолон внутривенно до 180–240 мг и перорально до 30 мг), кордиамина;
- в критических ситуациях применяется внутривенная капельная инфузия допамина с "почечной" скоростью 0,5–2,0 мг/кг/мин, длительностью до суток. В таком случае препарат за счет влияния на допаминергические рецепторы изолированно увеличивает почечную фракцию кровотока, клубочковую фильтрацию и несколько уменьшает проксимальную реабсорбцию. При увеличении длительности введения допамина, как и при повышении скорости инфузии, начинают преобладать другие эффекты препарата (стимуляция бета-1- и затем альфа-1-рецепторов), сопровождающиеся повышением АД и инотропным действием, которые позволяют поддерживать приемлемый уровень клубочковой фильтрации.
5. Нормализация нейрогормонального профиля (назначение ИАПФ и антагонистов альдостерона, также альдактона/верошпирона). Альдактон (верошпирон) лучше назначать утром, во время максимального циркадного подъема уровня альдостерона в дозе 200–300 мг/сут. Необходимо помнить, что назначенный перорально препарат начинает действовать лишь на 3-и сутки, поэтому в первые 2–3 дня препарат лучше вводить внутривенно.
6. Нормализация белкового профиля – применение альбумина (200–400 мл/сут), можно вместе с диуретиками, что увеличивает скорость их фильтрации.
7. При достаточном уровне АД возможно дополнительное назначение препаратов, увеличивающих скорость клубочковой фильтрации (положительные инотропные препараты, эуфиллин).
8. Комбинирование нескольких диуретиков. Мы уже говорили о целесообразности сочетания активных диуретиков с ингибиторами карбоангидразы, что позволяет избежать развития алкалоза, в условиях которого ослабевает действие тиазидных и петлевых диуретиков. Диакарб, во-первых, подкисляет мочу, а во-вторых, за счет нарушения реабсорбциии натрия в проксимальных канальцах сохраняет более высокую концентрацию этого иона в первичной моче. Из-за этого восходящая часть петли Генле в большей степени "загружается" ионами натрия и увеличивается субстрат для действия петлевых и тиазидных диуретиков.
Аналогично применение петлевых и тиазидных диуретиков усиливает поступление ионов натрия в дистальные канальцы, где действуют антагонисты альдостерона, и тем самым повышает эффективность применения верошпирона.
Это важное правило: назначение любого мочегонного препарата приводит к тому, что из-за нарушения реабсорбции натрия усиливается "загрузка" этим ионом более дистальных частей нефрона. В итоге потенцируется действие мочегонных препаратов, направленных на нижележащие канальцы.
Сочетанное применение активных диуретиков. Формально все три наиболее часто назначаемых в России петлевых диуретика – лазикс, урегит и буметанид – обладают высокой и приблизительно одинаковой диуретической активностью. Хотя в настоящее время в мире большое количество исследований рекомендует к применению относительно новый и, судя по литературе, наиболее сильный петлевой диуретик – торасемид, достаточного опыта по использованию этого препарата в России нет. Более того, в сознании отечественных врачей-терапевтов три петлевых диуретика ранжированы как наиболее сильный и часто применяемый – фуросемид, второй – урегит и третий, самый слабый – буметанид (буфенокс). Как уже говорилось, это не соответствует действительности. Недостатком урегита является отсутствие внутривенной формы. А вот буметанид имеет даже преимущества перед фуросемидом в фармакодинамике.
Тем не менее в реальной жизни устойчивость к лечению мочегонными определяется докторами при недостаточном мочегонном эффекте относительно высоких (до 240 мг внутривенно) доз лазикса. Оставляя в стороне дискуссию об истинности такой "рефрактерности" к лечению, можно констатировать, что подобная клиническая ситуация требует сочетания активных диуретиков.
Исходя из вышеизложенного правила, выгодным является сочетание петлевых диуретиков с тиазидными, которые блокируют реабсорбцию натрия на различных участках нефрона. Эта комбинация более оправдана, чем применение сочетания двух петлевых диуретиков, например фуросемида с урегитом или буфеноксом. Конечно, и комбинация двух петлевых диуретиков может позволить преодолеть толерантность к длительному использованию одного из них, но тиазидные диуретики действуют на более дистальные отделы нефрона и при комбинации лазикс + гипотиазид зона блокады реабсорбции натрия в канальцах расширяется. Кроме того, такая комбинация влияет на два различных транспортера электролитов в апикальных клетках канальцев.
Наиболее популярной в мире является комбинация лазикса с метолазоном. Как уже упоминалось, метолазон – самый липофильный и длительно действующий тиазидный диуретик, что обеспечивает дополнительную эффективность указанной комбинации, особенно при нарушении функции почек. Однако и сочетание петлевого диуретика (чаще всего лазикса) с гипотиазидом и, вероятно, с индапамидом (к сожалению, этот диуретик при ХСН не исследован) тоже может повысить эффективность дегидратационной терапии.
Особенности сочетанного действия мочегонных препаратов показаны на схеме на рис. 11. Представлен как бы развернутый каналец, в частности, те его зоны, где может происходить реабсорбция. Последовательно – проксимальный каналец, восходящая часть (толстая часть) петли Генле, нисходящий каналец. Степень реабсорбции показана стрелками, и чем их больше, тем ситуация, естественно, хуже. На верхней схеме показана ситуация, возникающая при назначении петлевых диуретиков коротким курсом. Как видно, реабсорбция в восходящей части петли Генле полностью блокирована, но на проксимальный и дистальный канальцы никакого влияния петлевые диуретики не оказывают. Когда лечение петлевыми диуретиками происходит в течение более длительного срока (вторая схема на рис.11), происходит рикошетная задержка жидкости. По-прежнему восходящая часть петли Генле непроницаема, но в дистальном канальце реабсорбция даже возрастает. Здесь работают два механизма. Первый – активация гормонов, а второй – непосредственное изменение эпителия дистального канальца. Если к лечению добавляются тиазидные диуретики (третья сверху схема на рис.11), то ситуация существенно улучшается – практически две трети нефрона защищены от возможности реабсорбции натрия и воды. Но применение такой мощной комбинации приводит к тому, что через 2–3 нед терапии у больного подщелачивается среда и эффект активных мочегонных ослабевает. Если в этом случае к лечению добавить ингибитор карбангидразы (ИКАГ) диакарб раз в 2–3 нед по 3 дня с последующим перерывом, удается добиться практически полной блокады реабсорбции натрия и воды в нефроне (нижняя схема на рис. 11).
Таким образом, оптимальный принцип сочетанной диуретической терапии при рефрактерном отечном синдроме у больных с ХСН подразумевает сочетание высоких доз лазикса, вводимого внутривенно с тиазидным диуретиком и верошпироном, а раз в 2 нед к терапии должен добавляться на 3–4 дня ингибитор карбоангидразы (диакарб).
В заключение следует отметить, что даже подобные меры не всегда позволяют преодолеть устойчивость к дегидратационной терапии. Тогда приходится прибегать к механическому удалению избыточной жидкости из полостей (плевральная, перикардиальная пункция и парацентез) или экстракорпоральным методам дегидратации (изолированная ультрафильтрация, гемодиализ).
Необходимо сказать, что дегидратационная терапия представляет собой одну из составляющих успешного лечения больных с сердечной недостаточностью. Следует помнить, что в развитии отечного синдрома задействованы сложные нейрогуморальные механизмы и бездумная дегидратация вызывает лишь побочные эффекты и рикошетную задержку жидкости. Применение мочегонных препаратов должно быть строго обоснованным, обязательно сочетаться с использованием нейрогуморальных модуляторов, таких как ИАПФ и антагонисты альдостерона, быть лишь одним из звеньев рациональной комбинированной терапии декомпенсированных больных.
Дата добавления: 2015-02-06 | Просмотры: 895 | Нарушение авторских прав
|


 Таким образом, в 60-е годы классикой в лечении ХСН стала считаться комбинация сердечного гликозида с диуретиком.
Таким образом, в 60-е годы классикой в лечении ХСН стала считаться комбинация сердечного гликозида с диуретиком. натрия с задержкой жидкости в организме.
натрия с задержкой жидкости в организме.


