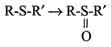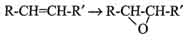|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
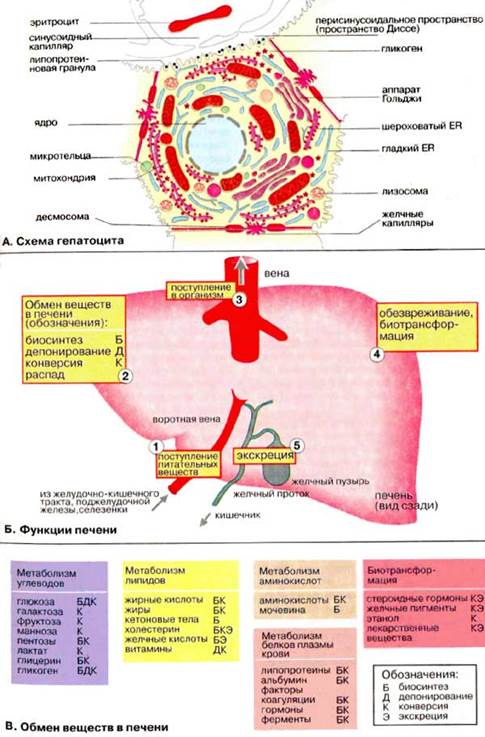
Печень: общие сведенияПечень — самый крупный орган в организме человека и животных; у взрослого человека она весит 1,5 кг. Хотя печень составляет 2-3% массы тела, на нее приходится от 20 до 30% потребляемого организмом кислорода. А. Схема гепатоцита Печень состоит примерно из 300 млрд клеток, 80% из которых составляют гепатоциты. Клетки печени занимают центральное место в реакциях промежуточного метаболизма. Поэтому в биохимическом отношении гепатоциты являются как бы прототипом всех остальных клеток.
Б. Функции печени Важнейшими функциями печени являются метаболическая, депонирующая, барьерная, экскреторная и гомеостатическая. Метаболическая. Продукты расщепления питательных веществ поступают в печень из пищеварительного тракта через воротную вену. В печени протекают сложные процессы обмена белков и аминокислот, липидов, углеводов, биологически активных веществ (гормонов, биогенных аминов и витаминов), микроэлементов, регуляция водного обмена. В печени синтезируются многие вещества (например, желчи), необходимые для функционирования других органов. Депонирующая. В печени происходит накопление углеводов (например, гликогена), белков, жиров, гормонов, витаминов, минеральных веществ. Из печени в организм постоянно поступают макроэргические соединения и структурные блоки, необходимые для синтеза сложных макромолекул. Барьерная. В печени осуществляется обезвреживание (биохимическая трансформация) чужеродных и токсичных соединений, поступивших с пищей или образовавшихся в кишечнике, а также токсических веществ экзогенного происхождения. Экскреторная. Из печени различные вещества эндо- и экзогенного происхождения либо поступают в желчные протоки и выводятся с желчью (более 40 соединений), либо попадают в кровь, откуда выводятся почками. Гомеостатическая. Печень выполняет важные функции по поддержанию постоянного состава крови (гомеостаза), обеспечивая синтез, накопление и выделение в кровь различных метаболитов, а также поглощение, трансформацию и экскрецию многих компонентов плазмы крови. В. Обмен веществ в печени Печень принимает участие в метаболизме почти всех классов веществ. Метаболизм углеводов. Глюкоза и другие моносахариды поступают в печень из плазмы крови. Здесь они превращаются в глюкозо-6-фосфат и другие продукты гликолиза. Затем глюкоза депонируется в виде резервного полисахарида гликогена или превращается в жирные кислоты. При снижении уровня глюкозы печень начинает поставлять глюкозу за счет мобилизации гликогена. Если запас гликогена оказывается исчерпанным, глюкоза может синтезироваться в процессе глюконеогенеза из таких предшественников, как лактат, пируват, глицерин или углеродный скелет аминокислот. Печень
лактат, пируват, глицерин или углеродный скелет аминокислот
Метаболизм липидов. Жирные кислоты синтезируются в печени из ацетатных блоков. Затем они включаются в состав жиров и фосфолипидов, которые поступают в кровь в форме липопротеинов. В то же время жирные кислоты поступают в печень из крови. Для энергообеспечения организма большое значение имеет свойство печени конвертировать жирные кислоты в кетоновые тела, которые затем вновь поступают в кровь. В печени идет синтез холестерина из ацетатных блоков. Затем холестерин в составе липопротеинов транспортируется в другие органы. Избыток холестерина превращается в желчные кислоты или выводится из организма с желчью.
Метаболизм аминокислот и белков. Уровень аминокислот в плазме крови регулируется печенью. Избыточные аминокислоты расщепляются, аммиак связывается в цикле мочевины, мочевина переносится в почки. Углеродный скелет аминокислот включается в промежуточный метаболизм как источник для синтеза глюкозы (глюконеогенез) или как источник энергии. Кроме того, в печени осуществляется синтез и расщепление многих белков плазмы крови. Печень
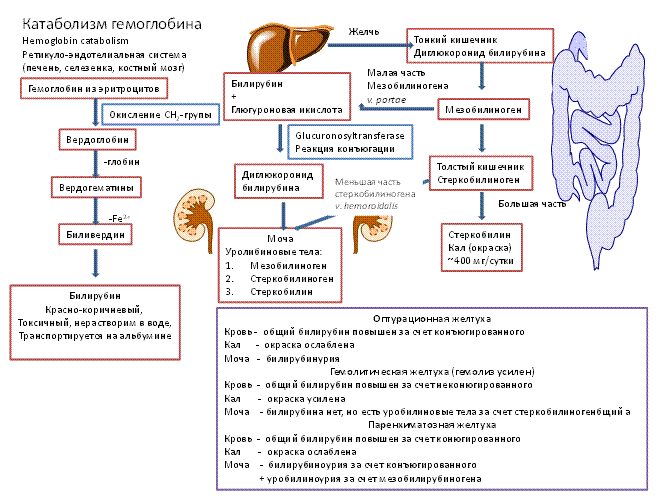
Биохимическая трансформация. Стероидные гормоны и билирубин, а также лекарственные вещества, этанол и другие ксенобиотики поступают в печень, где они инактивируются и конвертируются в высоко полярные соединения.
Депонирование. Печень служит местом депонирования энергетических резервов организма (содержание гликогена может достигать 20% массы печени) и веществ-предшественников; здесь также депонируются многие минеральные вещества, следовые элементы, ряд витаминов, в том числе железо (около 15% всего железа, содержащегося в организме), ретинол, витамины A, D, K, B12 и фолиевая кислота.
1. Микросомальное окисление На его долю приходится 5-10 % кислорода, поступающего в организм. АТФ во внемитохондриальном окислении никогда не образуется. Существуют 2 типа внемитохондриального окисления. Окисление оксидазного типа. Ферменты - оксидазы. По строению являются металлофлавопротеинами. Содержат металлы с переменной валентностью - железо(Fe), медь(Cu), молибден(Mo). Находятся оксидазы в пероксисомах - особых образованиях эндоплазматического ретикулюма, а также в наружной мембране митохондрий. Отнимают водород от субстрата и передают его на кислород с образованием Н2О2 - перекиси водорода. Оксидаз в клетке немного, и субстратов для них тоже мало. Эти ферменты обычно обладают широкой субстратной специфичностью и невысокой активностью.
1. Моноаминоксидазы (МАО) - окисляют гормон адреналин и некоторые биогенные амины. 2. Диаминоксидазы (ДАО) - окисляют гистамин и другие диамины и полиамины. 3. Оксидаза L-аминокислот. 4. Оксидаза D-аминокислот. Ксантиноксидаза - окисляет пуриновые азотистые основания (аденин и гуанин) с участием воды. Биологическое значение окисления по оксидазному типу: 1. окисляются трудноокисляемые циклические вещества; 2. быстрая инактивация БАВ - биологически активных веществ; 3. образующаяся Н2О2 оказывает бактерицидное действие - разрушает клеточные мембраны фагоцитированных бактериальных клеток. Окисление оксигеназного типа. Происходит на мембранах эндоплазматического ретикулума и во внутренней мембране митохондрий. Ферменты - оксигеназы. Они активируют молекулу кислорода, а затем внедряют один или два атома кислорода в молекулу окисляемого вещества. Оксигеназы, включающие один атом кислорода в окисляемое вещество, называются монооксигеназами (гидроксилазами). Оксигеназы, включающие два атома кислорода в окисляемое вещество, называются диаксигеназами. Оксигеназы работают в составе мультиферментного комплекса, встроенного в мембрану. Мультиферментный комплекс состоит из 3-х компонентов. 1. Флавиновые дегидрогеназы. Содержат ФАД. Наиболее обычный субстрат для них - НАДФН2. 2. Железо-серный белок. Содержит негеминовое железо с переменной валентностью. 3. Цитохром Р450. Его строение отличается от строения цитохромов цепи митоходриального окисления. Мультиферментный комплекс формирует цепь переноса электронов и протонов, в конце ее происходит активация кислорода. Активированный кислород присоединяется к активному центру цитохрома Р450, и на него переносятся электроны, а затем этот кислород включается в молекулу субстрата. Примеры реакций оксигеназного типа окисления. Монооксигеназы (гидроксилазы) включают в окисляемое вещество один атом кислорода из молекулы О2, а другой атом кислорода соединяется с двумя атомами водорода, отнятыми у какого-либо восстановителя (обычно - НАДФН2, реже - у других: например, у витамина С). Источник водорода - НАДФН2. Аскорбиновая кислота (витамин С), как восстановитель, участвует в работе пролингидроксилазы; этот фермент включает гидроксильные группы в аминокислотные остатки пролина в молекуле проколлагена. Поэтому зрелый коллаген приобретает большую механическую прочность. При недостатке (дефиците) витамина С в организме эти реакции протекают медленнее - соединительная ткань становится менее прочной. Высокоспецифичные гидроксилазы, включающие ОН-группу в молекулу холестерина, принимают участие в образовании стероидных гормонов (половых, коры надпочечников) - эти реакции идут во внутренней мембране митохондрий. Малоспецифичные гидроксилазы. Наиболее часто окисляют циклические гидрофобные вещества, чужеродные для организма - ксенобиотики (лекарственные препараты; компоненты растений; вещества, которыми загрязнена окружающая среда). Биологический смысл этих реакций: гидроксилирование ксенобиотика делает его более растворимым, ускоряется его выведение из организма - многие из этих реакций протекают в печени (детоксикация). Диоксигеназы включают оба атома молекулы кислорода в окисляемое вещество. Таким путем окисляются циклические трудноокисляемые структуры, реакции идут с разрывом цикла. Активные формы кислорода. Кислород - потенциально опасное вещество. Молекулярный кислород О2 и кислород в составе молекулы Н2О - стабильные соединения, химически инертные. Они стабильны, потому что внешняя электронная орбита укомплектована электронами. Полное восстановление кислорода происходит на заключительной стадии МтО. Химические соединения, в составе которых кислород имеет промежуточную степень окисления, имеют высокую реакционную способность и называются активными формами кислорода. Эти соединения образуются: 1. в монооксигеназных реакциях - супероксид-анион, который может отщепляться от активного центра цитохрома Р450; 2. в оксидазных реакциях - образуется пероксидный анион (присоединяя протоны, превращается в перекись водорода); 3. в дыхательной цепи МтО может происходить утечка электронов от каких-либо переносчиков - это явление наблюдается при реоксигенации ишемических тканей; 4. активные формы кислорода могут легко переходить друг в друга. Примеры таких переходов изображены на рисунках. Донорами электронов могут являться металлы переменной валентности. Наиболее химически активным соединением является гидроксильный радикал - сильнейший окислитель. Время его жизни очень короткое (1 миллиардная доля секунды), но за это время он мгновенно вступает в цепные окислительные реакции в месте своего образования. Супероксиданион и перекись водорода - более стабильные вещества, могут диффундировать от места образования, проникать через мембраны клеток. Гидроксильный радикал может вызывать неферментативное окисление аминокислотных остатков в белке (гистидина, цистеина, триптофана) - так могут инактивироваться многие ферменты, нарушается работа транспортных белков, происходит нарушение структуры азотистых оснований в нуклеиновых кислотах - страдает генетический аппарат клеток. Окисляются жирные кислоты в составе липидов клеточных мембран - нарушаются физико-химические свойства мембран - проницаемость, рецепторная функция, работа мембранных белков. Особенностью реакций с участием гидроксильных радикалов является их цепной характер (гидроксильный радикал не исчезает, а передается). Активные формы кислорода опасны для клетки, поэтому существуют защитные механизмы (например, в фагоцитах количество образовавшейся перекиси водорода увеличивается только в момент фагоцитоза). Инактивация активных форм кислорода в клетках происходит под действием антиоксидантной системы.
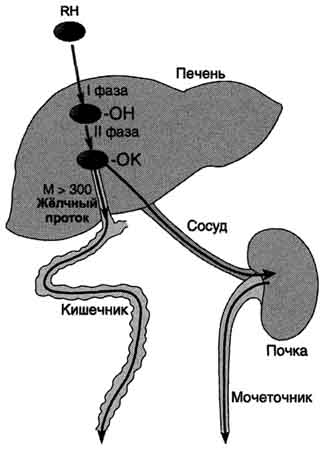
I. МЕХАНИЗМЫ ОБЕЗВРЕЖИВАНИЯ КСЕНОБИОТИКОВ Обезвреживание большинства ксенобиотиков происходит путём химической модификации и протекает в 2 фазы (рис. 12-1). В результате этой серии реакций ксенобиотики становятся более гидрофильными и выделяются с мочой. Вещества, более гидрофобные или обладающие большой молекулярной массой (>300 кД), чаще выводятся с жёлчью в кишечник и затем удаляются с фекалиями. Система обезвреживания включает множество разнообразных ферментов, под действием которых практически любой ксенобиотик может быть модифицирован. Микросомальные ферменты катализируют реакции С-гидроксилирования, N-гидроксилирования, О-, N-, S-дезалкилирования, окислительного дезаминирования, сульфоокисления и эпоксидирования (табл. 12-1). В мембранах ЭР практически всех тканей локализована система микросомального окисления (монооксигеназного окисления). В эксперименте при выделении ЭР из клеток мембрана распадается на части, каждая из которых образует замкнутый пузырёк - микросому, отсюда и название - микросомальное окисление. Эта система обеспечивает первую фазу обезвреживания большинства гидрофобных веществ.
Рис. 12-1. Метаболизм и выведение ксенобиотиков из организма. RH - ксенобиотик; К - группа, используемая при конъюгации (глутатион, глюкуронил и др.); М - молекулярная масса. Из множества цитохром Р450 - зависимых реакций на рисунке приведена только одна - схема гидроксилирования ксенобиотика. В ходе первой фазы в структуру вещества RH вводится полярная группа ОН-. Далее происходит реакция конъюгации; конъюгат в зависимости от растворимости и молекулярной массы удаляется либо почками, либо с фекалиями.
Таблица 12-1. Возможные модификации ксенобиотиков в первой фазе обезвреживания
В метаболизме ксенобиотиков могут принимать участие ферменты почек, лёгких, кожи и ЖКТ, но наиболее активны они в печени. К группе микросомальных ферментов относят специфические оксидазы, различные гидролазы и ферменты конъюгации. Вторая фаза - реакции конъюгации, в результате которых чужеродное вещество, модифицированное ферментными системами ЭР, связывается с эндогенными субстратами - глюкуроновой кислотой, серной кислотой, глицином, глутатионом. Образовавшийся конъюгат удаляется из организма. А. Микросомальное окисление Микросомальные оксидазы - ферменты, локализованные в мембранах гладкого ЭР, функционирующие в комплексе с двумя внемитохондриальными ЦПЭ. Ферменты, катализирующие восстановление одного атома молекулы О2 с образованием воды и включение другого атома кислорода в окисляемое вещество, получили название микросомальных оксидаз со смешанной функцией или микросомальных монооксигеназ. Окисление с участием монооксигеназ обычно изучают, используя препараты микросом. Дата добавления: 2015-11-25 | Просмотры: 943 | Нарушение авторских прав |




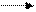 Глюкоза и другие моносахариды глюкозо-6-фосфат гликоген
Глюкоза и другие моносахариды глюкозо-6-фосфат гликоген


 Кровь Кетоновые тела
Кровь Кетоновые тела
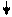



 Печень: AcSCoA ВЖК Жиры, Фосфолипиды, Липопротеины
Печень: AcSCoA ВЖК Жиры, Фосфолипиды, Липопротеины
 Холестерин Желчные кислоты Желчь
Холестерин Желчные кислоты Желчь

 Аминокислоты (избыточные и из белков плазмы крови) Аммиак Мочевина
Аминокислоты (избыточные и из белков плазмы крови) Аммиак Мочевина
 Кетокислоты Глюконеогенез Глюкоза
Кетокислоты Глюконеогенез Глюкоза