 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ЭЛЕМЕНТЫ ТЕОРИИОбщие сведения. Квазистатическим или равновесным процессом в термодинамике называют бесконечно медленный переход термодинамической системы из одного равновесного состояния в другое, при котором в любой момент времени физическое состояние системы бесконечно мало отличается от равновесного. Равновесие в системе при квазистатическом процессе устанавливается во много раз быстрее, чем происходит изменение физических параметров системы. Всякий квазистатический процесс является обратимым процессом. Термин «квазистатический процесс» предложен в 1909 г. немецким математиком К.Каратеодори. Направление протекания процессов в термодинамической системе описывается вторым началом термодинамики, которое известно в нескольких эквивалентных формулировках. Формулировка Клаузиуса (1850 г.): «Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому». Формулировка Томсона (1851 г.): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара». Первое начало термодинамики в дифференциальной форме имеет вид dQ = nCVdT + pdV. (1) Правая часть этого равенства не является полным дифференциалом, следовательно, количество теплоты Q не является функцией состояния. Разделив (1) на T, получим:
С помощью уравнения Клапейрона – Менделеева уравнение (2) можно записать в виде:
Правая часть равенства (3) является полным дифференциалом. Следовательно, левая часть, которая называется приведенным количеством теплоты, также полный дифференциал. Функция состояния, полный дифференциал которой равен dQ/T, называется энтропией и обозначается S:
В термодинамике понятие энтропии было введено Клаузиусом в 1865 г. Математически второе начало термодинамики можно записать с помощью равенства Клаузиуса
в соответствии с которым для термодинамической системы, совершающей квазистатический циклический процесс, интеграл от приведенного количества теплоты по всему циклу равен нулю. Изменение энтропии термодинамической системы при квазистатическом переходе из одного равновесного состояния в другое
Теория метода. Изменение энтропии стакана и цилиндра при релаксации, в соответствии с (6), равны соответственно
где t01 и t02, t1 и t2 – температуры стакана и цилиндра в начальный и в данный момент времени соответственно. Изменение энтропии стакана с цилиндром DS = DSs + DSc. (9) Для вычисления DS необходимо определить теплоемкость стакана, удельную теплоемкость цилиндра и его массу, начальную и конечную температуры стакана и цилиндра. Для измерения теплоемкости С стакана и удельной теплоемкости с цилиндра массой m сначала необходимо нагреть стакан, при этом цилиндр вынут из стакана и не нагревается. Затем цилиндр надо вставить в стакан и закрыть теплоизолирующей крышкой. Между цилиндром и стаканом происходит теплообмен, пока их температуры не станут одинаковы. При нагревании стакана количество теплоты, которое выделяет нагреватель, идет на нагревание стакана и частично рассеивается в воздухе. В начале процесса нагревания в течение некоторого промежутка времени Dt температура стакана растет по линейному закону. Пренебрегая потерями теплоты на этом интервале, можно определить теплоемкость стакана по формуле
где P – мощность нагревателя, Dt – изменение температуры стакана. Интервал времени Dt следует выбрать небольшим (1 – 2 мин).
При релаксации стакан с цилиндром находятся в термостате. При теплообмене между ними уравнение теплового баланса имеет вид: cmDt2 = -CDt1, (11) где Dt1 и Dt2 – изменения температуры стакана и цилиндра за один и тот же небольшой промежуток времени от начала релаксации (тепловые потери не учитываем). Отсюда находим удельную теплоемкость цилиндра
УПРАЖНЕНИЯ 1. Включить установку. 2. Когда на экране появится надпись «ENABLE», нажать клавишу «ВЫБОР» и выбрать стакан 2. 3. Выбрать максимальные температуру нагрева стакана и мощность нагревателя, после чего нажать клавишу «ВВОД». 4. Записать значения напряжения и силы тока. 5. После окончания процесса нагревания, следуя указаниям установки, вставить цилиндр в стакан и закрыть крышку. 6. После окончания измерений со стаканом 2 выполнить пункты 2 – 5 со стаканом 1. 7. После окончания измерений записать координаты точек графика, передвигая курсор клавишами “> <” (рис. 3) (или распечатать результаты на подключенном принтере). 8. По формулам (10), (12) вычислить теплоемкость стаканов и удельную теплоемкость цилиндров. 9. По формулам (7), (8), (9) для каждого стакана с цилиндром рассчитать изменение суммарной энтропии с течением времени. Построить график зависимости изменения суммарной энтропии от времени. Объяснить полученные результаты. Приложение: Масса латунного цилиндра - 604 г, Масса дюралевого цилиндра – 581 г.
КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Что называется теплоемкостью, удельной теплоемкостью тела? От чего зависят эти величины. 2. Что называется временем релаксации термодинамической системы? 3. Первое начало термодинамики. 4. Второе начало термодинамики. 5. Энтропия. 6. Равенство Клаузиуса. 7. Какие факторы влияют на точность измерений в данной работе?
ЛИТЕРАТУРА 1. Матвеев А.Н. Молекулярная физика. М.: Высш. шк., 1987. – 360 с. 2. Сивухин Д.В. Термодинамика и молекулярная физика. М.: Наука, 1990. – 592 с.
Дата добавления: 2015-11-26 | Просмотры: 294 | Нарушение авторских прав 12 |
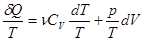 . (2)
. (2)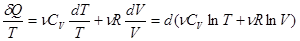 . (3)
. (3)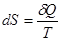 (4)
(4)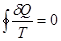 , (5)
, (5)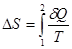 . (6)
. (6) . (7)
. (7) , (8)
, (8)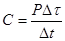 . (10)
. (10) . (12)
. (12)