 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
и т.д. (см. справочные данные)Осмотическая концентрация. Осмолярность. Осмоляльность Осмотическая концентрация — суммарная концентрация всех осмотически-активных частиц в растворе. Осмотическая концентрация выражаться как осмол яр ность (осмоль - рассчитывается на литр раствора) и как осмол яльн ость (осмоль - рассчитывается на кг растворителя). Осмотическую концентрацию растворов вычисляют по формуле:
M i - молекулярная масса растворенного вещества i; mi – количество растворенного вещества: если в 1 л раствора – то рассчитывают осмолярность; если в 1 кг растворителя – то осмоляльность; ki – число частиц или ионов, образующихся при растворении из одной молекулы вещества Так, если NaCl при растворении диссоциирует на Na+ и Cl -, и в разбавленных растворах диссоциирует нацело (α = 1), то осмолярность 1-молярного раствора NaCl составит 2 осмоль/л, в концентрированных растворах α может быть 0,8, тогда осмолярность 1- молярного раствора NaCl составит 1,6 осмоль/л.
Теоретически возможно рассчитать осмолярность лишь для простых разбавленных растворов (одно-, двухкомпонентных), и только в том случае, если известны константы диссоциации и механизмы диссоциации растворяемых веществ. В растворах сложного состава, многокомпонентных, а также при высоких концентрациях растворяемые вещества могут влиять на диссоциацию друг друга, в настоящее время это влияние прогнозировать сложно, практически невозможно. Фактическая осмолярность понижается по сравнению с теоретически рассчитанной. В таких случаях, а также для растворов новых, малоизученных ЛВ осмолярность определяют экспериментально. ГФ РБ регламентирует экспериментальное определение осмолярности (осмоляльности). Осмометрия
От осмотической концентрации (осмолярности/осмоляльности) зависят так называемые каллигативные свойства растворов (свойства, зависящие от числа частиц в растворенном веществе и не зависящие от его природы): - осмотическое давление, - повышение точки начала кипения (чем выше осмолярность, тем выше температура кипения), - понижение температуры начала кристаллизации (чем выше осмолярность, тем ниже температура замерзания раствора),
Повышение температуры начала кипения раствора по сравнению с чистым растворителем (ΔТ кип) и понижение температуры начала замерзания (ΔТзам) обусловлено понижением давления пара растворителя (водяных паров в случае водных растворов) над раствором. Повышение пропорционально мольной доле растворенного вещества. ΔТ кип = К кип С, где К кип - эбуллиоскопическая констаната растворителя, показывает, на сколько градусов повысится температура кипения раствора, если в 1000 г растворителя внести 1 моль вещества; С – моляльная концентрация, выраженная в молях растворенного вещества в 1000 г растворителя Измерения с применением этого метода назывют эбуллиоскопией (от латинского ebullire – выкипать). Эбуллиоскопия менее точна по сравнению с криоскопией, так как эбуллиоскопические константы К кип (для воды = 0,51°), как правило, меньше криоскопических К зам. В этой связи именно криоскопический метод считается более точным в измерении осмоляльности: ΔТзам = Кзам·С, где ΔТзам – понижение температуры начала кристаллизации раствора по сравнению с чистым растворителем, эту величину называют температурной депрессией кристаллизации. Для плазмы крови Δ Т зам = 0,52°. С – моляльная концентрация, выраженная в молях растворенного вещества в 1000 г растворителя; Кзам – криоскопическая константа растворителя (замерзания). Показывает, на сколько градусов понизится температура замерзания раствора, если в 1000 г растворителя внести 1 моль вещества. Для воды Кзам = 1,86°.
Таким образом, измерив температурную депрессию кристаллизации ( ГФ РБ: замерзания) раствора ΔТзам, можно рассчитать осмоляльность водного раствора по формуле: OSM = 1000 · Δ Т зам/1,86° (мОсмоль/кг) Температурную депрессию замерзания раствора согласно ГФ РБ определяют с помощью аналитических приборов - осмометров. Миллиосмометр-криоскоп термоэлектрический МТ-5 - аналитический прибор, предназначенный для измерения методом криоскопии осмотических концентраций биологических жидкостей и водных растворов, а также для измерения температур замерзания, соответствующих этим концентрациям. Прибор работает в автоматическом режиме. Управление осуществляется с помощью встроенного микроконтроллера. Составные части: - Приспособление для охлаждения измерительной кюветы - Система измерения температуры (по силе тока или разности потенциалов). Измерительное устройство м.б. градуировано непосредственно в единицах осмоляльности, либо в град. понижения температуры (град.температурной депрессии). Миллиосмометры-криоскопы МТ-5 могут быть рекомендованы для использования в аналитических лабораториях с целью анализа качества лекарственных препаратов, как при их производстве, так и в процессе контроля, в соответствии с ОФС, ФС и ФСП.
Дата добавления: 2015-11-28 | Просмотры: 429 | Нарушение авторских прав |
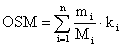 , где
, где