|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Гормони надниркових залозНадниркові залози розташовуються на верхніх полюсах нирок і фактично являють собою поєднання в одному анатомічному утворі двох самостійних залоз: мозкової речовини, що становить внутрішню частину органа, і зовнішнього шару – кори. Обидві структури відрізняються за своєю будовою та продукують різні гормони. 9.9.1. Гормони мозкової речовини надниркових залоз. Мозкова речовина надниркових залоз є похідним нервової тканини та складається з хромафінних клітин, які виробляють дві біологічно активні сполуки з гормональною активністю – адреналін (80 %) і норадреналін (10 – 20 %). Ці гормони, як і близькі до них аміни, що містять в своїй структурі катехолове ядро, мають загальну назву катехоламіни.
Безпосереднім попередником катехоламінів є тирозин (рис. 9.12). Їх синтез відбувається в цитоплазмі та гранулах клітин мозкового шару надниркових залоз; у гранулах також відбувається зберігання катехоламінів, куди вони потрапляють з цитоплазми шляхом АТФ-залежного транспорту та зберігаються в комплексі з АТФ (на 4 молекули гормона припадає 1 молекула АТФ). Вивільнення гормонів із гранул відбувається шляхом екзоцитозу. У плазмі крові гормони утворюють нестійкі комплекси з альбумінами. Концентрація адреналіну в плазмі крові біля 0,05 мкг/л, а норадреналіну — у чотири рази вища (0,2 мкг/л). Стрес підвищує вміст катехоламінів у 4 – 8 разів. Катехоламіни інактивуються шляхом зворотного захоплення нервовими закінченнями, або внаслідок метаболічних перетворень, що відбуваються в постсинаптичних клітинах, а також в печінці. Продукти метаболізму катехоламінів виділяються з сечею як у вільному стані, так і у вигляді парних сполук. Основними мішенями адреналіну та норадреналіну є серце, печінка, мозок, скелетні м'язи та гладкі м’язи судин, бронхів, матки, травного тракту. Катехоламіни діють через два класи глікопротеїнових рецепторів: α- і β-адренергічні. Вони є продуктами різних генів, різняться спорідненістю до агоністів і антагоністів і передають сигнали в клітини за допомогою різних посередників. Так, адреналін зв'язується як з α-, так і з β-рецепторами, тоді як норадреналін у фізіологічних концентраціях зв'язується здебільшого з a-адренорецепторами. Взаємодія гормонів з b1- та b2-рецепторами призводить до активації аденілатциклази та підвищення рівня цАМФ, тоді як зв'язування з a2-рецепторами інгібує її і знижує вміст цАМФ у клітині. При взаємодії гормонів з a1-рецепторами відбувається активування фосфоліпази С, збільшення внутрішньоклітинної концентрації Са2+ або продуктів метаболізму фосфатидилінозитолу (або те й інше). Збільшення внутрішньоклітинної концентрації цАМФ, що утворюється в клітинах-мішенях при взаємодії адреналіну з b1- та b2-рецепторами, зумовлює різні його ефекти: у м'язах і, меншою мірою, у печінці гормон через цАМФ-залежний механізм стимулює розпад глікогену, активуючи фосфорилазний каскад, що призводить до підвищення рівня глюкози в крові та посиленого утворення в м'язах молочної кислоти. Норадреналін, на відміну від адреналіну, незначно впливає на вуглеводний обмін. У жировій тканині адреналін, шляхом взаємодії з b1-рецепторами, стимулює ліполіз (через аденілатциклазну систему активується (фосфоризується) ліпаза). Це призводить до зростання концентрації вільних жирних кислот і гліцерину в крові. Адипоцити крім b1-, мають також і a2-рецептори, які опосередковують антиліполітичний ефект. Гіперадреналінемія супроводжується посиленим розпадом білків і підвищеним виведенням кінцевих продуктів азотистого обміну (особливо креатину) з сечею. Отже, дія катехоламінів (як і всієї симпатоадреналової системи) спрямована на швидку додаткову мобілізацію енергії в умовах гострого стресу і забезпечує готовність організму до захисних реакцій. Суттєвий вплив катехоламіни чинять і на серцево-судинну систему. Через b1-рецептори вони збільшують силу та частоту серцевих скорочень, хвилинний об'єм серця, що призводить до підвищення артеріального тиску. Адреналін розширює коронарні судини. Діючи через b2-рецептори, він виявляє потужну бронхорозширювальну дію, тоді як норадреналін відрізняється менш вираженим бронхолітичним ефектом. Обидва гормони викликають звуження судин черевної порожнини, шкіри та слизових оболонок. 9.9.2. Гормони кіркової речовини надниркових залоз (кортикостероїди). Кіркова речовина надниркових залоз продукуєпонад 40 різних стероїдів. Ті з них, які володіють біологічною активністю, об’єднують у 3 класи: глюкокортикоїди (С21-стероїди) відіграють суттєву роль в адаптації організму до стресу, основний представник – кортизон; мінералокортикоїди (С21-стероїди) необхідні для підтримання рівня Nа+ та К+, основний представник - альдостерон; андрогени (С19-стероїди), основний представник - тестостерон.
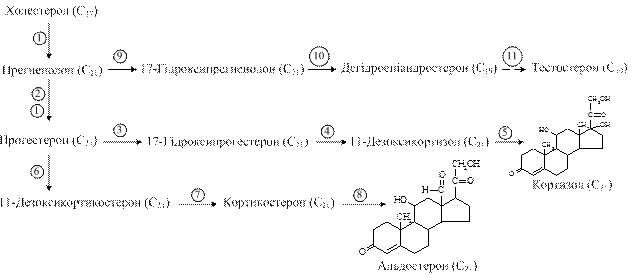
Кортизол синтезується з холестеролу, який надходить з крові в складі ЛПНЩ або синтезується в клітинах з ацетил-КоА (рис. 9.13). Швидкість синтезу та секреції цього гормона стимулюється у відповідь на стрес, травму, інфекцію, зниження концентрації глюкози в крові; збільшення концентрації пригнічує синтез кортиколіберину та АКТГ за механізмом негативного зворотного зв’язку. При тривалій дії АКТГ на клітини надниркових залоз спостерігаються гіпертрофія і проліферація клітин залоз.
рис. 9.13. Основні етапи синтезу кортикостероїдів: 1 – перетворення холестеролу на прегненолон (1 – гідроксилаза); 2 – утворення прогестерону (2 – 3-b-гідроксистероїддегідрогеназа); 3, 4, 5 – реакції синтезу кортизолу (3 – 17-гідроксилаза, 4 – 21-гідроксилаза, 5 – 11-гідроксилаза); 6, 7, 8 – шлях синтезу альдостерону (6 – 21-гідроксилаза, 7 – 11-гідроксилаза, 8 – 18-гідроксилаза, 18-гідроксидегідрогеназа); 9, 10, 11 – шлях синтезу тестостерону (9 – 17-гідроксилаза, 10 – 17,20-ліаза, 11 – дегідрогеназа)
Синтез мінералокортикоїдів у клітинах клубочкової зони теж розпочинається з холестеролу, основним стимулятором цього процесу є ангіотензин ІІ, який збільшує проникність мембран клітин кори надниркових залоз для іонів Са2+. Низький вміст іонів Nа+ або підвищення концентрації іонів К+ у сироватці крові посилює синтез і секрецію цього мінералокортикоїду. Кортизол і кортикостерон в плазмі зв'язуються зі специфічним α-глобуліном крові -транскортином. Невелика кількість кортизолу може зв'язуватися з альбуміном. Альдостерон транспортується переважно альбуміном. Метаболізм стероїдних гормонів здійснюється в печінці, нирках, кишці та інших тканинах. Органами-мішенями для глюкокортикоїдів є печінка, нирки, лімфоїдна тканина, сполучна тканина (кістки, жирова тканина тощо), скелетні м'язи. Глюкокортикоїди прямо або опосередковано регулюють практично всі фізіологічні та біохімічні процеси в організмі, однак в їх дії умовно можна виділити наступні основні напрями впливу: 1) на метаболізм вуглеводів, ліпідів і білків; 2) на метаболізм електролітів і води; 3) на імунну відповідь організму; 4) на запальні процеси; 5) на стійкість до пошкоджуючих факторів. Дія глюкокортикоїдів на метаболізм вуглеводів характеризується стимулюванням утворення глюкози та досягається: 1) збільшенням швидкості глюконеогенезу в печінці і нирках; 2) стимуляцією вивільнення амінокислот (субстрат глюконеогенезу) з периферійних тканин (м'язової, лімфоїдної); 3) гальмуванням використання глюкози у позапечінкових тканинах (м'язах, жировій і лімфоїдній тканинах). Сигналом для стимуляції глюконеогенезу служить зниження концентрації глюкози в крові. Однак цей сигнал діє не безпосередньо на надниркові залози, а через гіпоталамо-гіпофізарну систему. Посилення глюкокортикоїдами глюконеогенезу відбувається шляхом стимуляції синтезу його ферментів — фосфоенолпіруваткарбоксикінази і глюкозо-6-фосфатази. Утворена в процесі глюконеогенезу, глюкоза використовується на синтез глікогену в печінці. На обмін білків і нуклеїнових кислот глюкокортикоїди впливають протилежним чином у різних типах тканин. Так, у печінці вони стимулюють синтез білків (зокрема, ферментів процесу глюконеогенезу), і синтез РНК, а в інших органах, таких як м'язи, шкіра, лімфоїдна і жирова тканини, кістки, навпаки, гальмують синтез білків, а в деяких (лімфоїдна тканина, м'язи) навіть викликають їх розпад. Глюкокортикоїди також знижують швидкість синтезу РНК в периферійних тканинах (особливо в лімфоїдній і м'язовій). Такий характер дії глюкокортикоїдів збільшує концентрацію вільних амінокислот у плазмі і цим створює оптимальні умови для глюконеогенезу. Посиленню процесу глюконеогенезу сприяє активація гормонами амінотрансфераз, що призводить до швидкого перетворення амінокислот на кетокислоти та вуглеводи. Посилення деградації амінокислот призводить до негативного азотистого балансу. Надмірна концентрація глюкокортикоїдів викликає гальмування росту та поділу фібробластів, а також синтез колагену та фібронектину. Вплив глюкокортикоїдів на обмін ліпідів у печінці і в периферійних тканинах також носить протилежний характер: надмірна кількість гормонів стимулює ліпогенез у печінці та ліполіз в периферійних тканинах. Посилення ліполізу в жировій тканині призводить до збільшення рівня вільних жирних кислот у плазмі крові, що пов'язано з прямою стимуляцією ліполізу, і зниженням споживання глюкози жировою тканиною для утворення гліцерину, що гальмує синтез триацилгліцеринів і вивільняє жирні кислоти в плазму. У результаті посилюється їх окиснення в печінці, забезпечуються її енергетичні потреби, а надлишок ацетил-КоА використовується в кетогенезі, утворені кетонові тіла поступають в кров. Крім прямого впливу глюкокортикоїдів на обмін ліпідів, гормони через цАМФ посилюють ліполітичну дію катехоламінів, секреція яких підвищується глюкокортикоїдами. Наводно-електролітний обмін глюкокортикоїди мають подібну до мінералокортикоїдів дію, але виражена вона меншою мірою. У високій концентрації глюкокортикоїди пригнічують імунну відповідь організму, що пов'язано з їхньою здатністю зменшувати кількість лімфоцитів і викликати інволюцію лімфоїдної тканини. Вони пригнічують запальні процеси шляхом індукції синтезу ліпокортинів, котрі, своєю чергою, інгібують фосфоліпазу С, знижуючи в такий спосіб синтез медіаторів запалення – простагландинів і лейкотрієнів. Мінералокортикоїди стимулюють реабсорбцію Na+, Сl- і Н2СО3 у дистальних канальцях нирок і, одночасно, екскрецію іонів калію. Вони сприяють секреції К+, NН4+ у нирках, слинних і потових залозах, слизовій оболонці дистальних відділів товстої кишки. Як і інші стероїдні гормони, альдостерон стимулює синтез у клітинах-мішенях невеликої кількості мРНК і, відповідно, білків, деякі з цих білків, вірогідно, сприяють перебудові мембрани та підвищенню ефективності роботи мембранних переносників натрію (пермеази). Альдостерон індукує синтез мітохондріальних ферментів, що забезпечує енергією посилений транспорт Na+, і Nа+, К+-АТФази, яка відкачує іони натрію з епітеліальних клітин канальців у міжклітинну рідину. Таким чином, ефект альдостерону не проявляється негайно, а через певний час, досягаючи максимуму через декілька годин. Альдостерон об'єднують в єдину систему з реніном і ангіотензином, які є ключовими в регуляції синтезу та секреції цього мінералокортикоїда, про що буде описано в розділі «Обмін води та мінеральних речовин». 9.9.3. Зміни метаболізму при гіпер- і гіпофункції кори надниркових залоз. Захворювання кори надниркових залоз можуть проявлятися симптомами як гіпер-, так і гіпопродукції гормонів. Гіперпродукція глюкокортикоїдів (гіперкортицизм) може бути наслідком зростання рівня АКТГ при пухлинах гіпофіза (хворобаІценка-Кушінга) або пухлинах інших клітин (бронхів, тимусу, підшлункової залози), які виробляють кортикотропінподібні речовини, або надлишкового синтезу кортизолу при гормонально-активних пухлинах кори надниркових залоз (синдром Іценка-Кушінга). При хворобі Іценка-Кушінга знижується толерантність до глюкози, виникає гіперглікемія й інші симптоми, що характеризують розвиток стероїдного діабету. Різке посилення катаболізму білків призводить до зменшення м'язової маси, витончення шкіри та негативного азотистого балансу. Характерним проявом гіперкортицизму є остеопороз – зміна мінерального складу кісткової тканини, внаслідок чого різко знижується міцність кістки. Це може бути наслідком інгібування кортизолом активності деяких ферментів, що беруть участь в утворенні колагену і глікозаміногліканів, в зв'язку з чим порушується синтез колагену в кістках. Для цієї патології характерний своєрідний перерозподіл відкладення жиру – місяцеподібне обличчя, виступаючий живіт. При синдромі Іценка-Кушінга у пацієнтів розвивається множинний карієс, зумовлений пригніченням імунної системи підвищеним умістом глюкокортикоїдів і зниженням місцевого імунітету. Глюкокортикоїди знижують запальну реакцію й ексудацію, зменшують еміграцію нейтрофілів та лімфоцитів у вогнище запалення та фагоцитарну активність. При гіперкортицизмі розвитку карієсу зубів сприяє втрата організмом іонів калію та кальцію, що призводить до демінералізації зубів. Оскільки глюкокортикоїди знижують швидкість репаративних процесів, при хірургічних втручаннях у порожнині рота таких пацієнтів пригнічуються процеси загоєння ран після видалення зубів. пригнічення імунної відповіді, насамперед Т-клітинної, а також гуморального імунітету супроводжується розвитком у порожнині рота кандидомікозів. Гіпопродукція гормонів кори надниркових залоз може проявлятися первинною (хвороба Аддісона) або вторинною наднирниковою недостатністю. Первинна виникає внаслідок туберкульозу або автоімунних процесів і клінічно проявляється зниженням маси тіла, загальною слабкістю, погіршенням апетиту. Блюванням, зниженням артеріального тиску та типовою гіперпігментацією шкіри («бронзова хвороба»). Причиною якої є зростання продукції ПОМК – попередника АКТГ і меланоцитстимулівного гомону. Втринна наднирникова недостатність може виникати внаслідок дефіциту АКТГ внаслідок пухлини чи інфекційного ураження гіпофіза і проявляється тими ж клінічними ознаками, що й первинна (за виключенням гіперпігментації). Гіперальдостеронізм (хвороба Конна) – захворювання, викликане гіперсекрецією альдостерону наднирковими залозами, яке виникає, зазвичай, внаслідок розвитку аденоми надниркових залоз. При первинному гіперальдостеронізмі надлишок альдостерону посилює реабсорбцію натрію в ниркових канальцях. Відповідно, збільшення концентрації Nа+ у плазмі є стимулом для секреції АДГ і затримки води нирками. Паралельно посилюється виведення іонів калію, магнію та протонів. Розвивається гіпернатріємія, яка спричинює розвиток гіпертонії, гіперволемії та набряків. Гіпокаліємія, своєю чергою, викликає м’язову слабкість. Виникає метаболічний алкалоз. Вторинний гіперальдостеронізм зустрічається значно частіше і є наслідком низки станів: серцевої недостатності, хронічного захворювання нирок, пухлин, які секретують ренін і супроводжуються порушенням кровообігу. У таких хворих спостерігають підвищений рівень реніну та ангіотензину ІІ, що стимулює кору надниркових залоз продукувати та секретувати надлишкову кількість альдостерону. Дата добавления: 2015-11-28 | Просмотры: 1082 | Нарушение авторских прав |
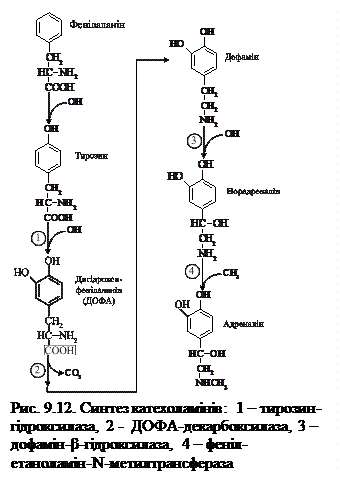 Ще один представник катехоламінів – нейромедіатор дофамін – є проміжним продуктом біосинтезу адреналіну та норадреналіну як у мозковій речовині надниркових залоз, так і в нервових клітинах.
Ще один представник катехоламінів – нейромедіатор дофамін – є проміжним продуктом біосинтезу адреналіну та норадреналіну як у мозковій речовині надниркових залоз, так і в нервових клітинах.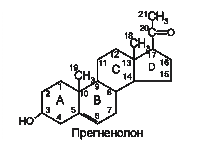 В основі структури всіх стероїдних гормонів лежить циклопентанпергідрофенантрен. У мітохондріях з холестеролу, який надходить з крові, утворюється прегненолон, подальше перетворення якого відбувається під впливом різних гідроксилаз за участі молекулярного кисню та НАДФН, а також дегідрогеназ, ізомераз і ліаз. Яким саме стероїдом виявиться кінцевий продукт, залежить від набору ферментів у клітині та послідовності реакцій гідроксилування, оскільки в корі надниркових залоз розрізняють три типи клітин, які формують три шари – клубочковий, пучковий і сітчастий. Так, наприклад, ферменти для синтезу альдостерону присутні лише в клітинах клубочового шару, а ферменти синтезу глюкокортикоїдів і андрогенів – у пучковому та сітчастому шарах.
В основі структури всіх стероїдних гормонів лежить циклопентанпергідрофенантрен. У мітохондріях з холестеролу, який надходить з крові, утворюється прегненолон, подальше перетворення якого відбувається під впливом різних гідроксилаз за участі молекулярного кисню та НАДФН, а також дегідрогеназ, ізомераз і ліаз. Яким саме стероїдом виявиться кінцевий продукт, залежить від набору ферментів у клітині та послідовності реакцій гідроксилування, оскільки в корі надниркових залоз розрізняють три типи клітин, які формують три шари – клубочковий, пучковий і сітчастий. Так, наприклад, ферменти для синтезу альдостерону присутні лише в клітинах клубочового шару, а ферменти синтезу глюкокортикоїдів і андрогенів – у пучковому та сітчастому шарах.