|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
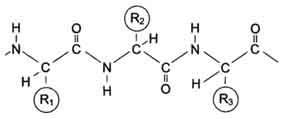
Схема Б. Строение пептидовСер-Гис-Про-Ала и Ала-Про-Гис-Сер - два разных пептида, несмотря на то, что они имеют одинаковые количественный и качественный составы аминокислот. 2.Характеристика пептидной связи Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу (рис. 1-1). Связь между?-углеродным атомом и?-аминогруппой или?-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации. Пептидные связи обычно расположены в транс-конфигурации, т.е.?-углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве (рис. 1-2). Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, существующих в клетках (нейтральная среда, температура тела). В лабораторных условиях гидролиз пептидных связей белков проводят в запаянной ампуле с концентрированной (6 моль/л) соляной кислотой, при температуре более 105 °С, причём полный гидролиз белка до свободных аминокислот проходит примерно за сутки. В живых организмах пептидные связи в белках разрываются с помощью специальных протеолитических ферментов (от англ, protein - белок, lysis - разрушение), называемых также протеазами, или пептидгидролазами. Для обнаружения в растворе белков и пептидов, а также для их количественного определения используют биуретовую реакцию (положительный результат для веществ, содержащих в своём составе не менее двух пептидных связей). 3.Биологическая роль пептидов В организме человека вырабатывается множество пептидов, участвующих в регуляции различных биологических процессов и обладающих высокой физиологической активностью.
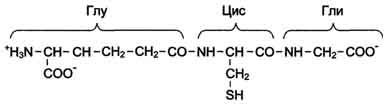
Рис. 1-2. Транс-конфигурация пептидных связей. Функциональные группы -СО- и -NH-, образующие пептидные связи, не ионизированы, но полярны, и могут участвовать в образовании водородных связей. Количество аминокислотных остатков в структуре биологически активных пептидов может варьировать от 3 до 50. К одним из самых "маленьких" пептидов можно отнести ти-реотропин-рилизинг-гормон и глутатион (трипептиды), а также энкефалины, имеющие в своём составе 5 аминокислот. Однако большинство биологически активных пептидов имеет в своём составе более 10 аминокислот, например нейропептид Y (регулятор аппетита) содержит 36 аминокислот, а кортиколиберин - 41 аминокислоту. Некоторые из пептидов, в частности большинство пептидных гормонов, содержат пептидные связи, образованные а-аминогруппой и а-карбоксильной группой соседних аминокислот. Как правило, они синтезируются из неактивных белковых предшественников, в которых специфические протеолитические ферменты разрушают определённые пептидные связи. Ангиотензин II - октапептид, образующийся из крупного белка плазмы крови ангиотензиногена в результате последовательного действия двух протеолитических ферментов. Первый протеолитический фермент ренин отщепляет от ангиотензиногена с N-конца пептид, содержащий 10 аминокислот, называемый ангиотензином I. Второй протеолитический фермент карбоксидипептидилпептидаза отщепляет от С-конца ангиотензина I 2 аминокислоты, в результате чего образуется биологически активный ангиотензин II, участвующий в регуляции АД и водно-солевого обмена в организме (см. схему А). Однако в некоторых биологически активных пептидах могут содержаться либо необычные аминокислоты, либо существовать необычные связи между аминокислотами, не встречающиеся в белках. Пример пептида, содержащего необычную для белков связь между аминокислотами, - трипептид глутатион, построенный из глутамата, цистеина и глицина (см. схему Б). N-концевая аминокислота глутамат связана со второй аминокислотой цистеином не через?-карбоксильную группу, а через?-карбоксильную группу его радикала. Глутатион - широко распространённый пептид организма человека. Он может быть использован в окислительно-восстановительных реакциях как донор и акцептор водорода и необходим для работы ряда ферментов. Функции пептидов зависят от их первичной структуры. Ангиотензин I по структуре очень похож на ангиотензин II (имеет только две дополнительные аминокислоты с С-конца), но при этом не обладает биологической активностью. Изменение в аминокислотном составе пептидов часто приводит к потере одних и возникновению других биологических свойств. В качестве примера можно рассмотреть структуру и свойства двух пептидных гормонов - окситоцина и вазопрессина. В гипоталамусе окситоцин и вазопрессин образуются в результате частичного (ограниченного) протеолиза более крупных белковых предшественников. Из гипоталамуса по нервным волокнам эти гормоны внутри секреторных гранул перемещаются в нервные окончания аксонов, находящихся в задней доле гипофиза. После действия специфических стимулов эти гормоны выделяются в кровь (см. схему А на с. 13).
Схема А
Дата добавления: 2015-12-15 | Просмотры: 686 | Нарушение авторских прав |