|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
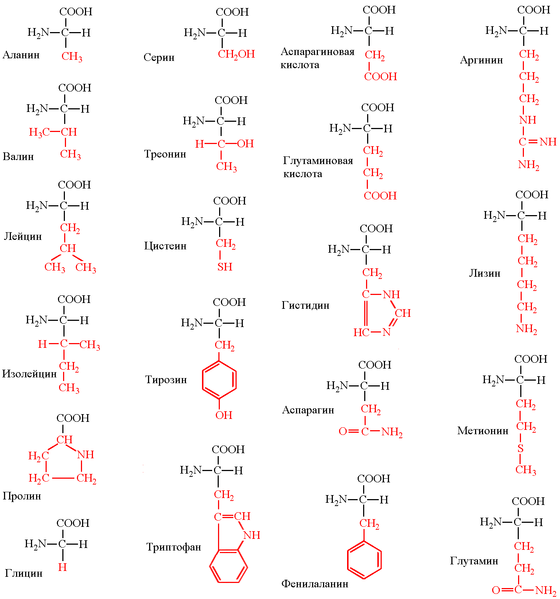
По функциональным группам· Алифатические · Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин · Оксимоноаминокарбоновые: серин, треонин · Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд · Амиды моноаминодикарбоновых: аспарагин, глутамин · Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд · Серосодержащие: цистеин, метионин · Ароматические: фенилаланин, тирозин, триптофан, (гистидин) · Гетероциклические: триптофан, гистидин, пролин · Иминокислоты: пролин
Глицин входит в состав многих белков и биологически активных соединений. Из глицина в живых клетках синтезируются порфирины и пуриновые основания. Химическая формула: NH 2 —CH 2 —COOH Глицин также является нейромедиаторной аминокислотой, проявляющей двоякое действие. Рецепторы к глицину имеются во многих участкахголовного мозга и спинного мозга. Связываясь с рецепторами (кодируемые генами GLRA1, GLRA2, GLRA3 и GLRB), глицин вызывает «тормозящее» воздействие на нейроны, уменьшают выделение из нейронов «возбуждающих» аминокислот, таких, как глутаминовая кислота, и повышают выделение ГАМК. Также глицин связывается со специфическими сайтами NMDA-рецепторов и, таким образом, способствует передаче сигнала от возбуждающих нейротрансмиттеров глутамата и аспартата.[1] В спинном мозге глицин приводит к торможению мотонейронов, что позволяет использовать глицин в неврологической практике для устранения повышенного мышечного тонуса.
Лейцин входит в состав всех природных белков, применяется для лечения болезней печени, анемий и других заболеваний.
L- тирозин является протеиногенной аминокислотой и входит в состав белков всех известных живых организмов. Тирозин входит в составферментов, во многих из которых именно тирозину отведена ключевая роль в ферментативной активности и её регуляции. Местом атаки фосфорилирующих ферментов протеинкиназ часто является именно фенольный гидроксил остатков тирозина. Остаток тирозина в составе белков может подвергаться и другим посттрансляционным модификациям. В некоторых белках (резилин насекомых) присутствуют молекулярные сшивки, возникающие в результате посттрансляционной окислительной конденсации остатков тирозина с образованием дитирозина и тритирозина. Тирозин подавляет аппетит, способствует уменьшению отложения жиров, способствует выработке меланина и улучшает функции надпочечников, щитовидной железы и гипофиза.
Серин участвует в образовании активных центров ряда ферментов (эстераз, пептидгидролаз), обеспечивая их функцию. Протеолитические ферменты, активные центры которых содержат серин, играющий важную роль при выполнении каталитической функции, относят к отдельному классу сериновых пептидаз. Действие некоторых фосфорорганических соединений основано на необратимом присоединении молекулы яда к OH- группам остатков серина, приводящему к полному ингибированию каталитической активности ферментов. Токсический эффект прежде всего связан с ингибированием ацетилхолинэстеразы. Фосфорилирование остатков серина в составе белков имеет важное значение в механизмах межклеточной передачи сигналов. Кроме того, серин участвует в биосинтезе ряда других заменимых аминокислот: глицина, цистеина, метионина, триптофана.
Фармакологический препарат глутаминовой кислоты оказывает умеренное психостимулирующее, возбуждающее и отчасти ноотропное действие. Глутаминовая кислота (пищевая добавка E620) и её соли (глутамат натрия Е621, глутамат калия Е622, диглутамат кальция Е623, глутамат аммония Е624, глутамат магния Е625) используются как усилитель вкуса во многих пищевых продуктах[4]. Глутаминовая кислота используется в качестве хирального строительного блока в органическом синтезе[5], в частности, дегидратация глутаминовой кислоты приводит к её лактаму ― пироглутаминовой кислоте (5-оксопролину), которая является ключевым предшественником в синтезах неприродных аминокислот, гетероциклических соединений, биологически активных соединений и т.д.
Аспарагиновая кислота: · присутствует в организме в составе белков и в свободном виде · играет важную роль в обмене азотистых веществ · участвует в образовании пиримидиновых оснований и мочевины · Аспарагиновая кислота и аспарагин являются критически важными для роста и размножения лейкозных клеток при некоторых видахлимфолейкоза. · Фермент микробного происхождения L-аспарагиназа, нарушающий превращение аспарагиновой кислоты в аспарагин и наоборот, оказывает сильное специфическоецитостатическое действие при этих видах лейкозов.
фенилаланин является протеиногенной аминокислотой и входит в состав белков всех известных живых организмов. Участвуя в гидрофобных истэкинг-взаимодействиях, фенилаланин играет значительную роль в фолдинге и стабилизации белковых структур, является составной частью функциональных центров.
Аланин легко превращается в печени в глюкозу и наоборот. Этот процесс носит название глюкозо-аланинового цикла и является одним из основных путей глюконеогенеза в печени.
Лизин поддерживает уровень энергии и сохраняет здоровым сердце, благодаря карнитину, который в организме из него образуется. Как показали исследования, однократный прием 5000 мг лизина увеличивает уровень карнитина в 6 раз. Для этого должны присутствовать в достаточных количествах витамины C, тиамин (B1) и железо. Лизин участвует в формировании коллагена и восстановлении тканей. Его применяют в восстановительный период после операций и спортивных травм. Лизин улучшает усвоение кальция из крови и транспорт его в костную ткань, поэтому он может быть неотъемлемой частью программы лечения и профилактики остеопороза. Совместный прием лизина и аргинина (1-2 г в сутки) повышает иммунный ответ организма, в частности, количество и активность нейтрофилов. Лизин усиливает действие аргинина. Лизин понижает уровень триглицеридов в сыворотке крови. Лизин в сочетании с пролином и витамином С предупреждает образование липопротеинов, вызывающих закупорку артерий, следовательно, будет полезен при сердечно-сосудистых патологиях. Лизин замедляет повреждение хрусталика, особенно при диабетической ретинопатии. Дефицит лизина неблагоприятно сказывается на синтезе белка, что приводит к утомляемости, усталости и слабости, плохому аппетиту, замедлению роста и снижению массы тела, неспособности к концентрации, раздражительности, кровоизлияниям в глазное яблоко, потере волос, анемии и проблемам в репродуктивной сфере.
Аргинин — условно-незаменимая аминокислота. У взрослого и здорового человека аргинин вырабатывается организмом в достаточном количестве. В то же время, у детей и подростков, у пожилых и больных людей уровень синтеза аргинина часто недостаточен. Биосинтез аргинина осуществляется из цитруллина под действием аргининсукцинатсинтазы и аргининсукцинатлиазы. Аргинин является одним из ключевых метаболитов в процессах азотистого обмена (орнитиновом циклемлекопитающих и рыб). Аргинин является субстратом NO-синтаз в синтезе оксида азота NO, являющегося локальным тканевым гормоном с множественными эффектами — от провоспалительного до сосудистых эффектов и стимуляции ангиогенеза.
Гистидин входит в состав активных центров множества ферментов, является предшественником в биосинтезе гистамина. Одна из «существенных» аминокислот, способствует росту и восстановлению тканей. В большом количестве содержится в гемоглобине; используется при лечении ревматоидных артритов, аллергий, язв и анемии. Недостаток гистидина может вызвать ослабление слуха.
Цистеин — заменимая аминокислота. Он может синтезироваться в организме млекопитающих из серина с участием метионина как источника серы, а также АТФ и витамина В6. В некоторых микроорганизмах источником серы для синтеза цистеина может быть сероводород. Цистеин способствует пищеварению, участвуя в процессах переаминирования. Способствует обезвреживанию некоторых токсических веществ и защищает организм от повреждающего действия радиации. Один из самых мощных антиоксидантов, при этом его антиоксидантное действие усиливается при одновременном приеме витамина С и селена. Цистеин является предшественником глутатиона — вещества, оказывающего защитное действие на клетки печени и головного мозга от повреждения алкоголем, некоторыми лекарственными препаратами и токсическими веществами, содержащимися в сигаретном дыме.
Валин - Один из главных компонентов в росте и синтезе тканей тела. Вместе с лейцином и изолейцином служит источником энергии в мышечных клетках, а также препятствует снижению уровня серотонина. Опыты на лабораторных крысах показали, что валин повышает мышечную координацию и понижает чувствительность организма к боли, холоду и жаре. Используется для лечения болезненных пристрастий и вызванной ими аминокислотной недостаточности, наркоманий, депрессий (несильное стимулирующее соединение); множественного склероза, так как защищает миелиновую оболочку, окружающую нервные волокна в головном и спинном мозге. Также необходим для поддержания нормального обмена азота в организме.
Пролин, как и гидроксипролин, в отличие от других аминокислот, не образует с нингидрином пурпура Руэмана, а дает желтое окрашивание. В составе коллагена пролин при участии аскорбиновой кислоты окисляется в гидроксипролин. Чередующиеся остатки пролина и гидроксипролина способствуют созданию стабильной трёхспиральной структуры коллагена, придающей молекуле прочность.
Гидроксипролин входит в состав белка коллагена, входящего в соединительную ткань, а также в желатин. Синтезируется из пролина. Для синтеза необходим молекулярный кислород, а также витамин C. 4-Гидроксипролин содержится в моче. Среднесуточное выделение для здорового человека составляет 226±62 мкмоль.
L-триптофан является протеиногенной аминокислотой и входит в состав белков всех известных живых организмов. Относится к ряду гидрофобных аминокислот, поскольку содержит ароматическое ядро индола. Участвует в гидрофобных и стэкинг-взаимодействиях.
Изолейцин (сокращенно Ile или I; 2-амино-3-метилпентановая кислота)[1] — это алифатическая α-аминокислота, имеющая химическую формулу HO2CCH(NH2)CH(CH3)CH2CH3 и входящая в состав всех природных белков. Является незаменимой аминокислотой, что означает, что изолейцин не может синтезироваться в организме человека и должен поступать в него с пищей. Участвует в энергетическом обмене. При недостаточности ферментов, катализирующих декарбоксилирование изолейцина, возникает кетоацидурия. Кодоны изолейцина AUU, AUC и AUA. Обладая углеводородной боковой цепью, изолейцин относится к числу гидрофобных аминокислот. Характерной особенностью боковой цепи изолейцина является её хиральность (второй такой аминокислотой является треонин). Для изолейцина возможно четыре стереоизомера, включая два возможных диастереоизомера L-изолейцина. В природе, однако, изолейцин присутствует лишь в одной энантиомерной форме — (2 S,3 S)-2-амино-3-метилпентановая кислота.
Метионин — алифатическая серосодержащая α-аминокислота, бесцветные кристаллы со специфическим неприятным запахом, растворимые в воде, входит в число незаменимых аминокислот. Содержится во многих белках и пептидах (метионин-энкефалин, метионин-окситоцин). Значительное количество метионина содержится в казеине. Метионин также служит в организме донором метильных групп (в составе S-аденозил-метионина) при биосинтезе холина, адреналина и др., а также источником серы при биосинтезе цистеина.
Треони́н (α-амино-β-гидроксимасляная кислота; 2-амино-3-гидроксибутановая кислота) — гидроксиаминокислота; молекула содержит двахиральных центра, что обусловливает существование четырёх оптических изомеров: L- и D-треонина (3D), а также L- и D-аллотреонина (3L). L-треонин вместе с 19 другими протеиногенными аминокислотами участвует в образовании природных белков. Для человека треонин являетсянезаменимой аминокислотой. Суточная потребность в треонине для взрослого человека составляет 0,5 г, для детей — около 3 г. Бактериями и растениями треонин синтезируется из аспарагиновой кислоты через стадию образования гомосерин-O-фосфата.
Гидроксилизин (5-гидрокси-L-лизин) — нестандартная аминокислота, входящая в состав белка коллагена и в некоторые гликопротеины. В организме гидроксилизин образуется из лизина под воздействием фермента лизилгидроксилазы. Дефицит гидрокилизина считают причиной синдрома Элерса-Данлоса типа 6.[1] Пониженный синтез гидроксилизина, связан, как правило, с низкой активности лизилгидроксилазы. Другое заболевание, связанное с дефицитом гидроксилизина — латиризм. Оно возникает из-за воздействия ингибитора β-аминопропионитрила (BAPN). Дата добавления: 2015-12-15 | Просмотры: 383 | Нарушение авторских прав |