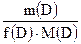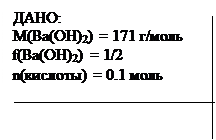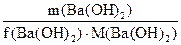|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Примеры решения типовых задач по теме “Растворы, массовая доля вещества”.
Задача 1. Приготовление раствора из навески сухого вещества. Какой массы кристаллогидрат BaCl2 ٠2H2O нужно взять для приготовления раствора объемом 0.5 л, в котором массовая доля BaCl2 составляет 0.1? (ρ = 1.090 г/мл).

РЕШЕНИЕ. 1. Находим массу заданного раствора по формуле: m = V . ρ = 500 мл . 1.090 г/мл = 545 г. 2. Находим массу BaCl2 в этом растворе по формуле:
mвещества = mраствора . ω
ω = 10% - то есть массовая доля растворенного вещества, выраженная в %. Это значит, что 10 г растворенного вещества содержатся в 100 г раствора (10 г BaCl2 и 90 г H2O). mвещества = 545 г . 0.1 = 54.5 г 3. Находим массу кристаллогидрата: 244.2 г BaCl2 . 2H2O содержат 208.4 г BaCl2 х г - 54.4 г ВаСl2 х = 244.2 . 54.4 / 208.6 = 64.2 г. Ответ: для приготовления раствора нужно взять 64.2 г BaCl2 . 2H2O Задача 2. Приготовление раствора из концентрированного путем разбавления. Какие объемы воды и раствора, в котором массовая доля BaCl2 составляет 10%, а ρ= 1.090 г/мл, потребуется для приготовления 1 л раствора с массовой долей BaCl2 2% и ρ = 1.012 г/мл?
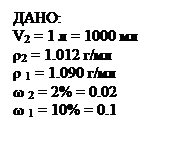
Vр-ра =? Vводы =?
3. Из закона разбавления следует: при разбавлении раствора, то есть при добавлении к нему чистого растворителя, количество растворенного вещества не меняется. Поэтому масса вещества в исходном растворе тоже равна 20.24 г. 4. Находим массу исходного раствора ω = mвещества/mраствора mраствора = mвещества/ ω = 20.24 г/0.1 = 202.4 г 5. Находим объем исходного раствора V = m/ ρ =202.4 г/ 1.090 г/мл = 185.7 мл 6. Находим массу и объем воды: 1012 - 202.4 = 809.6 г или 809.6 мл. Ответ: Vводы = 809.6 мл, Vраствора = 185 мл. Задача 3. Определение массовой доли по молярной концентрации раствора. Определите массовую долю гидроксида натрия в его растворе молярной концентрации 4.75 моль/л (ρ = 1.18 г/мл)
ω (NaOH) =?
3. Находим массу 1 литра раствора: mраствора = V . ρ = 1000 мл . 1.18 г/мл = 1180 г 4. Находим массовую долю NaOH в данном растворе ω = mвещества /mраствора = 190 г/1180 г = 0.161 или 16.1% Ответ: массовая доля NaOH в его растворе с молярной концентрацией, равной 4.75 моль/л, составляет 16.1%.
Примеры решения задач по теме "Молярная концентрация эквивалента". Содержание растворенного вещества в растворе (концентрацию раствора) выражают разными способами. В аналитической практике, в объемном анализе, наиболее удобным видом концентрации является молярная концентрация эквивалента вещества. Рассмотрим некоторые понятия, относящиеся к этому виду концентрации. Эквивалент - реальная или условная частица, которая может присоединять, отдавать или как-то иначе быть равноценной одному иону водорода H+ в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях. Примеры: В реакциях одному иону водорода H+ эквивалентны: а) 2H+ + S2-........ 1/2 иона S2- б) H+ + NH3 ......... 1 молекула NH3 в) 3ОН- + H3PO4 → PO43- + 3H2O... 1/3 молекулы H3PO4 г) Al3+ + 3e → Al 0...... 1/3 Al3+ д) 2ОН- + H3PO4 → НPO42-..1/2 молекулы H3PO4 Фактор эквивалентности - число, показывающее, какую долю реальной частицы (молекулы, атома, иона) составляет эквивалент. Он может быть единицей или меньше единицы (f £ 1) в зависимости от природы вещества или характера данной реакции. При f = 1 эквивалентом является целая молекула, атом или ион (например, NH3), при f < 1 эквивалентом является соответствующая доля молекулы, атома или иона. Значение фактора эквивалентности в данной реакции определяется по формуле: fкислоты = 1/основность кислоты = 1/Z fоснования = 1/кислотность основания = 1/Z fсоли = 1/(число атомов металла . валентность металла) = 1/Z fокислителя (или восстановителя) = 1/число принимаемых (или отдаваемых) электронов = 1/Z
Примеры значений фактора эквивалентности;
Молярная масса эквивалента, М(Э) г/моль - масса 1 моль эквивалентов данного вещества: М(Э) = f(Х) . M(Х) Она равна произведению фактора эквивалентности на молярную массу вещества Пример 1. М(1/2H2SO4) = 1/2 M(H2SO4) = 1/2 . 98 = 49 г/моль
Пример2. Вычислите число моль эквивалентов серной кислоты в 9.8 г, если f(H2SO4)= ½ n(H2SO4)) = Закон эквивалентов: в химических реакциях число моль эквивалентов всех веществ, вступающих в реакцию и образовавшихся в ней, всегда равны между собой. Для реакции: aA + bB → cC + dD n(А) = n(B) = n(C) = n(D) или:
Пример 3. 2 NaOH + H2SO4 → Na2SO4 + 2H2O n(NaOH) = n(1/2 H2SO4) = n(1/2 Na2SO4) = n(H2O)
Пример 4. Сколько граммов гидроксида бария потребуется для полной нейтрализации 0.1 моль эквивалентов органической кислоты? (Или: какая масса Ba(OH)2 эквивалентна 0.1 моль эквивалентов органической кислоты?).
m(Ba(OH)2) =? m(Ba(OH)2)/ (1/2 . 171) = 0.1, oтсюда: m(Ba(OH)2) = 1/2 . 171 . 0.1 = 8.55 г. Ответ: 8.55 г.
Дата добавления: 2015-12-16 | Просмотры: 1384 | Нарушение авторских прав |









 Число моль эквивалентов вещества, n(Э)
Число моль эквивалентов вещества, n(Э)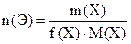
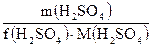 = 9.8 / (½·98) = 0.2
= 9.8 / (½·98) = 0.2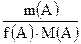 =
= 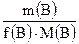 =
= 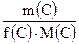 =
=