|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
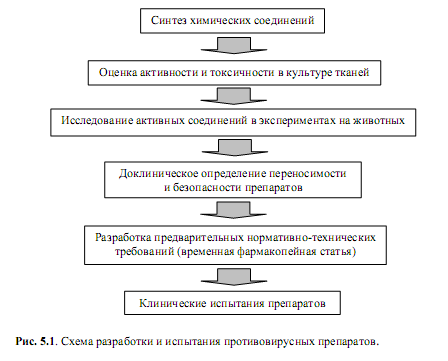
Этапы репликации вирусов, уязвимые для действия лекарственных средств. Общая стратегия поиска антивирусных средствЭкспрессия вирусных генов меньше подходит для химической атаки на вирус, чем репликация генома, поскольку вирусспецифические процессы транскрипции генома, созревания мРНК и ее трансляция в гораздо большей степени зависят от клеточной биохимической машинерии, чем процессы синтеза вирусных нуклеиновых кислот. Поэтому представляется неслучайным, что никаких клинически значимых лекарственных препаратов, которые бы дискриминировали экспрессию вирусных и клеточных генов, пока не разработано. Однако поиск таких препаратов продолжается, и здесь следует напомнить, что у некоторых вирусов белки (полипротеины) претерпевают посттрансляционный процессинг – протеолитическое разрезание вирусными и клеточными протеазами. Сейчас эти процессы становятся предметом т.н. нетрадиционной химиотерапии вирусных инфекций. В частности, в настоящее время проходят клинические испытания препараты (Indinavir, Ritonavir, Nelvinavir и др.), механизм действия которых заключается в ингибировании протеаз, которые специфически расщепляют вирусные полипротеины. Действующим веществом указанных препаратов являются пептидные аналоги. Эти вещества специфичны для протеазы ВИЧ и конкурентным образом ингибируют фермент, предотвращая созревание вирионов, способных инфицировать другие клетки. Что касается заключительных этапов цикла репликации вирусов, необходимо отметить, что для большинства вирусов процессы сборки, созревания и выхода из клетки до сих пор мало изучены и, поэтому, пока не являются мишенями для антивирусной атаки. В заключение раздела, касающегося характеристики средств борьбы с вирусами, приходится констатировать, что более 90% существующего арсенала антивирусных препаратов используются в отношении очень ограниченного числа вирусных инфекций. Ситуацию скрашивает лишь то, что эти препараты эффективны против наиболее распространенных вирусных заболеваний (грипп и прочие ОРВИ, а также различные герпетические поражения). В то же время химитерапевтических препаратов для эффективного лечения ВИЧ-инфекции, нейровирусных поражений и эндогенных гепатитов крайне недостаточно. Для всей остальной массы вирусных инфекций этиотропных средств нет. Общим недостатком имеющихся антивирусных препаратов является довольно узкий спектр активности, а также быстрое формирование резистентных к ним штаммов. На наш взгляд, наиболее рациональная стратегия противовирусной терапии должна включать вакцины (чтобы стимулировать иммунный ответ), индукторы интерферона для мобилизации неспецифической системы защиты и, наконец, этиотропные химиопрепараты для завершения процесса ингибирования репликации вируса. Как правило, разработка противовирусных препаратов должна вестись в порядке, который в немного упрощенном виде иллюстрирует рис. 5.1.
Задача начального этапа испытаний - объективно и точно выявить первичную специфическую противовирусную активность соединения и дать заключение о его перспективной значимости и целесообразности испытаний в опытах на животных. Практика показала, что наиболее дешево и быстро можно получить такие данные, используя тканевые культуры. Противовирусную активность препаратов в культуре ткани выявляют с помощью тех же тестов, что используются для оценки репродукции вируса: цитопатический эффект, феномен гемагглютинации, феномен гемадсорбции, метод флуоресцирующих антител, метод электронной микроскопии и метод бляшек (негативных колоний). При этом наиболее часто в последние 20-25 лет активность препаратов в культуре тканей определяют методом редукции бляшек. Популярной модификацией метода подавления бляшек является методика градиента концентрации исследуемого вещества в агаре, которое вносится в лунку, высеченную в центре чашки Петри с инфицированными клетками. По этой методике можно определять минимальную активность исследуемого вещества с одновременной оценкой его токсичности для клеток. Широко используется также дисковый метод подавления образования негативных колоний, состоящий в том, что исследуемое соединение вносится в составе фильтровального диска в культуру клеток с агаровым покрытием. На стадии первичного отбора противовирусных препаратов особую ценность приобретают системы для одновременной оценки большого числа соединений. Описана методика исследования противовирусной активности химиопрепаратов с использованием культуры ткани в микрообъемах. По этой методике культуру клеток выращивают в пластиковых панелях с 96 лунками, в каждую из которых вносят по 0,1 мл вируссодержащей среды. После 72 ч инкубирования культуру клеток микроскопируют для определения цитопатического действия (ЦПД). По такой методике можно исследовать сразу большое число препаратов при небольших расходах питательных сред и изучаемых соединений. Можно упомянуть и один из ускоренных методов оценки противовирусной активности соединений, который основан на определении интенсивности включения
3Н-уридина или 3Н-тимидина в нуклеиновые кислоты соответственно РНК-содержащих или ДНК-содержащих вирусов. В суспензию клеток вносят исследуемый вирус и спустя 30-60 мин распределяют по лункам панелей. Предварительно в каждую лунку наливают раствор испытуемого вещества и один из указанных выше радиоактивномеченных предшественников вирусной нуклеиновой кислоты. Пробы инкубируют 5 ч при 37⁰. Затем радиоактивность, включившаяся в васокополимерную (кислотонерастворимую) фракцию клеточных лизатов замеряется в жидкостном сцинтилляционном счетчике. При помощи этого метода один работник за 3 ч может исследовать до 100 образцов различных соединений. Считается, что оценка противовирусной активности соединений методом ингибирования синтеза вирусных нуклеиновых кислот более точная, чем методом редукции бляшек. При отборе антивирусных средств большое значение имеет правильная оценка токсичности соединений. Наиболее широко распространенным и простым является метод прижизненного морфологического исследования клеток культуры ткани, которая инкубируется 48 ч в присутствии тестируемого соединения. Морфологическая оценка цитотоксичности основана на использовании результатов световой, фазово-контрастной и люминисцентной микроскопии. В качестве критерия токсического поражения клеток используются результаты теста на жизнеспособность. Доза препарата оценивается как нетоксичная, если культура клеток после смены среды, содержащей препарат, способна репродуцировать вирус в том же титре, что и интактная культура. Этот метод определения токсичности химиопрепаратов считается более чувствительным, чем метод прижизненного морфологического исследования. Минимальная доза препарата, полностью прекращающая размножение в клетках вируса, рассматривается как токсичная. Критерий эффективности антивирусных препаратов - ХТИ – в экспериментах с использованием культуры ткани определяется, как отношение среднетоксичной концентрации вещества (СТ50) к среднеэффективной вирусингибирующей концентрации (ЕД50). Соединения с ХТИ более 8 считаются перспективными для дальнейших исследований в опытах на животных. Здесь уместно сделать следующее замечание. В англоязычной литературе для обозначения ХТИ приняты индексы TI (therapeutic index) или SI (selectivity index). Их рассчет производится из отношения IC50/EC50, где IC50– концентрация ингибитора, подавляющая рост клеток или жизнеспособность неинфицированных клеток на 50%, а ЕС50 – концентрация ингибитора, подавляющая на 50% продукцию вируса, инфекционность вируса или вирусиндуцированный цитопатический эффект. Далее на животных исследуют специфическую активность, а также т.н. «острую» и хроническую токсичность препаратов после различных способов их введения. Критерием эффективности здесь служит процент выживания и ХТИ. Препараты, обеспечивающие выживаемость (защиту) не менее 50% животных от 10ЛД50, считаются перспективными для дальнейшего изучения. Острую и хроническую токсичность новых препаратов нужно изучать не менее чем на трех видах животных, включая собак. Аналоги известных химических соединений допускается изучать на животных двух видов, один из которых не относится к грызунам. В качестве подопытных животных для изучения противовирусных препаратов используются самые разнообразные животные, в т.ч. белые мыши, хлопковые крысы, морские свинки, кролики, хомяки, хорьки, поросята, собаки, обезьяны. Оценка на животных является абсолютно необходимой хотя бы потому, что между активностью препарата in vitro и in vivo далеко не всегда существует корреляция. Чем это можно объяснить? Универсального ответа не существует. Это может быть плохая всасываемость препарата (т.е. биодоступность), подверженность препарата непродуктивному метаболизму в макроорганизме и т.д. Следует отметить, что экспериментальная модель вирусной инфекции для оценки противовирусной активности препаратов должна как можно точнее воспроизводить заболевание человека. Чем больше сходство, тем выше корреляция между результатами, полученными на лабораторных животных и у человека. К сожалению, удовлетворительных моделей такого типа для большинства вирусных инфекций мало. В схемах оценки препаратов при изучении на животных моделях предусматривается введение их до и после заражения – для определения профилактического и лечебного эффекта. Обычно ХТИ в опытах на животных выражается отношением ЛД50 к ЕД50, где ЕД50 – суточная доза препарата, защищающая 50% животных. Принято, что препараты с ХТИ меньше 2 – неактивны, а с 4 и выше – перспективные для дальнейшего изучения в клинике. Следует отметить, что кроме высокой специфичности к антивирусным препаратам предъявляется много других требований. Это: • хорошая растворимость в водной среде; • сохранность структуры при введении в организм; • скорость адсорбции слизистыми и элиминации из организма; • способность проникать в ткани-мишени; • стабильность при хранении; • доступность сырья и простая технология производства и т.д. По поводу последнего по списку (но не по значимости!) требования, необходимо отметить, что именно из-за отсутствия подходящей технологии производства часто внедрение препаратов в практику здравоохранения задерживается на десятки лет. Дата добавления: 2015-12-16 | Просмотры: 1218 | Нарушение авторских прав |