|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ОБЗОР ВНЕШНИХ ИСТОЧНИКОВ И АРГУМЕНТАЦИЯГруппа ученых из Университета Лозанны (Швейцария) изучает свойства ICE-элементов у широко распространенных бактерий из рода псевдомонад (Pseudomonas), обитающих в почве. В хромосоме у этих бактерий есть геномный островок, обладающий свойствами ICE-элемента. Так как он содержит гены ферментов метаболизма некоторых ароматических веществ, в том числе хлорокатехола (chlorocatechol), его обозначают как ICEclc (см.: Marco Minoia et al., 2008. Stochasticity and bistability in horizontal transfer control of a genomic island in Pseudomonas). Он расположен после гена тРНК для аминокислоты глицина. Процесс переноса ICEclc начинается с активации промотора гена интегразы (промотор — это регуляторный элемент гена, ответственный за его «включение»). Ранее на примере бактерии Pseudomonas knackmussii было показано, что интеграза активируется только в небольшой фракции клеток, причем это происходит в стационарной фазе роста, когда питательные вещества в среде исчерпаны и рост популяции прекращается. Для ее активации необходим белок InrR (integrase regulator) — регулятор интегразы. Он также синтезируется только в некоторых клетках в небольшом количестве. Что определяет включение этих генов в клетках в составе популяции, неясно. Предполагается, что включение InrR и, соответственно, активация интегразы происходят стохастически (случайным образом), в результате некоторого «транскрипционного шума» в регуляторной области inrR. В эксперименте использовали два вида бактерий — Pseudomonas knackmussii в качестве донора ICEclc и Pseudomonas putida в качестве реципиента. Для того чтобы зафиксировать факт передачи ДНК, в геном бактерий были внесены некоторые изменения. Донорные клетки были помечены красным флуоресцентным белком (mCherry) путем встраивания копии кодирующего его гена в геном бактерий. Так как P. knackmussii содержит две копии ICEclc, в одной из них интегразу заменили на ген зеленого флуоресцентного белка (egfp) под контролем промотора интегразы (Pint). Таким образом получилось, что красный белок синтезировали все клетки P. Knackmussii, а зеленый — только те, в которых активировалась интеграза. В результате наложения красного и зеленого активные доноры под микроскопом выглядят желтыми. Клетки-реципиенты содержали ген зеленого белка, перед которым не было регуляторного элемента, то есть сам по себе он не работал. Однако интегрируемый фрагмент ДНК содержал регуляторную область, поэтому, если интеграция ICEclc происходила, он начинал светиться. В результате эксперимента исследователи подтвердили, что только небольшая часть клеток в популяции (3–5%) может передавать генетическую информацию. Реципиенты могут получать ДНК только при прямом физическом контакте с активными донорами. Однако способность передавать ДНК не приносит клеткам пользы. Активация ICEclc приводила к тому, что клетки при помещении на свежую питательную среду делились редко или вообще не делились и часто погибали. Клетки с активной интегразой формировали отдельные микроколонии, хорошо отличимые от колоний нормальных клеток. По оценкам, в геномах разных видов бактерий от 5 до 30% генетической информации появилось в результате горизонтального переноса. Возможен даже перенос генов от бактерий к эукариотам — например, агробактерии могут передавать плазмиды растениям.
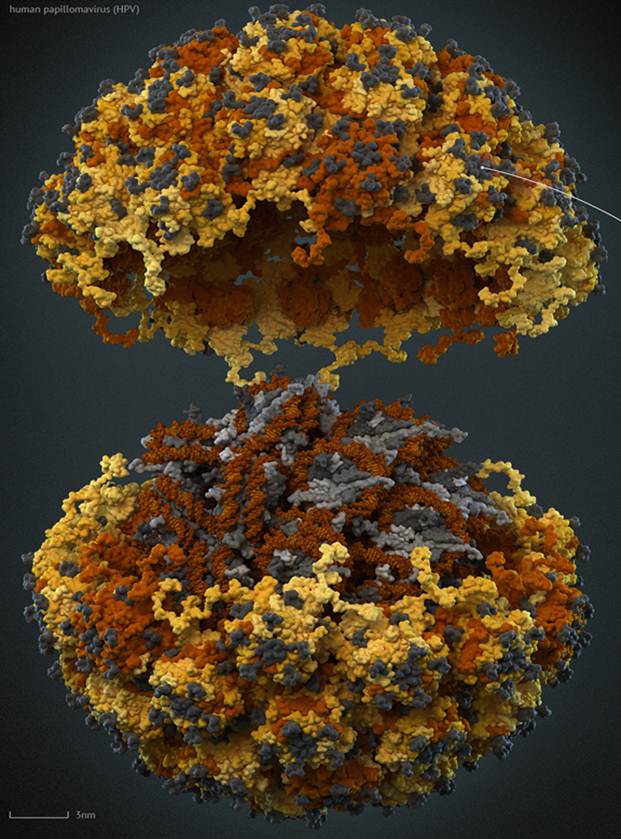
Капсиды вирусов представляют собой достаточно плотно упакованные комплексы белков (некоторые из них собственно и отвечают за процесс одевания) с нуклеиновой кислотой (ДНК или РНК у ретровирусов). Неклеиновая кислота вириона функционально, и структурно напоминает хроматин, представляя собой компактную форму вирусного генома. Существует два основных типа капсидных структур: палочковидная (нитевидная), либо сферическая («изометрическая» или икосаэдрическая). В первом случае связанные белковые субъединицы периодически располагаются вдоль нити нуклеиновой кислоты таким образом, что она сворачивается в спираль, образуя своего рода «инвертированную нуклеосому», в которой, в отличие от нуклеосом эукариот, белковая часть расположена не внутри, а снаружи структуры, что обуславливается нековалентными связями между отдельными субъединицами белков такой "оболочки". Подобная структура капсидов типична для вирусов растений (в частности, вируса табачной мозаики) и миксо-, парамиксо- и рабдовирусов, нуклеокапсиды которых имеют спиральную форму. В изометрических структурах упаковка нуклеиновой кислоты вирусного генома более сложна: белки оболочки капсида относительно слабо связаны с нуклеиновой кислотой или нуклеопротеидами, что налагает меньше ограничений на способ упаковки нуклеиновой кислоты. Например, мимивирусы уже используют нуклеосомный способ, Нуклеопротеиды «сердцевины» при этом могут быть весьма сложно организованы: так, в паповавирусах двухцепочечная кольцевая ДНК, связываясь с гистонами, образует структуры, очень похожие на нуклеосомы. К примеру папилломавирусы, они имеют сравнительно маленькие вирионы, лишенные мембранной оболочки. Их диаметр около 30 нм. Это примерно в четыре раза меньше диаметра ВИЧ или гриппа, имеющих мембранную оболочку, происходящую из мембраны зараженной клетки. Геном папилломавирусов представлен кольцевой двуцепочечной молекулой ДНК, которая упакована при помощи гистонов — клеточных белков, участвующих в компактизации ДНК в ядре. Геном папилломавирусов кодирует два типа белков. Ранние белки (early proteins, E-proteins) осуществляют регуляторные функции, обеспечивают размножение вируса и, в ряде случаев, ответственны за злокачественное перерождение клеток. Поздние белки (late proteins, L-proteins) выполняют структурную функцию, формируя капсид вирионов (рис 1). Каким конкретно образом ДНК уложена внутри вирсуной частицы, тоже не описано окончательно. Известно что в вирусоподобные частицы вируса папилломы человека может быть упакована любая ДНК короче 8 тысяч пар нуклеотидов, что открывет перспективы для использовния ВПЧ в качестве трансформационных векторов. Интересно, что в распаковке капсида папилломавирусов участвует циклофилин — клеточный белок, также способствующий распаковке капсида, например вируса имунодефицита человека. Интерес к разработке вакцин против данного вируса был подогрет тем, что исследование связи папилломовирусов с раком шейки матки в 2008 году было удостоено Нобелевской премии в области физиологии и медицины. Немецкий ученый Харальд цур Хаузен (Harald zur Hausen) показал, что папилломавирусы являются причиной практически всех случаев рака шейки матки, второго по распространенности рака у женщин.
Рис.1 Компьютерная модель вируса папилломы: изображены "жёлтые" L1-пентамеры капсида, "оранжевые" L2-пентамеры, "коричневый" геном и "серые" гистоновые белки.
Генно-инженерные эксперименты показали, что количество пальцев у мышей зависит от двух взаимодействующих систем генов-регуляторов. По мере отключения этих генов пальцы становятся многочисленнее, короче и тоньше, а их концы соединяются костно-хрящевой дугой, так что в итоге кисть начинает напоминать плавник примитивной рыбы. Новые данные согласуются с гипотезой о том, что развитие пальцев основано на реакционно-диффузионном механизме самоорганизации, придуманном Аланом Тьюрингом в 1952 году. Этот механизм способен генерировать сложные узоры из полос и пятен, часто встречающиеся в живой природе. По-видимому, пальцы развиваются там, где образуются неподвижные «волны» концентраций двух динамически взаимодействующих веществ (морфогенов). Сами эти вещества пока не идентифицированы, а известные гены-регуляторы лишь модифицируют силу их взаимного воздействия, что отражается на длине «волн», которая, в свою очередь, определяет ширину пальцев и их количество. Также описаны эксперименты по удаления длинных не кодирующих белки последовательностей у мышей (1,511 и 845 тысяч пар основания, что в сумме длиннее двух миллионов пар), в которых получены жизнеспособные, внешне не отличимые от их "естественных" сородичей особи. Эти данные показывают, что организация генома имеет командные последовательности высокого уровня (управляющие низкоуровневыми последовательностями), которые могут принимать дискретные значения в небольшом диапазоне, что позволяет использовать их отдельно от остальной части генома. Это в свою очередь и даёт возможность внедрения кода вируса в программу клетки хозяина, как высокоуровневой надстройки, способной перенимать управление над имеющимися наборами инструкций и ещё больше роднит вирусы с транспозонами.
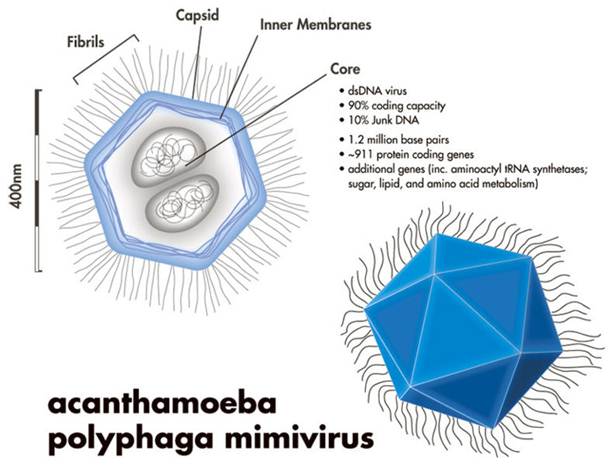
Общий предок больших ядерно-цитоплазматических ДНК вирусов вероятно произошёл от бактериофага, в результате захвата множества эукариотических и некоторых бактериальных генов, вместе с тем избавляясь от большинства генов фага, кроме тех, которые ответственны за репликацию и формацию вириона. Примером существующего представителя данной группы вирусов является мимивирус (рис. 2).
Рис.2 Схематическое изображение мимивируса.
«Классические» вирусы внедряют в жертву свою ДНК, которая, встраиваясь в ядерную, заставляет клетку производить новые копии «взломщика». Мимивирусу всё это не нужно: он справится с саморепликацией, не вовлекая ядерный геном хозяина, используя почти только энергию и соответствующие аминокислоты, заражённой клетки. Это огромный вирус с геномом длинной около 1,2 миллиона пар оснований (приблизительно 900 генов кодирующих белки), последовательности для целых метаболических цепочек, плюс ферменты трансляции, и ферменты гликозилирования белков, и даже метилазы и рестриктазы. Так как этот вирус атакует амёб (по данным исследований способен заражать и некоторые виды водорослей) круг его хозяев очень велик. Он и его родственники занимают второе место по распространённости в природе после бактериофагов.
Сол Шпигельман проводил в 60-х годах эксперимент по эволюции в пробирке. Целью эксперимента был ответ на вопрос "что произойдет с вирусным геномом, если ему предоставить все условия для быстрой репликации?" Для опыта был взят РНК-овый геном бактериофага Q-beta. Это вирус, заражающий кишечную палочку. Его геном имеет длину 4500 нуклеотидов, в нем закодированы белки, необходимые для репликации этого генома внутри бактерии, упаковки в белковую оболочку и т.п. Шпигельман взял голый геном и посадил его в пробирку с репликазой этого самого вируса (молекулярный комплекс, синтезирующий новую молекулу РНК по шаблону из уже имеющейся РНК). Кроме того, в пробирку постоянно поступали свободные нуклеотиды - строительный материал для РНК. Другими словами, Шпигельман создал для генома все условия, чтобы он мог реплицироваться, не заботясь о поиске жертвы-бактерии и прочих трудностях вирусной жизни. Через 74 поколения в пробирке родился монстр, который вышел недавно на свободу и перезарозил в Германии кишечные палочки. Условия эксперимента были направлены на отбор по скорости репликации. Для этого через уменьшающиеся интервалы времени отбирались те молекулы РНК, которые реплицировались первыми, они переносились в новую среду с теми же условиями и цикл повторялся. Некоторое время вирусная РНК аккуратно копировалась репликазой. Но вскоре появилась мутантная РНК, потерявшая несколько генов. Этот геном имел уменьшенную длину, мог реплицироваться быстрее и в итоге вытеснил начальный геном. Потом появился еще более короткий вариант, и вытеснил предыдущий. Очевидно, вирусу не нужно было нести гены репликазы и оболочки, чтобы выжить. Наоборот - в новых условиях это был лишний груз. Так продолжалось до тех пор, пока геном не выродился в маленький кусочек РНК длиной 220 нуклеотидов, который содержал сайт узнавания репликазой и небольшой довесок. Этот конечный вариант вируса генетики окрестили монстром Шпигельмана. Тридцать лет спустя, в 1996 году, Манфер Эйген с коллегами продолжил эксперимент. Они взяли кусочек РНК длиной 220 нуклеотидов из генома вируса ВИЧ, и сделали с ним примерно то же самое, что и Шпигельман. В итоге они получили два еще меньших монстра, длиной 48 и 54 нуклеотидов, которые состояли уже почти целиком только из сайта прикрепления репликазы.
Геном вирусов может быть разобщён(у вирусов растений фрагментация доходит до 2-4-х частиц, а увирусов насекмых достигает 28-ми), что приводит к невозможности его репликации в клетке заражённой не полным набором. В данном случае понятие вирион размывается, так как любая единственная вирусная частица не может считаться "индивидом" вируса. Для большинства вирусов является характерным основную часть (часто можно сказать "всю") своей "жизненной активности" проявлять в виде саморепликации. Вирусы животных генетически сильно связаны со своими хозяевами, что проявляется в высокой специфичности выбора пригодных для заражения видов, обычно их число невелико или даже сводится к одному единственному хозяину (вирус Гриппа). Ретровирусы встраиваясь в клетку хозяина (например ретровирусы: вирус СПИДа) становятся частью генома (напримере при помощи интегразы) атакованной клетки прежде чем начать синтез своих частиц, существуют строго определённые сайты, пригодные для интеграции вирусной ДНК в нативной ДНК клетки (тропность определённого вируса к данной группе клеток может быть продиктована тем, что после созревания в соматическую клетку, именно эта часть генома остаётся активной, а сама специализация клетки создаёт нужный для репликации синтетический аппарат). Стольже неточным для вирусов является понятие популяции, ведь стадия репродукции в клетке, и тем паче, процесс интеграции, лишают смысла трактовку репродуцирующегося вируса как популяции. О вирусе оспы (ДНК с молекулярной массой до 240 мегадальтон) и фаге MS2 (РНК 1,2 мегадальтона) можно размышлять, как о родственных видах так же, как о обезьяне и муравье. Вирусы могут отличатся между собой морфологически на столько, что вопрос их родства (в том смысле как это подразумевается для ветвящегося онтофилогенетического дерева потомков и предков, например для млекопитающих) становится весьма сомнительным. Это больше напоминает процесс получения похожих свойств, в ходе параллельной эволюции. Таким образом вирусы разных видов больше роднит общий шаблон поведения, нежели происхождения от некоего общего предка. Это заставляет думать о вирусах, как об неких отделяющихся участках метаболизма хозяина, которые развили свой способ распространения. От прочих паразитов, которые также специфичны относительно хозяина вирусов отличает особенность их информационной связи через ДНК/РНК с атакованными ими клетками. Таким образом вирус мнится, как некая часть собственной генетической программы хозяина, которая оказалась стабильней в виде маленького её фрагмента выполняющего функцию расселения будучи в неактивной - грубо говоря - не живой фазе, полностью отделившись от метаболизма хозяина. Возможно совместное использование белков генетически отдалёнными вирусами: если дефектный по оболочечным белкам ретровирус размножать в присутствии вируса везикулярного стоматита, то вирионы будут иметь вирусную оболочку последнего. Данный факт указывает не только на общность самого характера процессов воспроизводства многих вирусов, но и их локализацию (одевание в оболочку, например).
ВЫВОДЫ Вирусы, исходя из вышеперечисленных фактов, напоминают зацикленный (благодаря высшей стабильности именно вирусной части программы) фрагмент кода хозяина, не отличающийся высокой автономией (в сравнении с клеткой, которая вирусом не заражена). В этом они напоминают преоны, которые в свою очередь ещё более видоспецифичны, просты и стабильны, ведь являются информационными переносчиками структуры меньшей сложности и размеров - отдельных конформаций белков. Которые тоже способны к скоростному размножению именно благодаря большей устойчивости преонной формы белка над нативной (для клетки), хотя механизм трансформации "нормального" белка в прионную форму изучен недостаточно. Вирусы, вероятнее всего являются полифилетической группой организмов, имеющих, может быть, самое большое число самых филогенетически далеко отстоящих друг от друга предков; общность плана строения самых низких уровней организации генома среди большинства представителей клеточных форм жизни, обусловила похожесть вирусов между собой (как генетических паразитов) и обеспечила громадную экологическую нишу для вирусов, в которой они чрезвычайно быстро развиваются, образуя новые штаммы или даже виды.
Литература
1.S.Howking. "The Grand Design";
2.Современное естествознание. том 4. Физика элементарных частиц. Астрофизика;
2.Brian Greene. "The Fabric of cosmos";
3.Richerd Feinman;
4. В.М.Жданов "Эволюция вирусов";
5. Virol J. 2008 Jan 23;5:12. doi: 10.1186/1743-422X-5-12. Marine mimivirus relatives are probably large algal viruses. Monier A, Larsen JB, Sandaa RA, Bratbak G, Claverie JM, Ogata H.
6. Nature 431, 988-993 (21 October 2004) | doi:10.1038/nature03022; Received 2 June 2004; Accepted 8 September 2004 Дата добавления: 2014-12-11 | Просмотры: 795 | Нарушение авторских прав |