|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ГлутатионтрансферазыОсобое место среди ферментов, участвующих в обезвреживании ксенобиотиков, инактивации нормальных метаболитов, лекарств, занимают глутатионтрансферазы (ГТ). Глутатионтрансферазы функционируют во всех тканях и играют важную роль в инактивации собственных метаболитов: некоторых стероидных гормонов, простагландинов, билирубина, жёлчных кислот, продуктов ПОЛ. Известно множество изоформ ГТ с различной субстратной специфичностью. В клетке ГТ в основном локализованы в цитозоле, но имеются варианты ферментов в ядре и митохондриях. Для работы ГТ требуется глутатион (GSH) (рис. 12-6). Глутатион - трипептид Глу-Цис-Гли (остаток глутаминовой кислоты присоединён к цистеину карбоксильной группой радикала). ГТ обладают широкой специфичностью к субстратам, общее количество которых превышает 3000. ГТ связывают очень многие гидрофобные вещества и инактивируют их, но химической модификации с участием глугатиона подвергаются только те, которые имеют полярную группу. То есть субстратами служат вещества, которые, с одной стороны, имеют электрофильный центр (например, ОН-группу), а с другой стороны - гидрофобные зоны. Обезвреживание, т.е. химическая модификация ксенобиотиков с участием ГТ, может осуществляться тремя различными способами:
R + GSH → GSRH,
RX + GSH → GSR + НХ,
R-HC-O-OH + 2 GSH → R-HC-OH + GSSG + H2O · В реакции: ООН - гидропероксидная группа, GSSG - окисленный глутатион.
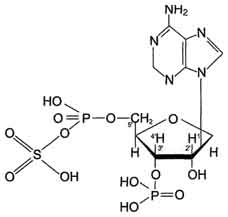
Рис. 12-5.3'-Фосфоаденозин-5'-фосфосульфат(ФАФ-SО3Н).
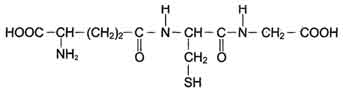
Рис. 12-6. Глутатион (GSH). Сисгема обезвреживания с участием ГТ и глутатиона играет уникальную роль в формировании резистентности организма к самым различным воздействиям и является наиболее важным защитным механизмом клетки. В ходе биотрансформации некоторых ксенобиотиков под действием ГТ образуются тиоэфиры (конъюгаты RSG), которые затем превращаются в меркаптаны, среди которых обнаружены токсические продукты. Но конъюгаты GSH с большинством ксенобиотиков менее реакционноспособны и более гидрофильны, чем исходные вещества, а поэтому менее токсичны и легче выводятся из организма (рис. 12-7). ГТ своими гидрофобными центрами могут нековалентно связывать огромное количество липофильных соединений (физическое обезвреживание), предотвращая их внедрение в липидный слой мембран и нарушение функций клетки. Поэтому ГТ иногда называют внутриклеточным альбумином. ГТ могут ковалентно связывать ксенобиотики, являющиеся сильными электролитами. Присоединение таких веществ - "самоубийство" для ГТ, но дополнительный защитный механизм для клетки.
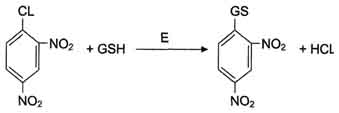
Рис. 12-7. Обезвреживание 1-хлор-2,4-динитробензола с участием глутатиона. Дата добавления: 2015-11-25 | Просмотры: 536 | Нарушение авторских прав |