|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Опрелеление ингибитора активатора плазминогена типа 1 (PAI-1)PAI-1 в качестве основного ингибитора уро-киназы (u-РА) и тканевого активатора (t-PA) играет важную роль в контроле за активностью фибринолиза. Определение PAI-1 часто включа- ется как один из тестов профиля (панели) оценки тромбофилии. У больных с кровотечениями неясного генеза с нормальными скрининговыми тестами дефицит PAI-1 может быть причиной патологии. Истинный дефицит выявляется относительно редко, но сопровождается тяжелыми кровотечениями. Повышение PAI-1 встречается достаточно часто, так как PAI-1 - белок острой фазы. Это имеет клиническое значение, так как является причиной рецидивирующего венозного тромбоза и отмечается часто у мужчин в преклонном возрасте. PAI-1 повышается при: инфекционных и воспалительных процессах; послеоперационном периоде; злокачественных опухолях; ожирении; гипертриглицеридемии; лечении дексаметазоном. У больных с инфарктом миокарда персисти-рующий подъем PAI-1 рассматривается как неблагоприятный прогностический признак. Определение PAI-1 состоит из нескольких этапов. На первом этапе необходимо инактиви-ровать ингибиторы плазмина - α2-антиплазмин и α2-макроглобулин. Затем используется общий принцип определения остаточной активности добавленного в избытке фактора, который должен подавляться исследуемым ингибитором (рис. 124).
Рис. 123. Принцип определения α2-антиплазмина хромогенным методом. ПАП - комплекс плазмин-антиплазмин
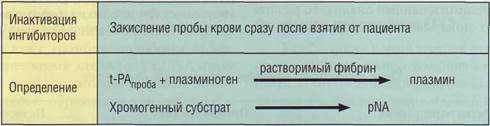
Рис. 124. Принцип определения ингибитора тканевого активатора плазминогена типа 1 (РАМ) хромогенным методом. u-PA - урокиназа, t-PA - тканевой активатор
Обеспечение диагностики нарушений гемостаза в КДЛ При использовании u-РА метод в техническом исполнении несколько проще, чем при использовании избытка t-PA, и может быть автоматизирован на современных анализаторах. Содержание PAI-1 в системе циркуляции подвержено суточным ритмам, поэтому пробы при системном анализе необходимо брать в одно время, лучше по утрам. Кроме того, PAI-1 - один из самых неустойчивых белков плазмы, поэтому определение необходимо проводить сразу после взятия крови, транспортировка может привести к потере активности PAI-1 в пробе. Завышенные результаты теста можно получить при увеличении активности PAI-2. Этот ингибитор повышается при беременности, поэтому в данном случае исследование PAI-1 описанным выше методом может дать ложные результаты. В последнее время активно используется определение PAI-1 методом ELISA или комбинацией им-мунохимических и функциональных методов. Определение тканевого активатора плазминогена (t-PA) Тканевой активатор плазминогена (t-PA) освобождается в кровоток из эндотелиальных клеток сосудистой стенки, где он синтезируется. Поэтому диагностика дефицита t-PA основывается не только на определении концентрации t-PA в крови, но и на способности освобождаться из сосудистой стенки при стрессовых воздействиях, в частности при манжеточной пробе (дозированном пережатии вен). Сначала определяют базовый уровень t-PA, потом на 10-15 минут на предплечье накладывают жгут или раздувают манжетку, вызывающую венозный стаз, затем берут вторую порцию крови, в которой повторно определяют t-PA. Сравнивают результаты обеих проб. Из-за быстрой инактивации тканевого активатора плазминогена PAI-1 и другими ингибиторами пробы крови необходимо немедленно закислить, чтобы предупредить инактивацию t-PA in vitro. В настоящее время выпускаются специальные пробирки с кислым антикоагулянтом. t-PA имеет суточный ритм, поэтому его необходимо определять так же, как PAI-1. t-PA обладает высокой амидазной активностью, позволяющей эффективно использовать для его определения метод хромогенных субстратов. Однако при низких концентрациях t-PA в плазме требуется проведение дополнительных процедур непрямого определения активности фермента через плазминоген и использование растворимого фибрина (рис. 125). Определение t-PA проводится у больных с тромбофилией как часть панели тестов на выявление причины тромбофилии, особенно при нагрузочных манжеточных пробах. Повышение t-PA после инфаркта миокарда рассматривается как неблагоприятный фактор. Нарушение освобождения t-PA после венозного стаза описано у больных с тромбозами и патологией почек.
Рис. 125. Принцип определения тканевого активатора плазминогена (t-PA) хромогенным методом Обеспечение диагностики нарушений гемостаза в КДЛ Тесты активации свертывания крови
Определение D-димеров D-димеры - это специфические продукты деградации фибрина, входившего в состав тромба. Они образуются в процессе лизиса сгустка крови под влиянием плазмина и некоторых неспецифических фибринолитиков (рис. 60). Концентрация D-димеров в сыворотке пропорциональна активности фибринолиза и количеству лизируемого фибрина. Этот тест позволяет судить об интенсивности процессов образования и разрушения фибриновых сгустков. Определение D-димеров проводится иммуно-ферментным методом с использованием монокло-нальных антител, иммунодиффузии, методом тур-бидиметрии, латекс-агглютинации (табл. 32). Во всех методах исследования используются моно-клональные антитела к эпитопам на D-димере, которые образуются при расщеплении нерастворимого фибрина плазмином. Этих эпитопов нет на фибриногене и растворимых фибрин-мономерах, поэтому D-димеры - показатель того, что в процессе фибринолиза расщепляется именно фибрин, а не фибриноген или фибрин-мономеры. Поскольку эти антитела не взаимодействуют с фибриногеном, исследования могут проводиться как в плазме, так и в сыворотке. Принцип теста, основанный на методе ELISA на твердой фазе (стриппированные планшеты), с нанесенными на поверхность пластика первичными антителами, показан на рис. 126. Так как D-димеры - не стандартизованный аналит, то разные методы могут показывать разные результаты, несмотря на то, что используются специфические антитела и калибраторы. На определение D-димеров практически не оказывает влияние техника взятия крови, примесь тромбоцитов, не требуется использования ингибиторов для подавления других факторов. Повышение уровня D-димеров в крови определяется при возникновении венозных тромбозов, атеротромбозе, тромбоэмболии легочной артерии, ДВС-синдроме, после операций, особенно при большом операционном поле и других состояниях с повышенным образованием
Рис. 126. Принцип метода ELISA для определения D-димеров. Специфические антитела нанесены на твердую фазу (пластик). С ними взаимодействует субъединица D из пробы и остается иммобилизованной на твердой фазе, Добавляются проявляющие антитела, конъюгированные с ферментом, которые могут взаимодействовать только с D-ди-мерами. Несвязавшиеся антитела отмываются, добавляется субстрат для фермента, по изменению окраски раствора определяется количество D-димеров, D-мономеры, формирующиеся при деградации фибриногена и входящие в состав ПДФ, не определяются тестом на D-димеры
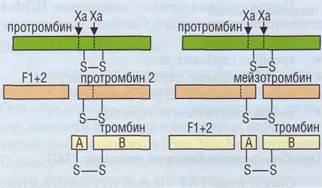
Характеристики методов определения D-димеров Таблица 32 Обеспечение диагностики нарушений гемостаза в КДЛ фибрина. D-димеры достаточно долго циркулируют в крови, время их полувыведения составляет более 24 ч, повышение D-димеров может персистировать в течение нескольких недель после острого тромбоза. Уровень D-димеров повышен у больных с тромбозом глубоких вен бедра, с тромбоэмболией легочной артерии, он может повышаться после обширных хирургических вмешательств, травм, при онкологических заболеваниях. На значение D-димеров влияют такие факторы, как величина тромба, время от начала клинических проявлений до назначения антикоагулянтной терапии, прием антикоагулянтов, на фоне которых уровень D-димеров постоянно снижается. Поэтому более важной для исключения диагноза тромбоза является отрицательная диагностическая значимость теста. Причем для разных тестов отрицательная диагностическая значимость колеблется от 78 до 100%, она выше у более чувствительных методов, что характерно для ИФА-ди-агностики. D-димеры определяются в моче, но их появление интерпретируется как маркер почечной дисфункции. Продукты деградации фибрина/фибриногена (ПДФ) Продукты деградации фибрина/фибриногена определяются традиционно в общей группе с использованием поликлональных антител. При этом антитела могут взаимодействовать с эпито-пами фибриногена, поэтому требуется не только использование сыворотки, но и полное удаление фибриногена с добавлением к крови тромбина или змеиного яда с тромбиноподобным эффектом. В последнее время для метода ELISA стали использовать моноклональные антитела к нео-эпитопам, которые образуются при деградации фибрина или фибриногена под влиянием плазми-на. Тем не менее трудно отдифференцировать ПДФ, образующиеся при деградации фибрина из тромба, от ПДФ, сформировавшихся при деградации фибриногена, особенно при использовании активаторов фибринолиза. Для определения ПДФ широко распространен метод латекс-агглютинации. Этот метод легко автоматизируется на турбидиметрах, но характеризуется относительно низкой специфичностью. Положительная проба - содержание ПДФ в плазме/сыворотке свыше 0,5 мкг/мл - указывает на: • ДВС-синдром; • тромбоз глубоких вен; • тромбоэмболию легочной артерии; • метастазы в легкие, рак яичников; • фибринолитическую терапию. Тромбин-антитромбиновый комплекс (ТАТ) Определение ТАТ - новый тест в диагностике ДВС-синдрома, он активно внедряется в практику клинико-диагностических лабораторий. Клиренс ТАТ из системы циркуляции достаточно быстрый, он удаляется в течение нескольких минут. Поэтому присутствие ТАТ в плазме свидетельствует об образовании тромбина in vivo непосредственно в момент взятия крови на исследование и о возможности истощения антикоагулянтов. В методе ELISA на твердую фазу нанесены антитела к тромбину. После отмывки проявляющие антитела связываются с антитромбином, присутствующем в ТАТ, оценка количества ТАТ проводится цветной реакцией. Определение ТАТ очень информативно в острой ситуации, непосредственно при тромбообразовании. В этом плане определение ТАТ по диагностическому значению схоже с определением фибринопептида А (ФПА), однако для ТАТ менее критичными являются требования к процедуре взятия крови. Иногда тест с некоторыми модификациями используется для определения антитромбина (AT). Фрагменты протромбина F1 +2 F1+2 - также новый тест, он отражает активность превращения протромбина в тромбин с участием протромбиназного комплекса (фактор Ха, фактор Va, фосфолипиды и Са2+), который формируется при активации системы плазменного гемостаза (рис. 127). Определение F1+2, так же как ТАТ, проводится с целью диагностики состояния гиперкоагуляции, которое может быть значимым при остром и хроническом ДВС, тромбозе глубоких вен бедра, эмболии легочной артерии, злокачественных опухолях и острых миелоидных лейкозах (протекающих с активацией системы свертывания), наличии факторов риска тромбоэмболии, остром инфаркте миокарда и
Обеспечение диагностики нарушений гемостаза в КДЛ синдрома. F1+2, в отличие от ТАТ, имеют относительно продолжительный период циркуляции в системе кровотока. Состояние гиперкоагуляции можно зарегистрировать с помощью как ТАТ, так и F1+2, тогда как состояние гипокоагуляции можно выявить только по уменьшению F1+2. Поэтому определение F1+2 проводится иногда с целью мониторинга антикоагулянтов непрямого действия, эффективности профилактического подкожного или внутривенного введения гепарина. Определение F1+2 можно использовать для решения вопроса о назначении/неназначении терапевтических вмешательств у пациентов с дефицитом антикоагулянтов и при беременности в случае риска возникновения тромбозов (табл. 33). Дата добавления: 2015-11-28 | Просмотры: 677 | Нарушение авторских прав |