 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Адгезивный поясокДесмосома Фибронектин – с внутренней стороны Адгезивный поясок
Нексусы обеспечивают метаболическую и электрическую связь
Отличие ресничек от микроворсинок: 1. Скелет образован микротрубочками, а не микрофиламентами, при этом у ресничек формируется аксонема 2. Толще микроворсинок в 2 раза 3. Локализация и способность волнообразным движениям
Вакуолярная система представлена ЭПА, АГ и лизосомами (возможно, преоксисомами)
Производные МФ: каркас микроворсинок грЭПС занимается «выпуском» белков либо на «экспорт», либо белков, входящих в состав органоидов клетки. Одним концом такая рибосома находится в полости ЭПС, куда и выходит после синтеза белок, а другим в цитоплазму. По окончании синтеза белка рибосома уходит в цитозоль, а белок в просвет ЭПС. В процессе модификации происходит фолдинг и химическая модификация. Процесс химической модификации продолжается в диктиосомах аппарата Гольджи; там же происходит и сортировка белков. гЭПС занимается синтезом липидов, а также обезвреживанием некоторых веществ. Это происходит за счет ферментов гидроксилирования. Вариантом гЭПС для мышц является САР. Мембрана лизосом располагает специальными белками-насосами, которые создают в самой лизосоме кислую сред оптимальную для действия гидролаз. При этом возникает вопрос: а как в таком случае гидролазы не переваривают собственную лизосому. Возможно, что это достигается путем гидроксилирования белков мембраны лизосомы.
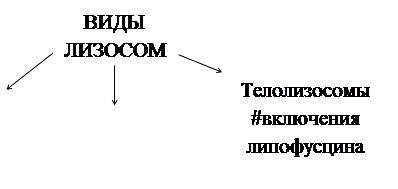
Существуют и другие гипотезы относительно лизосом. Например, некоторые авторы выделяют гидролазные пузырьки (первичную лизосому), раннюю эндосому (просто частицы, которые только поступили в клетку, но еще не расщепляются никакими ферментами) и позднюю эндосому (здесь происходит слияние первых двух). Когда pH среды в поздней лизосоме становится достаточно низким для действия гидролаз, то такую эндосому называют лизосомой. Пероксисомы – это органоиды похожи на лизосомы, но отличающиеся от них набором ферментов, которых там наблюдается четыре группы: a) Оксидазы аминокислот b) Оксидазы других веществ c) Ферменты, устраняющие d) Ферменты, катализирующие некоторые реакции обмена липидов Отличительно чертой пероксисом является наличие кристаллоидного нуклеоида.
Содержание свободных полисом особенно велико в быстрорастущих клетках Митохондрии – органоиды, жизненный цикл которых продолжается всего 10 дней. Меньшее по сравнению с ДНК ядра количество белков, образование свободных радикалов в митохондрии – причина увеличения частоты мутации в 10 раз. Микрофиламенты – это органоиды клетки, состоящие из глобулярных молекул актина и имеющие форму двойной спирали. Микрофиламенты связаны между собой с помощью филамина, а с белками плазмолеммы с помощью α-актинина. Наиболее значительный слой микрофиламентов т.н. кортикальный – наружный, прилежащий к плазмолемме. Эти органоиды выполняют не только структурообразующую роль, но также участвуют в различных формах клеточного движения. Также формируют скелет микроворсинки. Правда, в основании ворсинок нити актина соединены с миозином. В присутствии АТФ актиновые нити «втягиваются» миозиновыми. Промежуточные филаменты – органоиды клетки, имеющие тканеспецифичный белковый состав. Находятся параллельно поверхности клеточного ядра. Образуют ламину – пластинку на внутренней поверхности внутренней ядерной мембраны, к которой прикрепляются хромосомы. Микротрубочки состоят из белка тубулина. 13 субъединиц такого белка можно увидеть на поперечном разрезе микротрубочки (D=24 нм). У микротрубочки выделяют два конца (плюс и минус соответственно). Минус конец прикрепляется к т.н. сателлитам – особым белковым структурам. Другой же конец или свободен или также к чему-нибудь прикреплен. Помимо структурообразующей функции, важна также транспортная. Она осуществляется с помощью белков динеинов и кинезинов. Эти белки как тележки по рельсам перемещают органоиды, пузырьки и др. вдоль микротрубочки. В основе изменения длины микротрубочек лежит полимеризация\деполимеризация тубулина. Микротрубочки формируют центриоли. Две центриоли образуют диплосому. Диплосома плюс участок просветленной и содержащей сателлиты цитоплазмы (центросфера) – это клеточный центр. Аксонема – производное микротрубочек. Формула 9*2+2. Между соседними дуплетами имеются мостики (ручки из динеина), которые могут смыкаться\размыкаться. Этим и достигается биение ресничек. Жгутик от аксонемы отличается наличием базального тельца. Это органоид по структуре напоминающий центриоль. Длина всех молекул ДНК одной клетки человека – 185 см. В интерфазе хромосомы «прячутся» прикрепляясь к ламине. Функции Ядра многообразны: синтез субъединиц рибосом, транскрипция, созревание, репарация, апоптоз, регуляция транскрипции. В ядрах половых клеток помимо особого редукционного деления мейоза также значительно интенсифицированы процессы репарации и увеличена вероятность апоптоза. Эффективность репарации уменьшается на 1% каждый год (!). Хроматин – это совокупность всех интерфазных хромосом ядра. Само ядро состоит из белкового скелета (кариоскелета) и кариоплазмы. o Эухроматин – деспирализованный хроматин, находящийся в центре ядра; АКТИВНЫЙ o Гетерохроматин – спирализованных хроматин, находящийся преимущественно на периферии; НЕАКТИВНЫЙ
Половой хроматин – это деконденсированная половая хромосома у женщин. Часто видна на одном из сегментов ядра нейтрофилов. Хромосома = ДНК + белки(в 1,5 раза больше по массе) + РНК (регуляторная функция или не отделившиеся продукты транскирипции) дэнас
  
Уровни организации наследственного материала: I. Нуклеосома [кор + линкерные (link-связь) участки H1] для эухроматина
II. Нуклеомер ИЛИ хроматиновая фибрилла [нуклеосома + глобулярные белки] «супербусы» для гетерохроматина
III. Хромомеры [петли хроматиновой фибриллы собранные в петельные домены (розетки)] происходит за счет кислых белков.
IV. Хромонема ИЛИ хроматиновая фибрилла [розетки плотно прилегают друг к другу] – для метафазных хромосом
V. Хроматидный [хромонема тоже складывается] НУКЛЕО -СОМА -мер ХРОМО -МЕР -нема -тида Кариотип – совокупность всех особенностей строения метафазных хромосом Состав хромосомы: центромеры с кинетохором, плечи и теломеры
Компоненты ядрышка: глобулярный (субъединицы рибосомы), фибриллярный (пре-рРНК) и аморфный компонент (совокупность несколько раз повторенных генов рРНК). Ядерная оболочка двуслойна и имеет 2000-4000 ядреных пор. В каждой поре располагается комплекс поры (центральная и периферическая белковые гранулы, тонкая диафрагма и фибриллы, соединяющие центральную белковую гранулу с периферическими). Транспорт веществ в этом случае либо диффузия либо активный транспорт с затратой энергии ГТФ.
S – синтетический период 2nð4n
Однако данная схема характерна для клеток митотического типа. Однако клетки двух оставшихся типов, а также митотические клетки в определенной ситуации не будут делиться и вступят в фазу 1) Нехватка ресурсов 2) Отсутствие действия митогенов 3) Остановка в связи с репарацией 4) Дифференцировка 5) «Засыпание» для стволовых клеток
РЕГУЛЯЦИЯ МИТОТИЧЕСКОГО ЦИКЛА Осуществляется циклинами и циклинзависимыми киназами. В свою очередь эти белки регулируются сложными механизмами, включающими влияние на гены и на репликацию. МИТОЗ Профаза митоза начинается со спирализации хромосом, которая осуществляется конденсином при действии на него митозстимулирующего фактора. В профазу также пропадает ядрышко и прекращается синтез РНК, распад ламины с образованием микропузырьков. Происходит также распад АГ и ЭПС. Еще в синтетическом периоде удвоилось не только количество ДНК, но и количество диплосом, а теперь они идут к полюсам клетки и путем полимеризации наращивают микротрубочки. Метафаза. Основные события этого периода – это распад мембранных органоидов, образование веретен деления трех типов (кинетохорные, астральные и полярные). Здесь образуется фактор обеспечивающий анафазу. Механизм расхождения хромосом: 1) Укорочение кинетохорных МТ 2) Удлинение полярных МТ 3) Действие транслокаторов В конце анафазы митоз стимулирующий фактор уничтожается. В телофазе ядерная оболочка восстанавливается в двойном экземпляре. Причем сначала каждая хромосома покрыта своей ядреной оболочкой. Перетяжка осуществляется акто-миозиновой нитью. Апоптоз бывает 2-х видов: апоптоз изнутри и апоптоз по команде. Апоптоз осуществляется с помощью каспаз, эндонуклеаз и факторов, изменяющих плазмолемму. Регулируется апоптоз с помощью митохондриальных факторов и белка p53, который вырабатывается под действием трех протеокиназ, «замечающих» повреждение ДНК. Белок p53 действует следующим образом: влияет на клетки внешней секреции, которые секретируют вещества, ослабляющие пролиферацию и рост сосудов, останавливает клеточный цикл, способствует открытию специальных митохондриальных каналов, через которые выходит цитохром С и активирует систему каспаз, вызывает окислительный стресс. Каспазы – это ферменты разрушающие белки, особенно ядерные по аспарагиновой кислоте. Дата добавления: 2015-12-15 | Просмотры: 927 | Нарушение авторских прав |
 Вместо десмоплактинов – винкулин
Вместо десмоплактинов – винкулин
 НЕМЕМБРАННЫЕ ОРГАНЕЛЛЫ
НЕМЕМБРАННЫЕ ОРГАНЕЛЛЫ


 из среды (каталазы, пероксидазы)
из среды (каталазы, пероксидазы)






 РИБОСОМЫ
РИБОСОМЫ


 – пресинтетический период, в который в точку рестрикции под действием митогенов клеткой «принимается решение» о вступлении в деление 2n
– пресинтетический период, в который в точку рестрикции под действием митогенов клеткой «принимается решение» о вступлении в деление 2n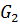 – постсинтетический период, когда происходит, например, синтез тубулина 4n
– постсинтетический период, когда происходит, например, синтез тубулина 4n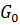 . Причинами этого явления могут быть:
. Причинами этого явления могут быть: