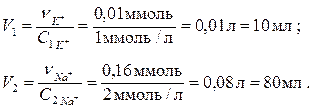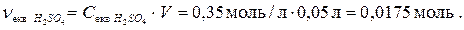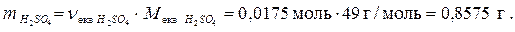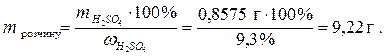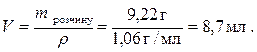|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Правильні відповіді. 1. Згідно з теорією розчинів, при розчиненні мають місце два процеси: руйнування первинної структури (кристалічної1. Згідно з теорією розчинів, при розчиненні мають місце два процеси: руйнування первинної структури (кристалічної, аморфної, надмолекулярної) та утворення сольватів – нестійких сполук, продуктів розпаду з молекулами розчинника (для води такі сполуки називаються гідратами). Перший процес є ендотермічним, тобто проходить з поглинанням енергії, а другий - екзотермічним (проходить з виділенням енергії). Розчинення амоній нітрату супроводжується зниженням температури. Це означає, що руйнування кристалічної структури потребує більше енергії, ніж виділяється при утворенні гідратів. А при розчиненні сульфатної кислоти, навпаки, виділяється набагато більше енергії при утворенні гідратів, ніж у першому процесі.
2. Якщо водолаз працює на значній глибині, то розчинність азоту повітря, яким він дихає, в нього в крові зростає. Це пов’язано з тим, що зі збільшенням глибини підвищується й тиск. А, як відомо, розчинність газів з підвищенням тиску зростає. Коли водолаза піднімати на поверхню без необхідної поступовості, то азот починає виділятися з такою швидкістю, що може викликати розрив судин або їх закупорювання. У літературі наведені випадки загибелі водолазів від кесонної хвороби.
3. Визначаємо кількість речовини катіонів Калію та Натрію в 0,25 л розчину: ν K+ = CK+ . V = 0,04 ммоль/л . 0,25 л = 0,01 ммоль; ν Na+ = CNa+ . V = 0,64 ммоль/л . 0,25 л = 0,16 ммоль. Визначаємо об’єми розчинів (1) та (2):
Для приготування 0,25 л потрібного розчину необхідно відібрати піпеткою 10 мл розчину (1) та 80 мл розчину (2), перенести ці об’єми в мірну колбу місткістю 0,25 л, довести рівень розчину дистильованою водою до риски. Готовий розчин перемішати.
4. Визначаємо кількість речовини еквівалента кислоти, що містить розчин, який треба приготувати:
Визначаємо масу кислоти:
Визначаємо масу розчину кислоти, який необхідно взяти для приготування заданого розчину:
Розраховуємо об’єм цього розчину:
Отже, для приготування 0,05 л розчину з молярною концентрацією еквівалента сульфатної кислоти 0,35 моль/л треба взяти піпеткою 8,7 мл розчину сульфатної кислоти з масовою часткою 9,3%, перенести в мірну колбу місткістю 50 мл та довести об’єм розчину в колбі дистильованою водою до риски.
Дата добавления: 2015-12-15 | Просмотры: 487 | Нарушение авторских прав 12 |