|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Электронограммы
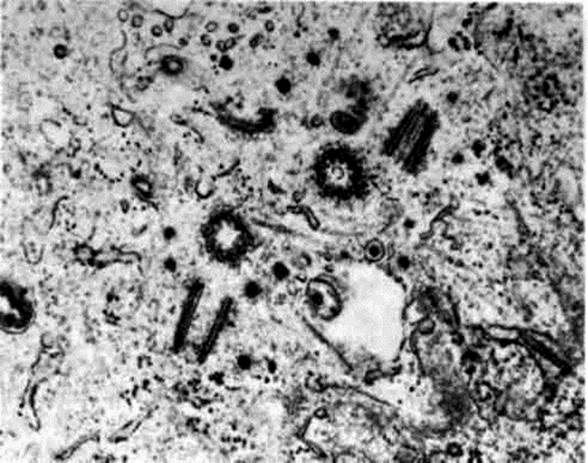
Рис. 1. Конденсация хромосом в профазе митоза. Происходит миграция одной пары центриолей (1), причем обе пары центриолей находятся по разным сторонам ядра (на фотографии видно только по одной центриоли из каждой пары). Ядерная оболочка (2) имеет глубокие впячивания напротив центриолей; ядрышко отсутствует. Хромосомы в полуконденсированном состоянии находятся в контакте с ядерной оболочкой.
Рис. 2. Животная клетка в период дифференцировки; х 20000. Клетка крови эмбриона мыши. Ядро имеет дольчатую форму, отношение массы ядра к массе цитоплазмы заметно увеличено. Хроматин находится в конденсированном состоянии в виде гетерохроматиновых сгустков (1). Ядерная оболочка пронизана многочисленными порами (6). Аппарат Гольджи (9), представленный в цитоплазме набором параллельных цистерн и пузырьков, находится в непосредственной близости от пары центриолей (7 и 8). Кроме того, цитоплазма содержит эндоплазматическую сеть (2), рибосомы, полисомы, митохондрии (3) и фагоцитозные вакуоли (5). Наружная клеточная мембрана (4) имеет извилистые очертания.
Рис. 3. Клетка в процессе активного синтеза белков. Фолликулярная клетка из яичника крысы; х 27500. Ядерная оболочка (1), плазматическая мембрана (2), цистерны шероховатой эндоплазматической сети (3). Последние расширены и заполнены гликопротеидами, имеющими высокую электронную плотность.
Рис. 4. Компартменты системы внутренних мембран. Обозначения: 1 – оболочка ядра, 2 – поры в оболочке ядра, 3 – полисомы, 4 – шероховатая эндоплазматическая сеть, 5 – гладкая эндоплазматическая сеть, 6 – переходные пузырьки, 7 – вакуоль, 8 – диктиосома, 9 – плазматическая мембрана.
Рис. 6. Синаптический контакт. Нервные клетки; х 100000. Проведение нервного импульса – чрезвычайно быстрый процесс, проявляющийся как зарядом на поверхности мембраны, так и секрецией химических соединений (ацетилхолина или норадреналина) в пресинаптическое пространство. Синапсом называется зона контакта между двумя клетками, через которую проходит передача нервного импульса с одной клетки на другую посредством химических веществ. На фотографии можно видеть окончания одного нервного волокна (А), контактирующего с другим (Б). Синаптические пузырьки волокна А содержат ацетилхолин, который поступает в межклеточное пространство и возбуждает мембранные рецепторы волокна Б. Цитоплазматические мембраны (1) образуют контакты совершенно другого рода; 2 – гликоген.
Рис. 7. Нервно – мышечное соединение (синаптический контакт). В нервных клетках – специальный вид контакта – синаптический, состоящий из пресинапса (окончание аксона клетки), из которого выделяется нейромедиатор в синаптическую щель, а далее постсинапс (тело другой нервной клетки, дендрит или орган – мишень) с рецепторами, улавливающими данный нейромедиатор.
Рис. 8. Межклеточное соединение – щелевидный контакт. Эмбрион мыши; х 72000. Такое соединение объясняет очень тесный контакт между двумя клетками и делает возможный ионный обмен (щелевидный контакт; показан стрелкой); 1 – цитоплазматическая мембрана соседних клеток. Контакт между кардиомиоцитами называется коммуникационным (щелевидным), когда мембраны клеток плотно прилежат друг к другу до 2 нм, соединяясь коннексоном – щель, ограниченная белковыми глобулами. Через щелевидный контакт происходит передача ионов и малых молекул от клетки к клетке.
Рис. 9. Большой и маленький щелевые контакты между культивируемыми фибробластами.
Рис. 10. Плотный контакт между эпителиальными клетками тонкого кишечника крысы. На срезе контакт виден в поперечном сечении как ряд местных слияний между плазматическими мембранами двух клеток. Эпителиальные клетки соединяются друг с другом при помощи плотного разделительного контакта – это зона максимального сближения мембран 2-3 нм. Этот контакт не проницаем для макромолекул и ионов.
Рис. 11. Гликокаликс (надмембранный комплекс клеточной поверхности). Яйцо медузы; х 15000. На фотографии видны микроворсинки (1) разветвленной формы и покрывающий их богатый полисахаридами слой – гликокаликс (2).
Рис. 12. Щеточная кайма клеток тонкого кишечника (микроворсинки) – это специальные органеллы данных эпителиальных клеток - выросты (складки) цитоплазматической мембраны клетки для увеличения клеточной поверхности.
Рис. 13. Клетки в корешке растения на различных стадиях митоза: профаза (спирализация хромосом, растворение ядерной оболочки, исчезновение ядрышка), прометафаза (движение хромосом к экватору), метафаза (образование экваториальной пластинки из спирализованных хромосом), анафаза (расхождение хроматид – дочерних хромосом к полюсам клетки), телофаза (цито- и кариокинез)
Рис. 14. Морфология клеточного деления. Первые стадии дробления яйца человека после оплодотворения in vitro; х 800. Образование 4-ёх клеток – бластомеров плодного яйца.
Рис. 15. Морфологические особенности ядра, находящегося в интерфазе. Кровеносный сосуд эмбриона крысы; х 10000. Хроматин в ядрах эпителиальных клеток (А) находится в деспергированном виде, хромосомы деспирализованы, клетки в активном состоянии. В клетке Б (будущем эритроците) хроматин местами конденсирован (стрелки), что соответствует его сниженной активности. Видны ядерная оболочка (1) и ядрышко (2).
Рис. 16. На электронограмме показана фибриллярная и гранулярная структуры ядрышка. Клетка эмбриона крысы, на примере которой хорошо видна двойственная природа строения ядрышек. Стадия 8 бластомеров; х 20000. Центральная часть, образовавшая компактную массу, состоит из фибриллярных структур толщиной от 6 до 8 нм (1). По краям эта масса преобразуется в шнуровидные образования, к которым в свою очередь присоединяются гранулы диаметром от 15 до 20 нм (2); 3 – оболочка ядра.
Рис. 17. На электронограмме показана фибриллярная и гранулярная структуры ядрышка. Клетки эмбриона крысы, на примере которых хорошо видна двойственная природа строения ядрышек. Стадия 16 бластомеров; х 27000. Участок, занятый фибриллярными структурами, значительно уменьшился. Это уменьшение прогрессивно нарастает в процессе последующих клеточных делений. Фибриллярный участок распадается на части и становится трудноразличимым. Обратите внимание на отсутствие мембраны у ядрышка. Обозначения такие же, как на рис. 16.
Рис. 18. Две мембраны ядерной оболочки. Оогония человека; х 65000. Внутренняя ядерная мембрана (1), наружная ядерная мембрана (2), перинуклеарное пространство (3), хроматин (4), ядерные поры (5), содержащие электронноплотное вещество, рибосомы (6).
Рис. 19. Вид ядерной оболочки сверху. Корешок гороха; х 50000. Хорошо видны многочисленные поры (1), занимающие около 25 % всей поверхности ядра. Количество и расположение пор меняется в зависимости от активности клетки.
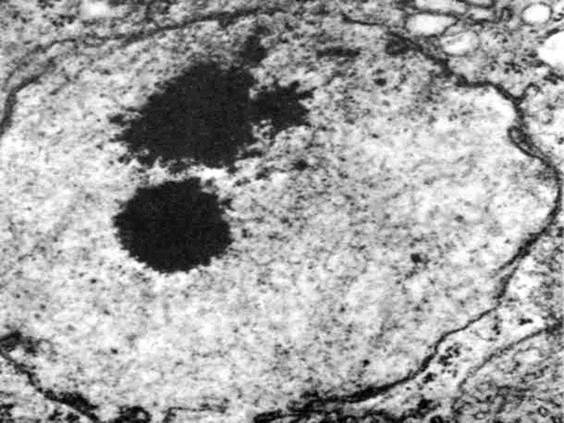
Рис. 20. Тонкий срез ядра клетки коры надпочечника
Рис. 21. Ядро клетки млекопитающего.
Рис. 22. Функционирование генов в гигантских хромосомах (политенные хромосомы). Слюнные железы личинки насекомого; х 900. В ядрах клеток слюнных желез многочисленные циклы редупликации ДНК, следующие один за одним, не сопровождаются разделением хромосом. Гигантские (политенные) хромосомы состоят из пучка интерфазных хромосом. Темные полосы ДНК (стрелка), состоят из ряда спирализованных участков (гетерохроматин – темный, неактиный) хромосом. Когда происходит деспирализация (эухроматин – светлый, активный), то в местах темных дисков появляются «пуффы» или «кольца Бальбиани» (1), где осуществляется синтез информационной РНК. 2 – ядрышко.
Рис. 23. Функционирование генов в хромосомах типа ламповых щеток. Ооцит тритона; х 900. Пара гомологичных хромосом была выделена из ядра клетки на стадии профазы мейоза. На этой стадии хромосомы имеют боковые выросты в виде петли, что придает им вид «ершика» (ламповой щетки). Эти петли являются местом синтеза РНК. Хромосомы в форме «ламповых щеток» свидетельствуют о высокой активности генов.
Рис. 25. Трехмерная структура Аппарата Гольджи. На микрофотографии видны два аппарата Гольджи: слева диктиосома в вертикальном разрезе, справа – самая верхняя цистерна, какой она видна сверху.
Рис. 26. Участок цитоплазмы в клетке млекопитающих. Цистерны, расположенные на транс – стороне каждой стопки цистерн Гольджи, выглядят темными благодаря красителю, выявляющему определенный фермент.
Рис. 27. Аппарат Гольджи растительной клетки в поперечном разрезе. Комплекс Гольджи – общая одномембранная органелла. Имеет две поверхности: цис-сторону – недеятельную, где находятся мелкие везикулы с материалом, синтезированным эндоплазматическим ретикулумом, и транс-сторону – деятельную с крупными вакуолями синтезированного диктиосомой секреторного материала. Структурно-функциональной единицей комплекса Гольджи является диктиосома – стопка уплощенных мембран.
Рис. 28. Объемная реконструкция диктиосомы. слева – цистерны в виде дисков; справа – перфорированные цистерны.
Рис. 29. Развитие диктиосомы. Данные исследований показывают, что существует мембранный «поток», который берет начало в шероховатой эндоплазматической сети и заканчивается секреторными вакуолями. Диктиосома имеет зону формирования и зону созревания продуктов секреции. Обозначения: 1 – секреторная вакуоль, 2 – зона созревания, 3 – цистерны, 4 – переходные пузырьки, 5 – зона формирования, 6 – рибосомы, 7 – эндоплазматическая сеть.
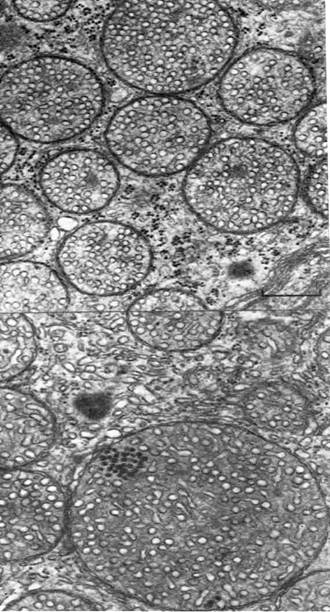
Рис. 30. Тонкий срез препарата шероховатых микросом, представляющих собой сферические пузырьки с прикрепленными к их поверхности рибосомами.
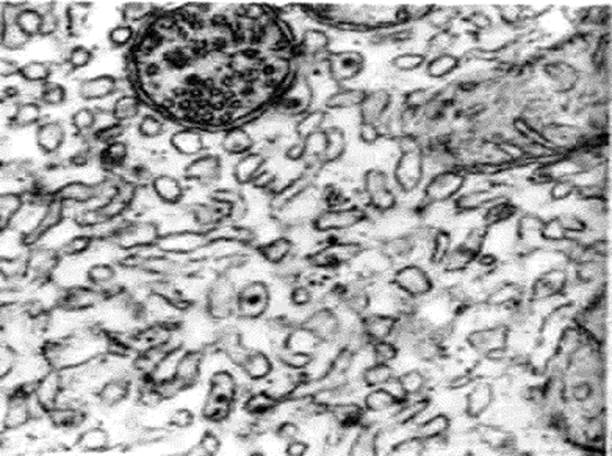
Рис. 32. Электронная микрофотография среза клетки млекопитающего, на которой виден гладкий и шероховатый эндоплазматический ретикулум.
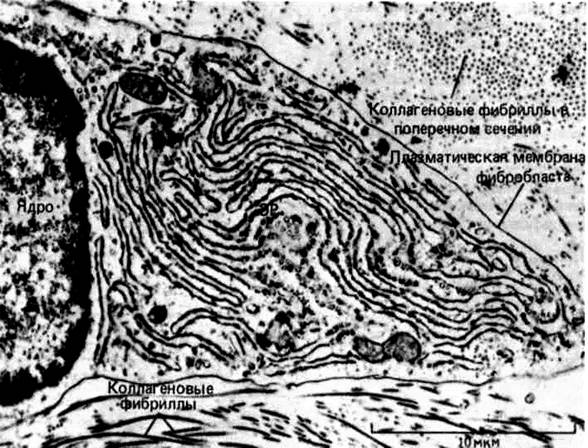
Рис. 33. Сильно развитый гранулярный эндоплазматический ретикулум (ЭР) фибробласта отражает способность этой клетки к интенсивному синтезу и секреции коллагена и других макромолекул внеклеточного матрикса.
Рис. 34. Эндоплазматическая сеть; х 25000. Поджелудочная железа лягушки. Плоские цистерны шероховатой эндоплазматической сети синтезируют и транспортируют белок.
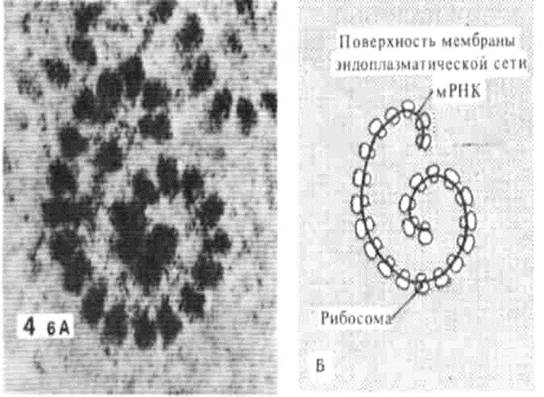
Рис. 35. Полисома (цепочка рибосом), синтезирующая белок на экспорт (для нужд организма) и ее схематическое изображение
Рис. 36. Эндоплазматическая сеть. Поджелудочная железа лягушки; х 25000. Трубочки гладкой эндоплазматической сети синтезируют и транспортируют липопротеиды и стероиды.
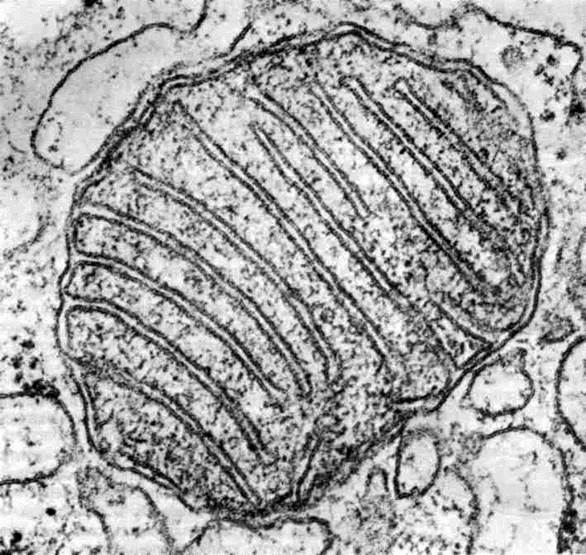
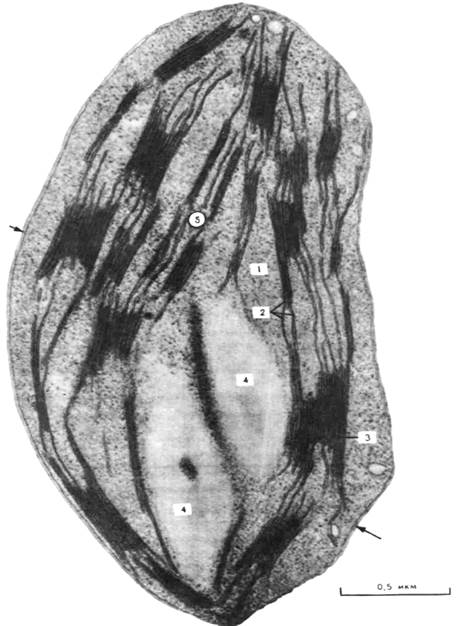
Рис. 37. Митохондрии с кристами в виде трубочек. Клетка коркового слоя надпочечника крысы; х 16700. Трубочковидные кристы часто можно встретить в митохондриях органов, которые вырабатывают стероиды. Некоторые из крист разветвлены и в целом занимают значительную часть объема митохондрии.
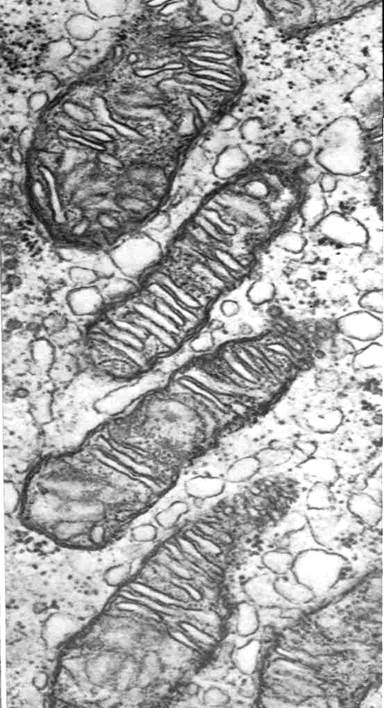
Рис. 38. Митохондрии с параллельными кристами. Клетка соединительной ткани яичника хомячка; х 70000.
Рис. 39. Общее строение митохондрии. Общая двухмембранная органелла, синтезирующая энергию. Наружная мембрана – гладкая, внутренняя – образует впячивания (кристы). Пространство между кристами заполнено матриксом, имеющим собственную ДНК, РНК, рибосомы, ферменты цикла Кребса.
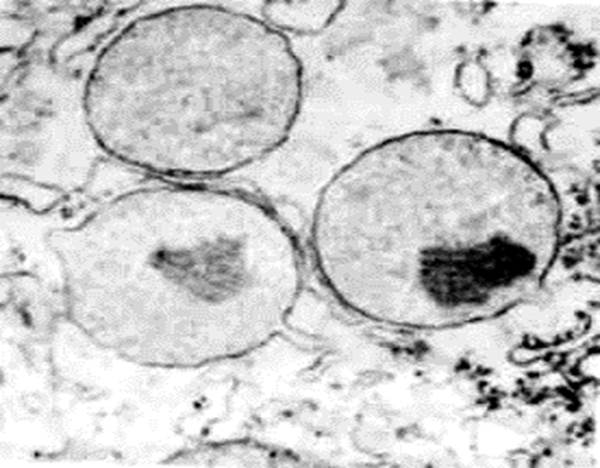
Рис. 40. Образование белковых кристаллов (включений трофического типа). Митохондрии из клеток корешка гороха; х 100000.
Рис. 41. Накопление металла в митохондриях (2) почки крысы в эксперименте. После введения животному солей золота (метод используется для терапии ревматических заболеваний) в клетках почки появляются гигантские митохондрии, содержащие плотный остаток: 1 – неизмененная митохондрия.
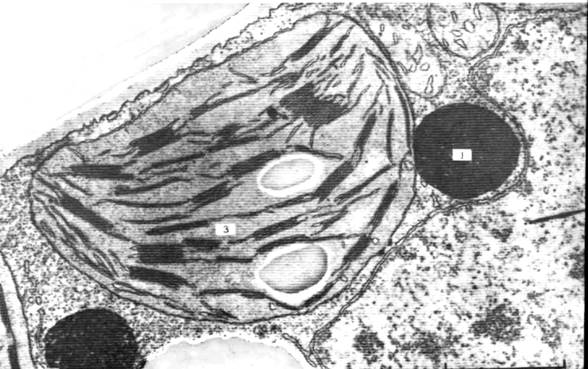
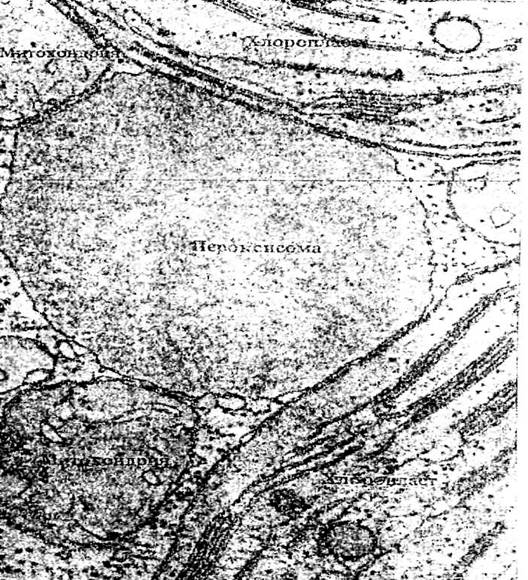
Рис. 42. Пероксисомы клетки печени. Пероксисомы – органеллы, метаболизирующие вредные для клетки и организма перекиси. В них можно видеть кристаллоподобные электронноплотные включения; кроме того, можно видеть тесную связь с мембранами эндоплазматического ретикулума.
Рис. 43. Обнаружение каталазы в пероксисомах. Лист табака; х 38000. На этих фотографиях можно видеть три клеточные структуры, участвующие в окислительно-восстановительных реакциях: пероксисомы (1), митохондрии (2) и хлоропласты (3). Каталаза обнаруживается только в пероксисомах, что и подтверждается темной окраской этих структур. Обращает на себя внимание близость в расположении пероксисом и хлоропластов, что соответствует возможности транспорта продуктов обмена хлоропластов к пероксисоме.
²
Рис. 44. Пероксисома. Наблюдается тесная связь между хлоропластами, пероксисомами и митохондриями.
Рис. 45. Ультратонкий срез хлоропласта. Лист табака; х 72000. Можно различить две внешние мембраны (стрелки), строму (1), содержащую рибосомы и телакоиды (2), либо свободно расположенные в строме, либо сгруппированные в граны (3). Видны также включения крахмала (4) и жировая капля (5).
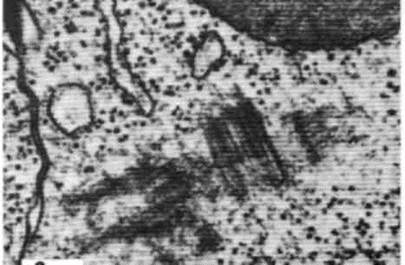
Рис. 46. Пара центриолей нервной клетки. Одна рассечена поперек, а другая вдоль; х 60000.
Рис. 47. Удвоение центриолей в процессе клеточного деления. Клетка медузы; х 58000. Дочерние центриоли (процентриоли) образуются перпендикулярно каждой из двух материнских.
Рис. 48. На электронной микрофотографии видны две новые центриоли, образовавшиеся в результате репликации двух материнских центриолей. На срезе одна центриоль из каждой пары видна в поперечном сечении, а другая – в продольном, так как в каждой паре центриоли расположены под прямым углом друг к другу.
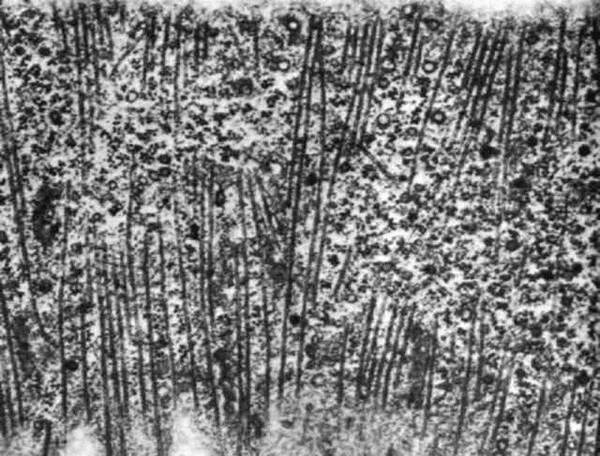
Рис. 49. Тангенциальный срез клетки из кончика корня тимофеевки. Кортикальные микротрубочки, лежащие под самой плазматической мембраной, расположены под прямым углом к продольной оси клетки.
Рис. 50. Электронная микрофотография микротрубочек, образовавшихся в результате полимеризации in vitro.
Список литературы 1. Джеральд М. Фаллер, Деннис Шилдс. Молекулярная биология клетки. Бином, 2011. 256 с. 2. Льюин Б., Кассимерис Л., Лингаппа В. Клетки. Бином. Лаборатория знаний, 2011. 952 с. 3. Пехов А.П. Биология. М.: Российский университет дружбы народов, 2010. 665 с. 4. Спирин А.С. Молекулярная биология клетки. Рибосомы и биосинтез белка. Академия, 2011. 512 с. Дата добавления: 2015-12-16 | Просмотры: 3319 | Нарушение авторских прав |
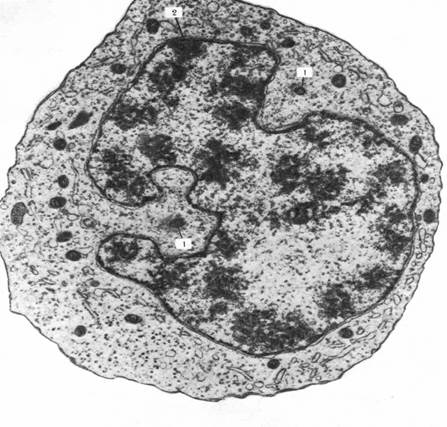
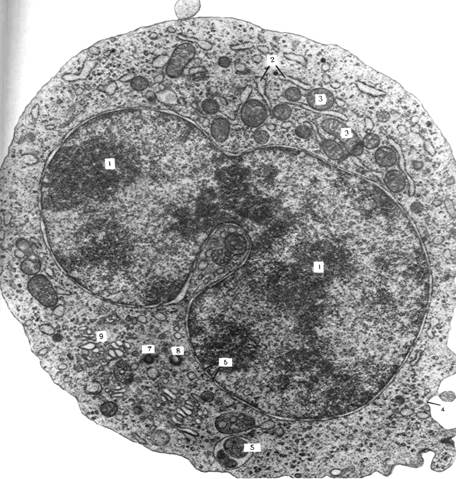
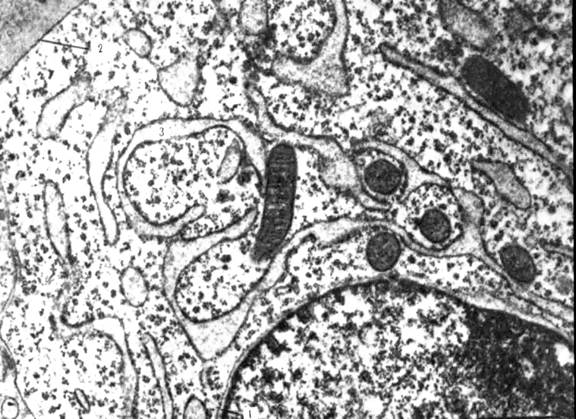
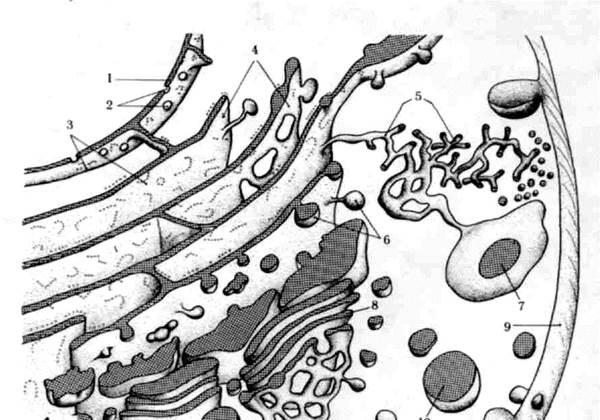
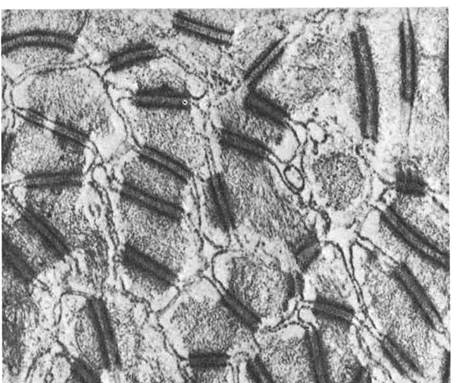 Рис. 5.Десмосома. Эпидермис теленка; х 50000. Десмосома обеспечивает очень плотную связь. Мембраны двух соседних клеток местами покрыты плотным материалом и многочисленными филаментами. Присутствие большого числа десмосом в эпидермисе объясняет прочное сцепление клеток этой ткани. Десмосома представляет собой межмембранное пространство 10-20 нм, заполненное веществом белковой природы. В цитоплазме в месте этого контакта видно скопление тонких микрофибрилл, направленных от соединения вглубь клетки на 0,32 – 0,5 мкм (десмосом).
Рис. 5.Десмосома. Эпидермис теленка; х 50000. Десмосома обеспечивает очень плотную связь. Мембраны двух соседних клеток местами покрыты плотным материалом и многочисленными филаментами. Присутствие большого числа десмосом в эпидермисе объясняет прочное сцепление клеток этой ткани. Десмосома представляет собой межмембранное пространство 10-20 нм, заполненное веществом белковой природы. В цитоплазме в месте этого контакта видно скопление тонких микрофибрилл, направленных от соединения вглубь клетки на 0,32 – 0,5 мкм (десмосом).
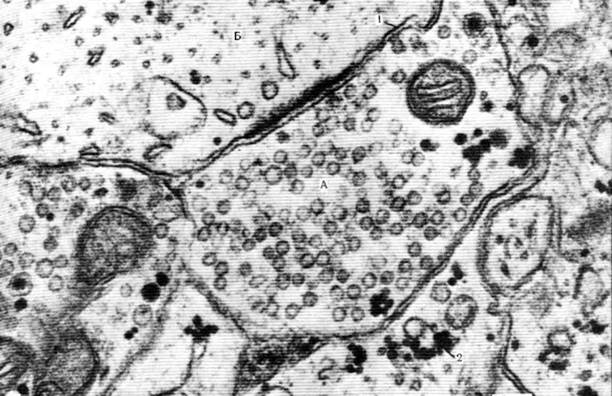
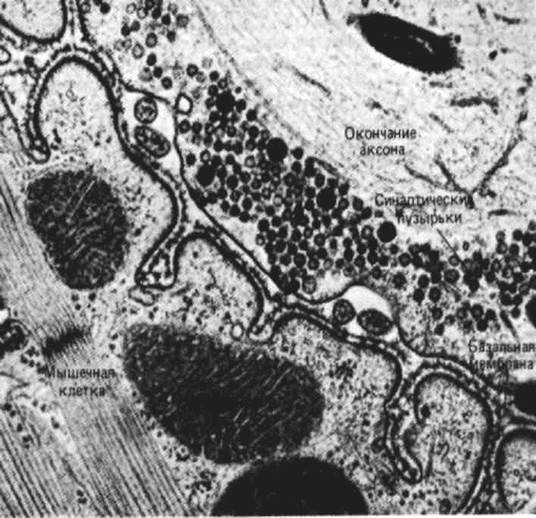
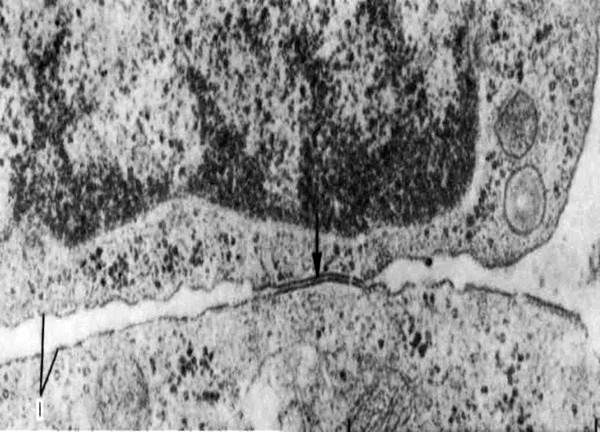
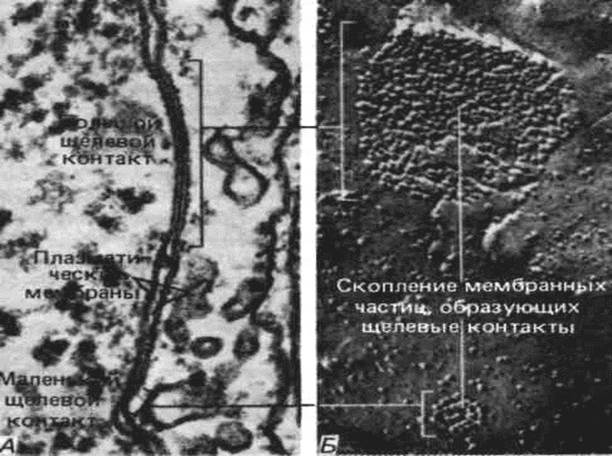
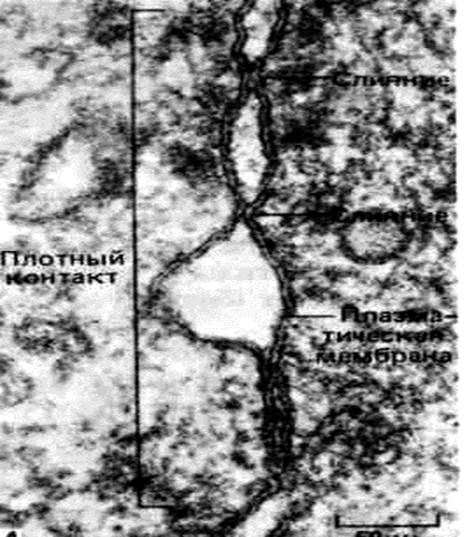
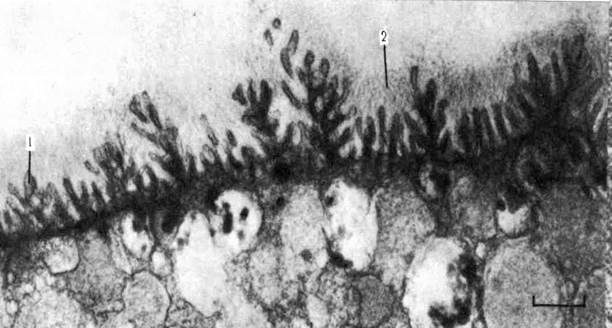
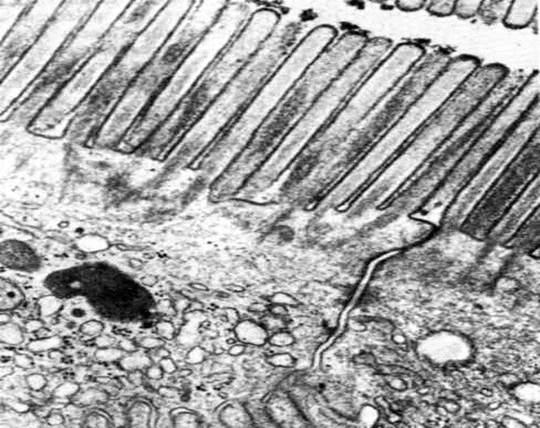
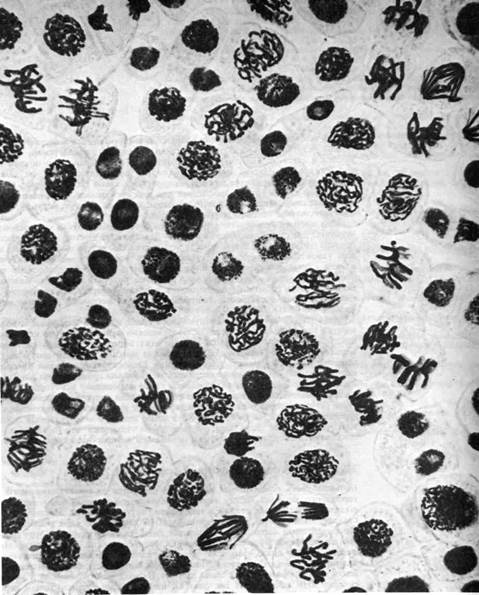
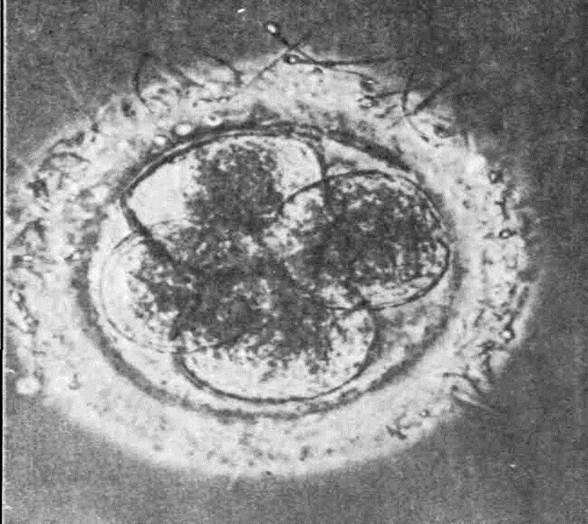
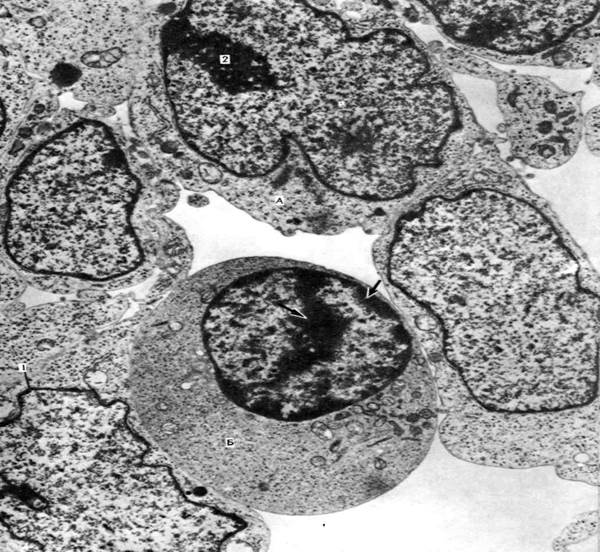
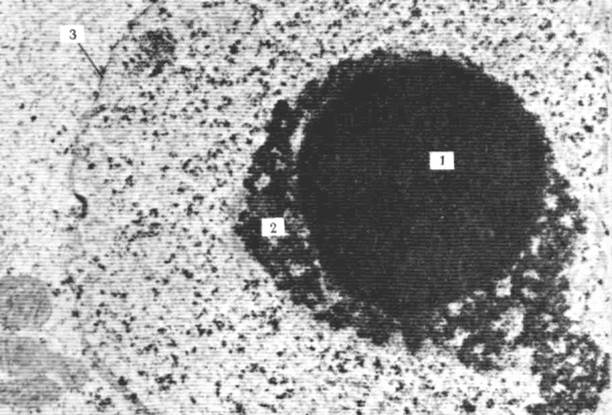
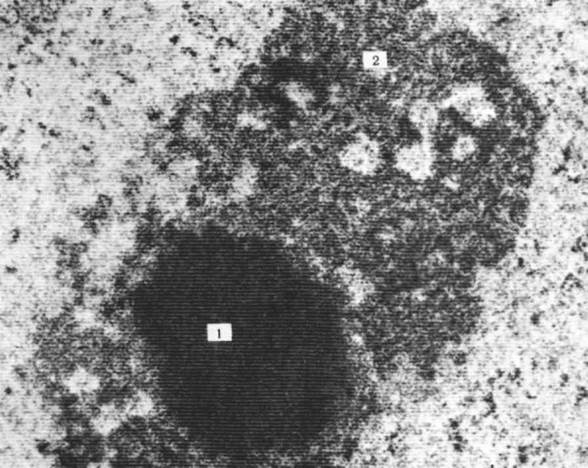
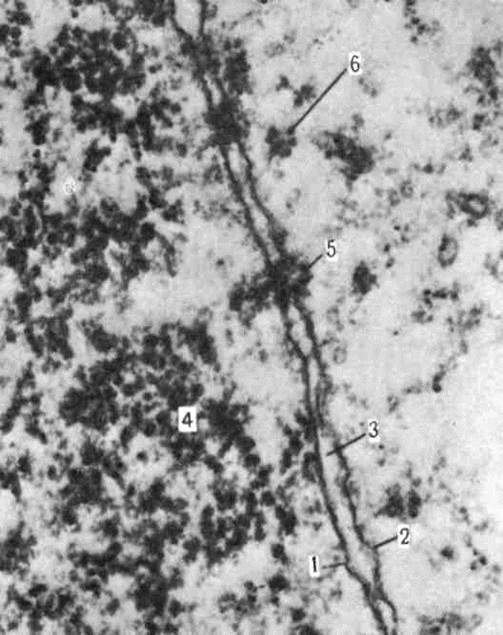
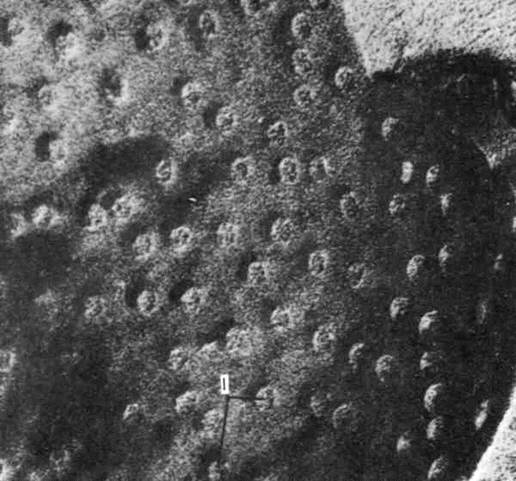
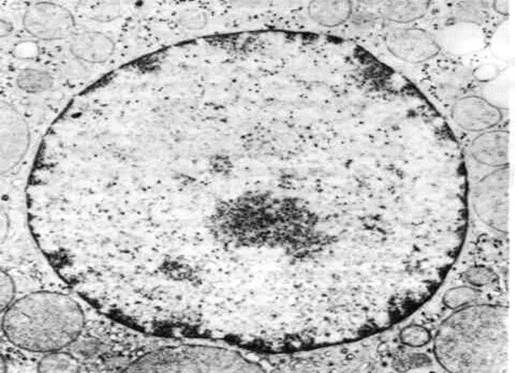
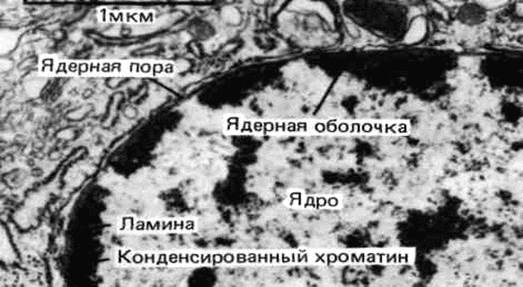
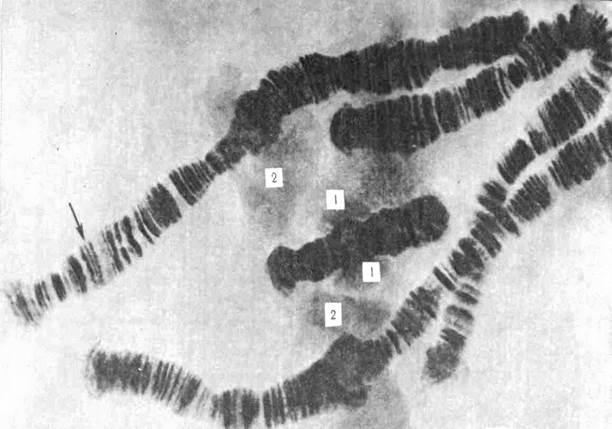
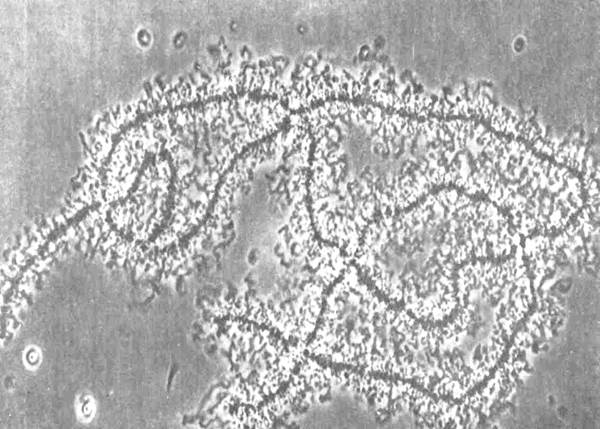
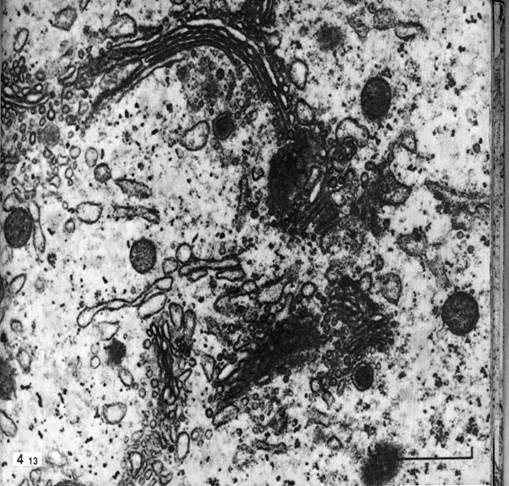 Рис. 24. Срез диктиосом комплекса Гольджи, различно ориентированных к плоскости сечения. Яйцеклетка крысы; х 31000.
Рис. 24. Срез диктиосом комплекса Гольджи, различно ориентированных к плоскости сечения. Яйцеклетка крысы; х 31000.
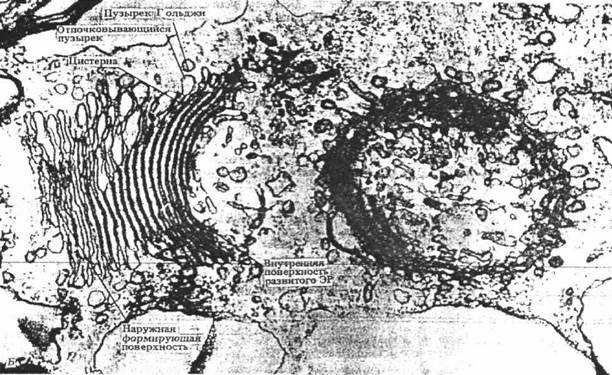

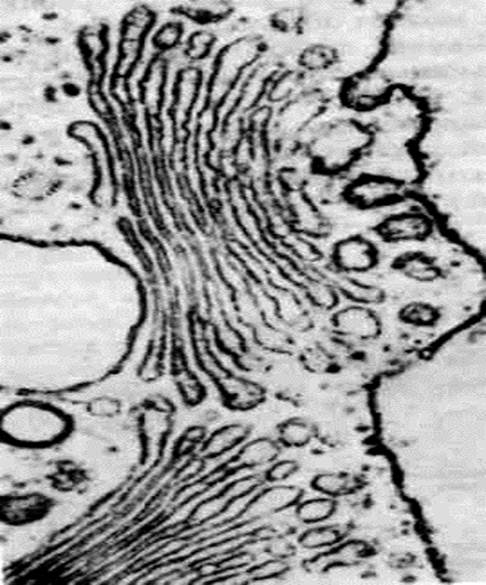
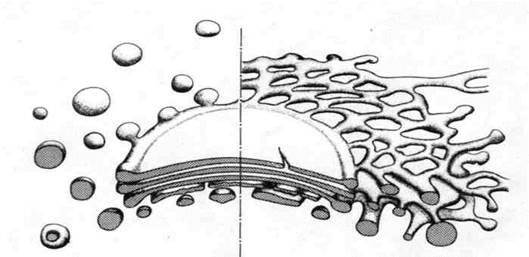
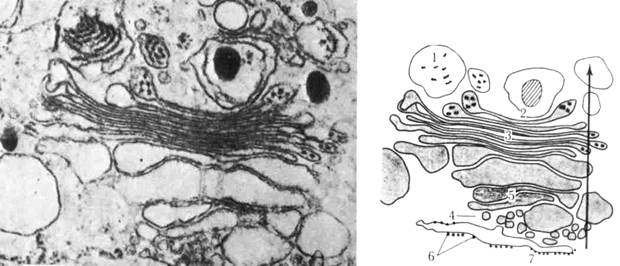
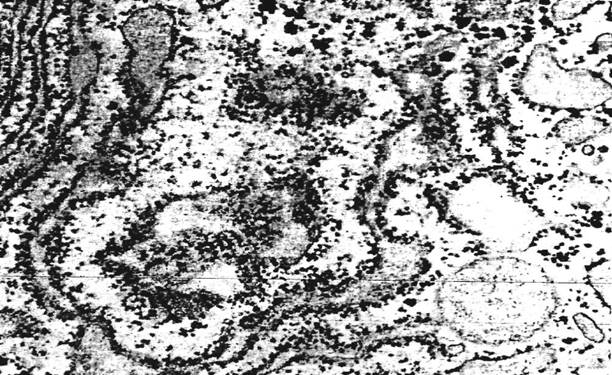
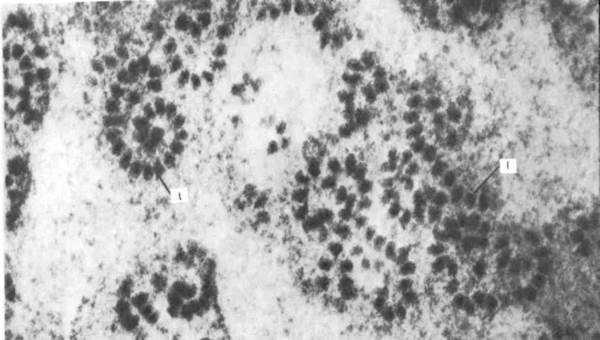 Рис. 31. Фрагмент шероховатой эндоплазматической сети в тангенциальном сечении; х 180000. На наружной поверхности цистерн расположены полисомы (1). Более плотные области соответствуют поверхности мембран.
Рис. 31. Фрагмент шероховатой эндоплазматической сети в тангенциальном сечении; х 180000. На наружной поверхности цистерн расположены полисомы (1). Более плотные области соответствуют поверхности мембран.