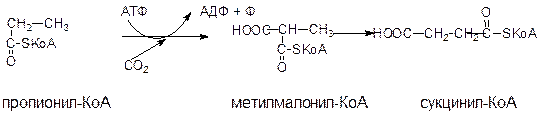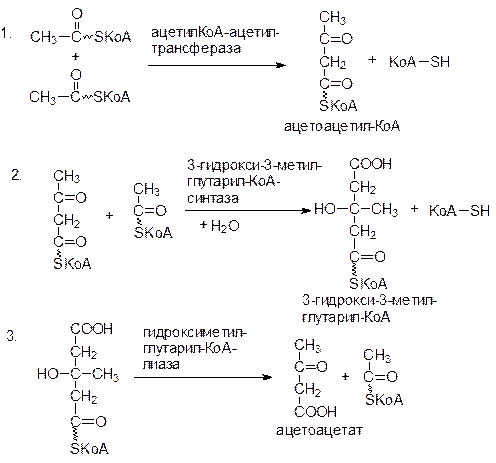|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Депонирование и мобилизация жировОбмен липидов
Липиды организма человека включают соединения, значительно различающиеся как по структуре, так и по функциям в живой клетке. Наиболее важными группами липидов с точки зрения функции являются: 1) Триацилглицеролы (ТАГ) – важный источник энергии. Среди питательных веществ они самые калорийные. Около 35% суточной потребности человека в энергии покрывается за счет ТАГ. В некоторых органах, таких как сердце, печень, свыше половины необходимой энергии поставляют ТАГ. 2) Фосфолипиды и гликолипиды – важнейшие компоненты клеточных мембран. При этом некоторые фосфолипиды выполняют особые функции: а) дипальмитоиллецитин является основным элементом сурфактанта легких. Его отсутствие у недоношенных детей может приводить к расстройствам дыхания; б) Фосфатидилинозитол является предшественником вторичных гормональных посредников; в) тромбоцит-активирующему фактору, являющемуся по своей природе алкилфосфолипидом, отводится важная роль в патогенезе бронхиальной астмы, ИБС и других заболеваний. 3) Стероиды. Холестерин входит в состав клеточных мембран, а также служит предшественником желчных кислот, стероидных гормонов, витамина D3. 4) Простагландины и лейкотриены – производные арахидоновой кислоты, выполняющие в организме регуляторные функции.
Обмен жирных кислот Источником жирных кислот для организма служат липиды пищи, а также синтез жирных кислот из углеводов. Использование жирных кислот происходит по трем направлениям: 1) окисление до СО2 и Н2О с образованием энергии, 2) депонирование в жировой ткани в виде ТАГ, 3) синтез сложных липидов. Все превращения свободных жирных кислот в клетках начинаются с образования ацил-КоА. Эта реакции катализируется ацил-КоА-синтетазами, локализованными на наружной митохондриальной мембране:
R-COOH + КоА + АТФ → ацил-КоА + АМФ + Н4Р2О7
С учетом этого обстоятельства основные пути превращений жирных кислот можно представить следующим образом:
Окисление жирных кислот с четным числом атомов углерода Окисление жирных кислот происходит в матриксе митохондрий. Однако, образовавшийся в цитоплазме ацил-КоА неспособен проникать через внутреннюю мембрану митохондрий. Поэтому транспорт ацильных групп осуществляется с помощью специального переносчика – карнитина (рассматривается как витаминоподобное вещество) и двух ферментов – карнитин-ацилтрансферазы I (КАТ 1) и КАТ 2. Сначала под действием КАТ 1 происходит перенос ацильных групп с ацил-КоА на карнитин с образованием комплекса ацил-карнитин:
Ацил-КоА + карнитин → ацил-карнитин + КоА
Образовавшийся ацил-карнитин проникает через внутреннюю мембрану митохондрий и на внутренней стороне внутренней мембраны митохондрий при участии фермента КАТ 2 происходит перенос ацильной группы с ацил-карнитина на внутримитохондриальный КоА с образованием ацил-КоА:
ацил-карнитин + КоА → Ацил-КоА + карнитин
Освободившийся карнитин вступает в новый цикл транспорта ацильных групп, а жирнокислотные остатки подвергаются окислению в цикле, получившем название β-окисления жирных кислот. Процесс окисления жирных кислот заключается в последовательном отщеплении двууглеродных фрагментов от карбоксильного конца жирной кислоты. Каждый двууглеродный фрагмент отщепляется в результате цикла из 4 ферментативных реакций:
Судьба образовавшихся продуктов: ацетил-КоА вступает в цикл лимонной кислоты, ФАДН2 и НАДН·Н+ передают протоны и электроны в дыхательную цепь, а образовавшийся ацил-КоА вступает в новый цикл окисления, состоящий из тех же 4-х реакций. Многократное повторение этого процесса приводит к полному распаду жирной кислоты до ацетил-КоА.
Расчет энергетической ценности жирных кислот на примере пальмитиновой кислоты (С16). Для окисления пальмитиновой кислоты с образованием 8 молекул ацетил-КоА требуется 7 циклов окисления. Количество циклов окисления рассчитывается по формуле: п = С/2 – 1,
где С – количество атомов углерода. Таким образом, в результате полного окисления пальмитиновой кислоты образуется 8 молекул ацетил-КоА и по 7 молекул ФАДН2 и НАДН·Н+. Каждая молекула ацетил-КоА дает 12 молекул АТФ, ФАДН2 – 2 молекулы АТФ и НАДН·Н+ – 3 молекулы АТФ. Суммируем и получаем: 8 · 12 + 7 · (2 + 3) = 96 + 35 = 131. После вычитания 2-х молекул АТФ, затрачиваемых на этапе активации жирной кислоты, получаем суммарный выход – 129 молекул АТФ.
Значение окисления жирных кислот Использование жирных кислот путем β-окисления происходит во многих тканях. Особенно велика роль этого источника энергии в сердечной мышце и в скелетных мышцах при длительной физической работе.
Окисление жирных кислот с нечетным числом атомов углерода Жирные кислоты с нечетным числом атомов углерода поступают в организм человека в небольших количествах с растительной пищей. Они окисляются в той же последовательности, что и жирные кислоты с четным числом атомов “С”, т.е. путем отщепления двууглеродных фрагментов с карбоксильного конца жирной кислоты. При этом на завершающей стадии β-окисления образуется пропионил-КоА. Кроме того, пропионил-КоА образуется при катаболизме аминокислот с разветвленным боковым радикалом (валина, изолейцина, треонина). Пропионил-КоА имеет свой путь метаболизма:
Сначала при участии пропионил-КоА-карбоксилазы происходит карбоксилирование пропионил-КоА с образованием метилмалонил-КоА. Затем метилмалонил-КоА под действием метилмалонил-КоА-мутазы превращается в сукцинил-КоА – метаболит цикла лимонной кислоты. Коферментом метилмалонил-КоА-мутазы служит дезоксиаденозилкобаламин – одна из коферментных форм витамина В12. При недостатке витамина В12 эта реакция замедляется и с мочой выводятся большие количества пропионовой и метилмалоновой кислот. Синтез и использование кетоновых тел Ацетил-КоА включается в цитратный цикл в условиях, когда окисление углеводов и липидов сбалансировано, т.к. включение ацетил-КоА, образовавшийся при окислении жирных кислот, в ЦЛК зависит от доступности оксалоацетата, являющегося в основном продуктом обмена углеводов. В условиях, когда преобладает расщепление липидов (сахарный диабет, голодание, безуглеводная диета) образовавшийся ацетил-КоА вступает на путь синтеза кетоновых тел.
Свободный ацетоацетат восстанавливается в ходе обратимой реакции до β-гидроксибутирата или декарбоксилируется спонтанно или ферментативно в ацетон. Ацетон не утилизируется организмом как источник энергии и выводится из организма с мочой, потом и выдыхаемым воздухом. Ацетоацетат и β-гидроксибутират в норме выполняют роль топлива и являются важными источниками энергии.
В связи с отсутствием в печени 3-кетоацил-КоА-трансферазы сама печень не способна использовать ацетоацетат в качестве источника энергии, снабжая им другие органы. Таким образом, ацетоацетат можно рассматривать как водорастворимую транспортную форму ацетильных остатков.
Биосинтез жирных кислот Синтез жирных кислот имеет ряд особенностей: 1. В отличие от окисления синтез локализован в цитозоле. 2. Непосредственным предшественником семи (из восьми) двууглеродных фрагментов молекулы пальмитиновой кислоты является малонил-КоА, образующийся из ацетил-КоА. 3. Ацетил-КоА непосредственно в реакциях синтеза используется как затравка. 4. Для восстановления промежуточных процессов синтеза жирных кислот используется НАДФН×Н+. 5. Все стадии синтеза жирной кислоты из малонил-КоА представляют собой циклический процесс, который протекает на поверхности синтазы жирных кислот или пальмитатсинтазы, так как основной жирной кислотой в липидах человека является пальмитиновая кислота.
Образование малонил-КоА из ацетил-КоА происходит в цитозоле. Ацетил-КоА, в свою очередь, образуется из цитрата, который поступает из митохондрий и в цитоплазме расщепляется с помощью фермента АТФ-цитратлиазы: Цитрат + АТФ + КоА → ацетил-КоА + оксалоацетат + АДФ + Н3РО4
Образовавшийся ацетил-КоА подвергается карбоксилированию с помощью фермента ацетил-КоА-карбоксилазы:
Ацетил-КоА-карбоксилаза – регуляторный фермент. Катализируемая этим ферментом реакция является лимитирующим этапом, определяющим скорость всего процесса биосинтеза жирных кислот. Ацетил-КоА-карбоксилаза активируется цитратом и ингибируется длинноцепочечными ацил-КоА. Последующие реакции протекают на поверхности пальмитатсинтазы. Пальмитатсинтаза млекопитающих является полифункциональным ферментом, состоящим из 2 идентичных полипептидных цепей, каждая из которых имеет 7 активных центров и ацилпереносящий белок, который переносит растущую жирнокислотную цепь из одного активного центра в другой. Каждый из белков имеет 2 центра связывания, содержащих SH-группы. Поэтому кратко этот комплекс обозначают:
Центральное место в каждом из белков занимает ацилпереносящий белок (АПБ), который содержит фосфорилированную пантотеновую кислоту (фосфопантетеин). Фосфопантетеин имеет на конце –SH группу. На первом этапе ацетильный остаток переносится на SH-группу цистеина, а малонильный остаток переносится на SH-группу 4`-фосфопантетеина пальмитатсинтазы (ацилтрансферазная активность) (реакции 1 и 2). Далее в реакции 3 ацетильный остаток переносится на место карбоксильной группы малонильного остатка; карбоксильная группа при этом отщепляется в виде СО2. Затем последовательно происходит восстановление 3-карбонильной группы (реакция 4), отщепление воды с образованием двойной связи между a- (2) и b- (3) углеродными атомами (реакция 5), восстановление двойной связи (реакция 6). В результате получается остаток четырехуглеродной кислоты, соединенной с ферментом через пантотеновую кислоту (бутирил-Е). Далее новая молекула малонил-КоА взаимодействует с SH-группой фосфопантетеина, при этом насыщенный ацильный остаток перемещается на свободную SH-группу цистеина. 1. Перенос ацетила с ацетил-КоА на синтазу.
2. перенос малонила с малонил-КоА на синтазу.
3. стадия конденсации ацетила с малонилом и декарбоксилирования образовавшегося продукта.
4. реакция первого восстановления
5. реакция дегидратации
6. реакция второго восстановления
После этого бутирильная группа переносится с одной HS-группы на другую, а на освободившееся место поступает новый малонильный остаток. Цикл синтеза повторяется. После 7 таких циклов образуется конечный продукт – пальмитиновая кислота. Процесс наращивания цепи на этом заканчивается и далее под действием гидролитического фермента молекула пальмитиновой кислоты отщепляется от молекулы синтазы.
Синтез ненасыщенных жирных кислот Образование двойной связи в молекуле жирной кислоты происходит в результате реакции окисления, катализируемой ацил-КоА-десатуразой. Реакция протекает по схеме: пальмитоил-КоА + НАДФН·Н+ + О2 → пальмитолеил-КоА + НАДФ+ + Н2О В тканях человека двойная связь в положении Δ9 молекулы жирной кислоты образуется легко, тогда как образование двойной связи между Δ9-двойной связью и метильным концом жирной кислоты невозможно. Поэтому человек не способен синтезировать линолевую кислоту (С18Δ9,12) и α-линоленовую кислоту (С18Δ9,12,15). Эти полиненасыщенные жирные кислоты используются в организме в качестве предшественников при синтезе арахидоновой кислоты (С20Δ5,8,11,14), поэтому они должны обязательно поступать с пищей. Эти полиненасыщенные жирные кислоты получили название незаменимых жирных кислот. Арахидоновая кислота, в свою очередь, служит предшественником при синтезе простагландинов, лейкотриенов и тромбоксанов.
Регуляция окисления и синтеза жирных кислот в печени В печени высоко активны ферментные системы как синтеза, так и распада жирных кислот. Однако эти процессы разделены в пространстве и во времени. Окисление жирных кислот протекает в митохондриях, тогда как синтез – в цитозоле клетки. Разделение во времени достигает действием регуляторных механизмов, заключающихся в аллостерической активации и ингибировании ферментов. Наибольшая скорость синтеза жирных кислот и жиров наблюдается после приема углеводной пищи. В этих условиях в клетки печени поступает большое количество глюкозы, глюкоза (в ходе гликолиза) окисляется до пирувата, часто которого превращается в оксалоацетат: пируват + СО2 ® оксалоацетат пируват ® ацетил-КоА Вступая в ЦЛК эти соединения превращаются в цитрат. Избыток цитрата выходит в цитозоль клетки, где активирует ацетил-КоА-карбоксилазу – ключевой фермент синтеза жирных кислот. С другой стороны цитрат является предшественником цитоплазматического ацетил-КоА. Это приводит к повышению концентрации малонил-КоА и началу синтеза жирных кислот. Малонил-КоА ингибирует карнитин-ацилтрансферазу I, в результате чего транспорт ацильных групп в митохондрии прекращается, а следовательно прекращается и их окисление. Таким образом, при включении синтеза жирных кислот автоматически выключается их распад. Наоборот, в период, когда концентрация оксалоацетата снижается, поток цитрата в цитозоль ослабевает и синтез жирных кислот прекращается. Уменьшение концентрации малонил-КоА открывает путь для ацильных остатков в митохондрии, где начинается их окисление. Этот механизм обеспечивает первоочередное использование углеводов: печень сберегает или даже пополняет запас жиров в организме, когда есть углеводы, и лишь по мере их исчерпания начинается использование жира.
Обмен триацилглицеролов Природные жиры представляют собой смесь ТАГ, различающихся по жирнокислотному составу. В ТАГ человека содержится много ненасыщенных жирных кислот, поэтому жир человека имеет низкую температуру плавления (10–15оС) и находится в клетках в жидком состоянии.
Переваривание жиров Жиры – одна из групп основных пищевых веществ человека. Суточная потребность в них составляет 50-100 г. У взрослого человека условия для переваривания липидов имеются только в верхних отделах кишечника, где имеется подходящая среда и куда поступают фермент – панкреатическая липаза и эмульгаторы – желчные кислоты. Панкреатическая липаза поступает в кишечник в реактивной форме – в форме пролипазы. Активация происходит при участии желчных кислот и еще одного белка панкреатического сока – колипазы. Последняя присоединяется к пролипазе в молярном отношении 2: 1. В результате липаза становится активной и устойчивой к действию трипсина. Активная липаза катализирует гидролиз эфирных связей в a- и a1-положениях, в результате образуется b-МАГ и освобождаются две жирные кислоты. В панкреатическом соке помимо липазы содержится моноглицеридная изомераза – фермент, катализирующий внутримолекулярный перенос ацила из b-положения МАГ в a-положение. А эфирная связь в a-положении чувствительна к действию панкреатической липазы.
Всасывание продуктов переваривания Основная часть ТАГ всасывается после расщепления их липазой на b-МАГ и жирные кислоты. Всасывание происходит при участии желчных кислот, которые образуют с МАГ и жирными кислотами мицеллы, которые проникают в клетки слизистой кишечника. Отсюда желчные кислоты поступают в кровь, а с ней – в печень и повторно участвуют в образовании желчи. Гепатоэнтеральная циркуляция желчных кислот из печени в кишечник и обратно имеет исключительно важное значение, обеспечивая всасывание больших количеств МАГ и жирных кислот (до 100 и более г/сутки) при относительно небольшом общем фонде желчных кислот (2,8-3,5 г). В норме не всасывается и выводится с калом лишь небольшая часть желчных кислот (до 0,5 г/сутки). При нарушении желчеобразования или выведения желчи условия для переваривания жиров и всасывания продуктов гидролиза ухудшаются, и значительная часть их выводится с калом. Это состояние называется стеаторреей. При этом также не всасываются жирорастворимые витамины, что приводит к развитию гиповитаминозов. Ресинтез жиров в клетках кишечника Большая часть продуктов переваривания липидов в клетках кишечника вновь превращается в ТАГ. Жирные кислоты образуют ацил-КоА, затем ацильные остатки переносятся на МАГ при участии ацилтрансфераз.
Образование жиров из углеводов Часть углеводов, поступающих с пищей, превращается в организме в жиры. Глюкоза служит источником ацетил-КоА, из которого синтезируются жирные кислоты. Необходимый для восстановительных реакций НАДФН×Н+ образуется при окислении глюкозы в пентозофосфатном пути, а глицерол-3-фосфат получается путем восстановления дигидроксиацетонфосфата – метаболита гликолиза.
В связи с отсутствием глицеролкиназы в жировой ткани, этот путь образования глицерол-3-фосфата является единственным в адипоцитах. Таким образом, из глюкозы образуются все компоненты, необходимые для синтеза жиров. Синтез ТАГ из глицерол-3-фосфата и ацил-КоА идет по схеме:
Синтез жиров из углеводов наиболее активно протекает с печени и менее активно в жировой ткани.
Депонирование и мобилизация жиров Жиры депонируются в специализированных клетках жировой ткани – адипоцитах. Жир в жировой ткани накапливается за счет двух источников: 1) поступает из липопротеинов и 2) образуется из глюкозы в самих адипоцитах. Мобилизация депонированных жиров происходит путем их гидролиза до жирных кислот и глицерина тканевыми липазами или триацилглицероллипазами. Мобилизация депонированного жира находится под гормональным контролем. В роли основного активатора выступает адреналин, действуя по тому же механизму, как и в случае мобилизации гликогена, т.е. через каскад реакций, включающий синтез цАМФ, активацию протеинкиназы А и фосфорилирование тканевой липазы. Жирные кислоты поступают в кровь, где образуют комплекс с альбумином и в такой форме транспортируется к органам и тканям. Глицерин транспортируется в растворенном состоянии и улавливается главным образом печенью. Здесь он превращается в глицерол-3-фосфат, который может вступать в реакции глюконеогенеза или окисляться в реакциях гликолиза и общего пути катаболизма. Ожирение Большая часть пищевых и синтезируемых в печени жиров проходит стадию депонирования в жировой ткани. У нормально упитанного человека жиры составляют около 15% массы тела. При полном голодании этот запас расходуется в течение 5-7 недель, т.к. его хватает на значительно большее время, чем запасов гликогена. При нормальном питании количество жира в организме здорового человека не изменяется. Однако и в этих условиях жиры жировой ткани постоянно обновляются. Другими словами одновременно и постоянно происходят депонирование и мобилизация жира с равными скоростями. В результате жиры жировой ткани за несколько дней обновляются полностью. При длительном голодании и систематических физических нагрузках скорость мобилизации жиров преобладает над скоростью депонирования, и количество депонированного жира уменьшается. Наоборот, если скорость мобилизации меньше скорости депонирования, то наступает ожирение. Первичное ожирение развивается в результате алиментарного дисбаланса – избыточной калорийностью потребляемой пищи по сравнению с энергетическими тратами организма. Количество потребляемой пищи зависит от многих факторов, в том числе и от регуляции чувства голода и насыщения. Голод и насыщение определяются концентрацией в крови глюкозы и гормонов желудочно-кишечного тракта (холецистокинина, нейротензина, бомбезина) и жировой ткани (лептина), инициирующих чувство насыщения. У человека и животных имеется ген ожирения – obese gene. Продуктом экспрессии гена ожирения является белок ob. Тривиальное название этого белка “лептин” (от греч. тонкий, худой). Он состоит из 145 аминокислот и действует как гормон, контролирующий массу жировой ткани. Одиночные мутации в гене лептина приводят к развитию ожирения. К настоящему времени описаны 5 одиночных мутаций в этом гене, которые ассоциируются с фенотипом ожирения. Для этого фенотипа характерны чрезмерное потребление пищи, низкая физическая активность, повышение отложения жиров в жировой ткани и развитие сахарного диабета II типа. Дата добавления: 2016-03-26 | Просмотры: 534 | Нарушение авторских прав |