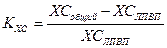|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ГиперлипопротеинемииЛП в крови имеются постоянно, но их концентрация меняется в зависимости от ритма питания. После приема пищи концентрация ЛП повышается, достигая максимума через 4-5 часов, а затем вновь снижается. За нормальное принимают содержание ЛП у здоровых людей через 10-12 часов после еды; кровь для анализа берут утром после ночного голодания. В этом состоянии в крови здоровых людей отсутствуют ХМ и обнаруживаются только ЛПОНП (~15% от всех ЛП), ЛПНП (60%) и ЛПВП (25%). Практически весь ХС и все жиры плазмы крови находятся в составе ЛП. В норме содержание общего ХС, т.е. суммы свободного и этерифицированного ХС в крови равно 150-280 мг/дл. При этом на долю эфиров ХС приходится 65-75% общего ХС. Содержание ТАГ в сыворотке крови в норме составляет менее 165 мг/дл. При повышенном содержании ЛП в крови (гиперлипопротеинемия) может быть повышено либо содержание ХС, либо содержание ТАГ, либо ХС и ТАГ одновременно. В связи с этим различают три формы гиперхолестеринемии (ГЛП): 1) гиперхолестеринемия (повышена концентрация ЛПНП и ЛПВП) 2) гипертриацилглицеринемия (повышена концентрация ХМ или ЛПОНП) 3) смешанная форма ГЛП – очень распространенные нарушения обмена: они обнаруживаются ~ у каждого десятого человека. По механизму возникновения ГЛП делят на наследственные (первичные) и приобретенные (вторичные). Примером наследственной ГЛП может быть гиперхиломикронемия (ГХМ). При этом заболевании имеется врожденный дефект ЛПЛ – ее активность в несколько раз ниже, чем у здоровых людей, либо дефицит апо С-II, вследствие чего ЛПЛ, присутствуя в нормальном количестве, не может гидролизовать ХМ и ЛПОНП. В результате резко повышается концентрация ТАГ в крови, их содержание в 10-40 раз превышает норму. В то же самое время содержание ХС лишь несколько превышает норму. Частым осложнением гиперхиломикронемии является панкреатит, который служит основной причиной смертности при этой болезни. Другой пример ГЛП – семейная гиперхолестеринемия (СГХС). Эта форма встречается значительно чаще – у 0,2% населения земного шара. Заболевание связано с наследованием дефектных генов, кодирующих рецептор ЛПНП. Поскольку рецептор-зависимый эндоцитоз играет основную роль в катаболизме ЛПНП, заболевание проявляется повышением в крови концентрации ЛПНП, а также ХС, поскольку его много в ЛПНП. Поэтому для СГХС характерно отложение ХС в тканях, в частности в коже (ксантомы), в стенках артерий. Отложение ХС в коронарных артериях является причиной высокой частоты ИБС и инфаркта миокарда, который у гомозигот может быть в очень раннем возрасте, даже в 10 лет. Вторичные ГЛП являются следствием таких заболеваний как сахарный диабет, гипертиреоз, гепатиты, нефрозы, прием пероральных противозачаточных препаратов. Атеросклероз ГЛП, сопровождающаяся гиперхолестеринемией, повышают риск развития атеросклероза. Вероятность развития атеросклероза тем выше, чем больше отношение концентраций ЛПНП и ЛПВП в крови. Главное биохимическое проявление атеросклероза – отложение холестерина в стенках артерий. В 1915 году русский ученый Аничков постулировал, что без холестерина не может быть атеросклероза. В экспериментах на кроликах, содержащихся на диете с высоким содержанием холестерина, он наблюдал развитие у них атеросклероза. Холестериновая концепция атеросклероза лежит в основе и современных взглядов на патогенез атеросклероза. Атеросклеротические изменения начинаются с появления липидных пятен или полосок на внутренней поверхности артерий. В аорте эти пятна и полоски впервые появляются еще в детском возрасте, примерно с трех лет. Затем на месте пятен и полосок появляются утолщения – фиброзные бляшки. При разрезании такой бляшки из нее выдавливается желтая кашица, состоящая в основном из эфиров холестерола. Бляшки могут изъязвляться. При этом изъязвленная поверхность служит местом образования пристеночных тромбов. Язвы зарастают соединительной тканью. В образующийся рубец откладываются соли кальция, что приводит деформации стенки сосуда и сужению просвета сосуда вплоть до его полной закупорки. Наиболее частыми и опасными осложнениями атеросклероза являются стенокардия, инфаркт миокарда, инсульт, облитерирующий эндартериит, почечная гипертония вследствие стеноза почечной артерии. Исследованиями последних лет показано, что гиперхолестеринемия является следствием образования в сосудистом русле модифицированных ЛПНП вследствие перекисного окисления, гликозилирования, ограниченного протеолиза и других процессов, происходящих в белковом или липидном компонентах частиц ЛПНП. Результатом этого является нарушение естественного катаболизма ЛПНП вследствие снижения их сродства к рецепторам ЛПНП и повышение уровня таких липопротеинов в крови. Модифицированные ЛПНП поступают в стенку артерий путем пассивной диффузии, где захватываются моноцитами-макрофагами (благодаря наличию у последних Скэвенджер-рецепторов). Ферментный набор макрофагов не способен катализировать какие-либо превращения ХС, кроме его этерификации. Поэтому ХС накапливается в клетках в больших количествах. Капли эфиров ХС в цитоплазме придают макрофагам характерный пенистый вид. Подавляющая часть пенистых клеток гибнет, при этом ХС выделяется в межклеточное пространство. Образуются очаговые скопления ХС и создается угроза развития сначала липидных пятен, а затем атеросклеротических бляшек. Между отложениями холестерина в артериях и ЛП крови происходит двусторонний обмен ХС, но при гиперхолестеринемии преобладает поток ХС в стенки артерий. Методы профилактики и лечения атеросклероза направлены на то, чтобы усилить обратный поток, обычно путем уменьшения гиперхолестеринемии. Для этого применяют малохолестериновую диету, лекарства, увеличивающие экскрецию ХС или ингибирующие его синтез. В особо тяжелых случаях снижение ХС в плазме крови достигается с помощью процедуры, получившей название плазмоферез. При плазмоферезе у больного забирают относительно большой объем крови, возвращают обратно форменные элементы, а вместо собственной плазмы вводят донорскую с низкой концентрацией ХС или раствор человеческого альбумина. Вероятность развития атеросклероза рассчитывается по формулам, учитывающим отношение атерогенных и антиатерогенных фракций ЛП. Наиболее известен холестериновый коэффициент атерогенности, предложенный акад. РАМН Климовым (1977 г.):
У здоровых лиц КХС не превышает 3-3,5. У больных ИБС величина коэффициента нередко достигает 5-6 и более единиц. Дата добавления: 2016-03-26 | Просмотры: 351 | Нарушение авторских прав |