 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Опухоли как мультифакториальная патология и болезни, обусловленные мутациями соматических клетокПроцесс канцерогенеза, несомненно, многоступенчатый, следовательно, конечный результат мультифакториально обусловлен. Выделяют 3 главные стадии возникновения и роста опухоли: инициацию, промоцию, прогрессию. На каждой из них развертываются скоординированные в патологическом направлении процессы сначала на молекулярном, а затем на клеточном уровне.Наследственная предрасположенность к злокачественным новообразованиям в меньшей степени выявляется в близнецовых исследованиях. Разница в конкордантности моно- и дизиготных близнецов имеется, но она небольшая.В развитии опухолей участвуют ДНК-вирусы и ретровирусы, которые интегрируются в геном клеток. Изучение их роли привело к открытию онкогенов в клетках млекопитающих. В нормальных клетках млекопитающих имеются последовательности ДНК, гомологичные вирусным онкогенам. Их назвали протоонкогенами (нормальный ген) или клеточными онкогенами (с онкогенными свойствами). Онкогены классифицируют на основе их клеточной локализации и функции кодируемых ими онкобелков на пути сигнальной трансдукции. Обнаружены и подробно изучены уже целые семейства онкогенов: факторы роста, рецепторы факторов роста, ГТФ-связывающие белки, пострецепторные тирозинкиназы, цитоплазматические онкогены, ядерные онкогены, онкогены апоптоза. В каждом из этих семейств выявлено несколько онкогенов, а общее их число уже превышает 40. Предполагается, что всего их не менее 80. В организме протоонкогены могут трансформироваться в клеточные онкогены и запускать генетический процесс озлокачествления через один из четырех механизмов. 1. Интеграция ретровируса в хромосому вблизи протоонкогена (инсерционный или вставочный мутагенез). В этом случае может начаться его неконтролируемая экспрессия. Результатом этого будет накопление в клетке достаточного количества онкогенных продуктов. 2. Второй механизм онкогенеза - это амплификация гена. Этот процесс повышает число копий онкогена в клетке в сотни раз, что ведет к образованию большого количества соответствующих онкопротеинов. Амплификация специфических протоонкогенов - признак определенных опухолей (например, в мелкоклеточном раке легкого находят амплификацию C-myc, N-myc и L-myc онкогенов). 3. Мутации в кодирующих последовательностях протоонкогенов приводят к синтезу онкогенных белков. Наряду с генными мутациями может наблюдаться существенная амплификация этого онкогена, что усиливает онкогенные свойства клетки. 4. Хромосомные мутации, а именно транслокации, могут нарушать биохимическую функцию или уровень протоонкогенной активности из-за другого окружения протоонкогена. Примером может быть хронический миелоидный лейкоз, при котором можно обнаружить так называемую филадельфийскую хромосому. Участок длинного плеча хромосомы 22 транслоцирован на длинное плечо хромосомы 9, а совсем небольшой участок хромосомы 9 реципрокно присоединен к хромосоме 22. В результате этой транслокации t(9;22)(q34; q11) клеточный онкоген c-abl с хромосомы 9 переносится в регион хромосомы 22 (ген bcr), что приводит к синтезу химерного продукта (c-abl и bcr), обладающего онкогенными свойствами.
Таблица 6.7. Синдромы и злокачественные опухоли с потерей гетерозиготности Как видно из табл. 6.7, для возникновения одной и той же опухоли необходима потеря гетерозиготности не в одном, а в нескольких локусах. Кроме того, нужны еще мутации в онкогенах. Многокомпонентность генетических событий очевидна. Злокачественные новообразования, развивающиеся на основе унаследованных мутаций, иногда имеют характер семейных синдромов, предрасполагающих к раку. Признаки таких синдромов в семье: 1) широко распространенные раки у близких родственников (I и II степени родства); 2) несколько близких родственников со сходными формами рака (например, молочной железы и яичника, кишечника и эндометрия); 3) 2 члена семьи со сходными редкими формами рака; 4) органов; 6) синхронность или непрерывность возникновения опухолей; 7) опухоли в органах двух разных систем у одного индивида.
CRC - колоректальный рак; endo - рак эндометрия; PSU- первичная локализация рака неизвестна; d - смерть. На рис. 6.10 приведены 3 родословные, отягощенные злокачественными новообразованиями в нескольких поколениях («раковые семьи»). Таким образом, медико-генетическое консультирование семьи с наследственной предрасположенностью к злокачественным новообразованиям - сложнейшая задача. Требуются специальная подготовка врачей-генетиков в вопросах генетических основ канцерогенеза и хорошая лабораторная база. Только такое сочетание позволяет правильно выявить предрасположенность членов семьи, определить необходимость их диспансерного наблюдения и характер профилактических мероприятий.
Дата добавления: 2016-03-26 | Просмотры: 458 | Нарушение авторских прав |
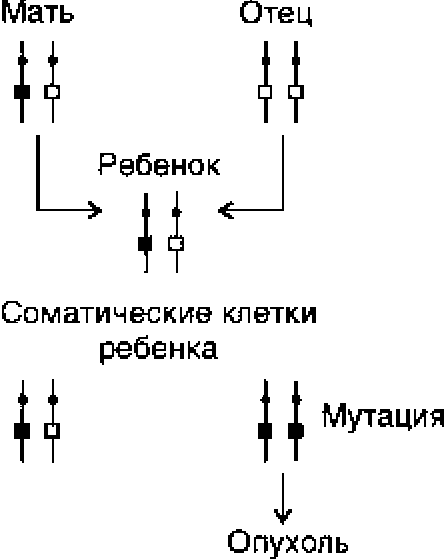

 Рис. 6.10. Примеры «раковых семей».
Рис. 6.10. Примеры «раковых семей».