|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Факторы патогенности.1.Факторы адгезии и колонизации. 2. Способность к внутриклеточному паразитированию, препятствовать фагоцитозу, размножаться в клетках лимфоидной ткани выражены у возбудителей брюшного тифа, паратифов-А и -В, способствуя хроническому носительству. 3.Эндотоксин (ЛПС). 4. Термолабильные и термостабильные энтеротоксины. 5. Цитотоксины. 6. Существенное значение имеют плазмиды вирулентности и R- плазмиды. 7. Vi - антиген ингибирует действие сывороточных и фагоцитарных бактериоцидных факторов. Основными факторами патогенности сальмонелл является их способность проникать в макрофаги и размножаться в лимфоидных образованиях собственно слизистого слоя тонкого кишечника (пейеровы бляшки, солитарные фолликулы), а также продукция эндотоксина. Экология и эпидемиология. Распространены повсеместно. Подавляющее большинство сальмонелл, циркулирующих во всех странах, так же как и у нас, относится к четырем серологическим группам — В, С, D, Е (98%) и только 2% — к остальным серогруппам. Почти 2/3 заболеваний связано с сальмонеллами группы В (S. typhimurium, S. heidelberg, S. derby). В нашей стране обязательная повсеместная адресная регистрация всех сальмонеллезов (не только пищевых токсикоинфекций, но и отдельных разрозненных спорадических случаев) введена с 1959 г. В связи с этим суждение о распространенности сальмонеллезов в предшествующие годы крайне затруднено. Имеются сведения о росте сальмонеллезных заболеваний в ряде стран Европы и США в период второй мировой войны и послевоенные годы, в основном за счет групповых вспышек. Аналогичная картина наблюдалась и у нас. В последнее 20-летие в нашей стране отмечается рост сальмонеллезных заболеваний, особенно у детей, в основном за счет спорадических случаев, которые составляют до 90% в сумме всех сальмонеллезов [Килессо В. А., 1980]. 1.2. Патогенез поражений Воротами инфекции является тонкая кишка, где происходит колонизация возбудителя и внедрение во внутреннюю фазу. До сих пор остается неясным, почему в большинстве случаев инфекционный процесс при сальмонеллезе ограничивается только этапом колонизации и инвазии в близлежащие ткани, что приводит к развитию гастроинтестинальной формы заболевания. Вместе с тем в незначительном проценте случаев в местах фиксации сальмонелл могут формироваться очаги пролиферативного, реже гнойного воспаления, что характерно для развития соответственно тифоподобной и септической формой сальмонеллеза. Захват сальмонелл макрофагами не приводит к их фагоцитозу. Они обладают способностью не только сохраняться, но и размножаться в макрофагах, преодолевать внутри них барьер кишечного эпителия, проникать в лимфатические узлы и кровь. Бактериемия у больных сальмонеллезом встречается часто, но обычно бывает кратковременной. В эксперименте показано, что бактериемия носит перемежающийся характер. Это объясняется чередованием размножения сальмонелл в макрофагах и последующим выходом в кровь. Энтеротоксин, активируя аденилатциклазу энтероцитов, приводит к нарастанию внутриклеточной концентрации циклического аденозинмо-нофосфата, фосфолипидов, простагландинов и других биологически активных веществ. Это приводит к нарушению транспорта ионов Na и С1 через мембрану клеток кишечного эпителия с накоплением их в просвете кишки. По возникающему осмотическому градиенту вода выходит из энтероцитов, развивается водянистая диарея. В тяжелых случаях заболевания вследствие потери жидкости и электролитов наблюдаются значительное нарушение водно-солевого обмена, уменьшение объема циркулирующей крови, понижение АД и развитие гиповолемического шока. Одновременно с потерей жидкости при сальмонеллезе развивается синдром диссеминированного внутрисосудистого свертывания, который является как следствием воздействия эндотоксина на свертывающую систему крови, так и гиповолемии. Страдает и сосудисто-нервный аппарат, что проявляется в понижении тонуса сосудов, нарушении терморегуляции. Иммунные реакции при сальмонеллезе представляются в виде сочетания так называемого местного (кишечного) иммунитета, который проявляется прежде всего гуморальной иммунной реакцией (секреция IgA) и слабовыраженной клеточной реакцией. Общая гуморальная реакция выражается продукцией различных классов иммуноглобулинов, а клеточная — повышением фагоцитарной активности макрофагов, тесно связанной с активной выработкой антител и реакцией последних с бактериальными антигенами. Образование антител у больных сальмонеллезом нередко рассматривают как реакцию, протекающую по типу вторичного иммунного ответа, так, как большинство взрослых людей неоднократно в течение жизни контактирует с сальмонеллами, в результате чего развивается сенсибилизация организма и возможны реакции гиперчувствительности. Развитие тифоподобной, септической, субклинической и хронических форм сальмонеллеза объясняется возникновением иммунологической толерантности к антигенам сальмонелл. Последняя является следствием либо мимикрии антигенов, либо результатом временного снижения функциональной активности фагоцитов и лимфоцитов макроорганизма (развития вторичного иммунодефицита). 1.3. Клинические проявления заболеваний Клинические проявления сальмонеллезных инфекций чрезвычайно разнообразны. Наряду с типичной клинической картиной брюшного тифа и острых токсикоинфекций с гастро-интестинальными симптомами могут наблюдаться симптомокомплексы, подобные дизентерии, холере, а иногда и септическая форма течения. В последние годы отмечается учащение случаев стертого и атипичного течения сальмонеллезов, обусловленное, очевидно, широким, но не всегда правильным применением антибиотиков при кишечных заболеваниях инфекционной природы. Многообразие клинических форм сальмонеллезной инфекции определяет ведущую роль бактериологического метода исследования в их выявлении и дифференциальной диагностике, указывая на необходимость поиска всех возможных представителей патогенных микроорганизмов кишечной группы. Инкубационный период при пищевом пути заражения колеблется от 6 ч до 3 суток (чаще 12—24 ч). При внутрибольничных вспышках, когда преобладает контактно-бытовой путь передачи инфекции, инкубация удлиняется до 3-8 дней. Выделяют следующие клинические формы сальмонеллеза: Наиболее частый клинический вариант при гастроинтестинальном сальмонеллезе - гастроэнтерический. Деструктивные изменения в толстой кишке (катарально-геморрагические) регистрируются лишь в 5-8% случаев. Гастроэнтероколитические и колитические варианты заболевания должны диагностироваться только, если в клинической картине заболевания преобладают проявления колита и имеется бактериологическое или серологическое подтверждение диагноза, так как эти варианты сальмонеллеза весьма сходны по течению с острой дизентерией. Тифоподобный вариант генерализованной формы. Заболевание чаще начинается остро. У некоторых больных первыми симптомами болезни могут быть кишечные расстройства в сочетании с лихорадкой и обшей интоксикацией, но через 1—2 дня кишечные дисфункции проходят, а температура тела остается высокой, нарастают симптомы общей интоксикации. У большинства больных по началу и течению заболевание сходно с брюшным тифом и паратифами А и В. Лихорадка может быть постоянного типа, но чаще волнообразная или ремиттирующая. Больные заторможены, апатичны. Лицо бледное. У некоторых больных на 2—3-й день появляется герпетическая сыпь, а с 6—7-го дня — розеолезная сыпь с преимущественной локализацией на коже живота. Наблюдается относительная брадикардия, понижение АД, приглушение тонов сердца. Над легкими выслушиваются рассеянные сухие хрипы. Живот вздут. К концу 1-й недели болезни появляется увеличение печени и селезенки. Длительность лихорадки 1—3 нед. Рецидивы отмечаются редко. Септический вариант сальмонеллеза характеризуется длительным течением и может закончиться летально, особенно в случаях сочетания с ВИЧ-инфекцией. Диагноз обычно устанавливают после выделения сальмонелл из гноя вторичного очага или из крови в первые дни болезни. У детей первого года жизни и лиц старше 60лет наблюдается более тяжелое течение сальмонеллеза с более частым вовлечением в патологический процесс толстой кишки, продолжительным бактериовыделением, замедленной нормализацией стула и большей частотой развития генерализованных форм. Острое носительство наблюдается у реконвалесцентов после манифестных форм сальмонеллеза; оно характеризуется выделением сальмонелл длительностью от 15 дней до 3 мес. О хроническом носительстве говорят, если сальмонеллы выделяются более 3 мес. Для подтверждения диагноза хронического носительства необходимо наблюдение в течение не менее 6 мес с повторными бактериологическими исследованиями кала, мочи, дуоденального содержимого. Из серологических реакций используют РИГА. О транзиторном бактериовыделении можно говорить в тех случаях, когда отсутствуют клинические проявления сальмонеллеза в момент обследования и в предыдущие 3 мес, когда положительные результаты бактериологического исследования отмечались 1-2 раза с интервалом один день при последующих отрицательных исследованиях. Кроме того, должны быть отрицательными серологические исследования (РИГА) с сальмонеллезным диагностикумом в динамике. 1.4. Иммунитет Постинфекционный иммунитет после брюшного тифа и паратифов хаарктеризуется высокой напряжённостью и сохраняется длительно. Повторные заболевания наблюдаются редко. К концу первой недели болезни в крови появляются агглютинины, преципитины, комплиментсвязывающие антитела, бактериолизины. Под влиянием этих антител происходит гибель бактерий с освобождением эндотоксинов и развитием основных симптомов заболеваний. Количество антител постепенно нарастает и достигает максимума на 14-15 день заболевания. Постинфекционный иммунитетпищевы токсикоинфекций, вызванных сальмонеллой, непродолжителен и не обладает достаточной напряжённостью. В сыворотке крови больных и реконвалесцентов обнаружены агглютинины, преципитины, бактериолизины и другие антитела. Заболевания, вызванные одними сероварами, не создают невосприимчивости к другим, а перенесенная инфекция не исключает реинфекцию. 1.5. Схема бактериологического обследования больных на тиф-паратифозную инфекцию. Материалом для бактериологического исследования при подозрении на инфекцию сальмонеллезной этиологии служат кровь, испражнения, рвотные массы или промывные воды желудка, дуоденальное содержимое, моча, а в тех случаях, когда заболевание заканчивается летально,— секционный материал (кусочки паренхиматозных органов, кровь из сердца, желчь, мезентериальные лимфатические узлы, содержимое и отрезок тонкой кишки). Выбор материала для лабораторного исследования определяется характером развития инфекционного процесса. Наиболее ранним и достоверным методом диагностики сальмонеллезов является выделение гемокультуры, поскольку бактериемия у больных возникает в конце инкубационного периода и сохраняется в течение всего периода лихорадочного состояния. Кровь для посева берут из вены локтевого сгиба в количестве 5—10 мл. Исследование испражнений при острых кишечных заболеваниях повторяют многократно; со дня поступления больного и до дня выписки его из стационара. Поскольку при сальмопеллезных инфекциях патологический процесс развивается в тонком кишечнике, пробы для бактериологического исследования следует брать из последней, более жидкой порции испражнений. В соответствии с этим для взятия материала не следует пользоваться ректальными трубками. При брюшном тифе интенсивное выделение бактерий начинается на 3-й неделе заболевания, так как в этот период патологический процесс и соответственно возбудитель заболевания сосредоточиваются в лимфатическом аппарате кишечника. Однако следует иметь в виду, что в дуоденальном содержимом тифопаратифозные бактерии обнаруживаются в l'/г—2 раза чаще, чем в испражнениях, поэтому естественно, что бактериологическое исследование желчи дает лучшие результаты, чем бактериологическое исследование кала. Зондирование производят в лечебных учреждениях по назначению лечащего врача. Пробы содержимого двенадцатиперстной кишки берут натощак. Примерно через 15 мин после введения дуоденального зонда начинает выделяться светлый дуоденальный сок — порция А. После этого в двенадцатиперстную кишку через зонд вводят 30—50 мл стерильного, слегка подогретого раствора сульфата магния, который вызывает сокращение и опорожнение желчного пузыря (порция В темно-зеленого или коричневого цвета) и выход желчи из желчных протоков (порция С светло-желтого цвета). Для бактериологического исследования используют порции В и С; они могут быть засеяны отдельно или же делают общий посев из смеси обоих порций. Исследование рвотных масс и промывных вод желудка производят при всех кишечных заболеваниях, сопровождающихся рвотой, и в случаях промывания желудка. Первичный посев и выделение сальмонелл из крови. Первый день. Кровь больного засевают немедленно после взятия во флакон с 10—20% желчным бульоном (рец. 76) или в среду Рапопорт (рец. 77). Желчь, содержащаяся в питательных средах, способствует росту тифопаратифозных бактерий, подавляет действие антител и предотвращает свертывание крови. Высокий процент высеваемости тифопаратифозных бактерий отмечается также при посеве крови на голодную среду Клодницкого (рец. 78). Объем питательной среды для подавления бактерицидных свойств сыворотки должен в 10 раз превышать количество засеваемой крови. Второй день. 1. Просматривают колбы с посевами. Размножение бактерий тифопаратифозной группы в среде Рапопорт проявляется уже через 24—48 ч; питательная среда, совершенно прозрачная до посева, становится мутной. На дне сосуда обнаруживается желто-серый гомогенный осадок белков крови. Изменяется и цвет питательной среды: из желтой она становится розоватой вследствие восстановления индикатора Андреде, что свидетельствует о расщеплении с образованием кислоты входящих в ее состав глюкозы или ман-нита. Размножение паратифозных бактерий сопровождается появлением газа в поплавке. Размножение бактерий в желчном бульоне или стерильной воде (при посеве крови по Клодницкому) в первые 2—3 дня после произведенного посева не всегда сопровождается помутнением среды. 2. Из среды с первичным посевом крови независимо от того, имеются ли в ней внешне выраженные признаки микробного? роста, делают высев на чашки с висмут-сульфитным агаром (рец. 82), средой Плоскирева (рец. 81), Эндо (рец. 79) и Левина (рец. 80). Засеянные среды помещают в термостат вместе с первичным посевом крови; его сохраняют для повторных высевов на тот случай, если на плотных питательных средах не обнаружатся колонии, характерные для тифопаратифозных бактерий. Повторные высевы со сред обогащения производят на 2-е, 3-й, 5-е, 7-е и 10-е сутки. В случае отсутствия характерных колоний после высева, произведенного на 10-е сутки, лаборатория дает отрицательный ответ и прекращает исследование. Первичный посев и выделение сальмонелл из дуоденального содержимого. Желчь, полученную для бактериологического исследования, засевают: а) на плотные питательные среды Плоскирева (рец. 81), висмут-сульфитный агар (рец. 82), среду Левина (рец. 80) и Эндо (рец. 79); б) во флаконы с бульоном так, чтобы соотношение между исследуемым материалом и питательной средой составляло 1:10. Оставшийся от посева материал, являющийся питательной средой, благоприятной для бактерий, ставят в термостат вместе с посевами. В течение 10 дней из него производят высевы на плотные дифференциально-диагностические среды. При обнаружении колоний, подозрительных на патогенные бактерии кишечной группы, дальнейшее изучение посевов крови и дуоденального содержимого ведется по общей схеме, приводимой ниже. В настоящее время для диагностики бактерий группы сальмонелл медицинская промышленность Советского Союза выпускает следующий набор сывороток. 1. Агглютинирующая адсорбированная поливалентная сальмонеллезная О-сыворотка (группы А, В, С, D, Е). 2. Агглютинирующая адсорбированная поливалентная сальмонеллезная О-сыворотка редких групп (по рецепторам). 3. Агглютинирующие адсорбированные сальмонеллезные О-сывороткн, рецепторы (с 1-го по 53-й). 4. Агглютинирующие адсорбированные сальмонеллезные Н-сывороткн, рецепторы (а, Ь, с, d, е — до г 36; 1,5; 1,6; 1,7). 5. Агглютинирующая неадсорбированная брюшнотифозная сыворотка. 6. Агглютинирующая неадсорбированная паратифозная А-сыворотка. 7. Агглютинирующая неадсорбированная паратифозная В-сыворотка. 8. Агглютинирующая неадсорбированная сыворотка S. typhimurium. 9. Агглютинирующая неадсорбированная сыворотка S. cholerae suis. 10. Агглютинирующая неадсорбированная сыворотка S. newport. 11. Агглютинирующая неадсорбированная сыворотка S. enteritidis. Сухие, адсорбированные поливалентные и монорецепторные сыворотки разводят 1—2 мл (как указано на этикетке ампулы) стерильного изотонического раствора хлорида натрия, что соответствует первоначальному объему сыворотки до высушивания. Растворенные сыворотки используют в реакции агглютинации на стекле без дополнительного разведения. Культуры бактерий, не реагировавшие со смесью сывороток; А, В, С, D и Е, испытывают со смесью О-сывороток редко встречающихся групп сальмонелл: F, Q, Н, I и т. д. и затем при положительном результате реакции агглютинации испытывают раздельно с каждой монорецепторной О-сывороткой, входившей в состав смеси. 1.6. Лечение и профилактика сальмонеллезов. Больных сальмонеллезом госпитализируют по клиническим (тяжелое и средней тяжести течение) и эпидемиологическим (лица, живущие в общежитиях, декретированное население) показаниям. Остальные лечатся в домашних условиях. При гастроинтестинальных формах этиотропная терапия показана только при среднетяжелом и тяжелом течении заболевания. Назначают фторхинолоны: иипрофлоксацин по 1,0 г/сут, норфлоксацин или офлоксацин по 0,8 г/сут на 3-5 дней. Необходимо как можно раньше промыть желудок 2—3 л воды или 2% раствора натрия гидрокарбоната. Промывание проводят с помощью желудочного зонда до отхождения чистых промывных вод. При легких формах ограничиваются промыванием желудка, диетой и питьем солевых растворов. Обычно используют раствор следующего состава: натрия хлорида — 3,5 г, калия хлорида —1,5 г, натрия гидрокарбоната — 2,5 г, глюкозы — 20 г на 1 л питьевой воды. Количество жидкости должно соответствовать ее потерям (не более 3% массы тела). При средней тяжести течения гастроинтестинальной формы сальмонеллеза, отсутствии рвоты и выраженных нарушений гемодинамики жидкость также можно вводить перорально. При повторной рвоте и нарастании обезвоживания растворы вводят внутривенно. Объем вводимой жидкости определяется степенью обезвоживания. Растворы вводят подогретыми до 38-40°С со скоростью 40-48 мл/мин. Наиболее эффективен раствор «Квартасоль», содержащий на 1 л апирогенной воды 4,75 г натрия хлорида, 1,5 г калия хлорида, 2,6 натрия ацетата и 1 г натрия гидрокарбоната. Можно использовать и другие полиионные растворы: «Три-соль» (5, 4, 1) — натрия хлорида 5 г, натрия гидрокарбоната 4 г, калия хлорида 1 г на 1 л воды; «Ацесоль» — натрия хлорида 5 г, натрия ацетата 2 г, калия хлорида 1 г на 1 л апирогенной воды и другие растворы («Хлосоль», Рингерлактат). Нельзя вводить изотонический раствор натрия хлорида или глюкозы, так как они не восполняют дефицит калия и оснований. Патологическое действие эндотоксина сальмонелл опосредуется частично через усиление синтеза простагландинов. Поэтому патогенетически обоснованным является включение в комплексную терапию сальмонеллезов препаратов, обладающих антипростагландиновой активностью: индометацина или ацетилсалициловой кислоты. Индометацин рекомендуется применять внутрь по 50 мг 3 раза в течение первых 12 ч, аспирин — по 0,25-0,5 г 3 раза в первые сутки лечения в стационаре. К лекарственным препаратам, стимулирующим абсорбцию ионов натрия из просвета кишки, относятся производные морфина, в частности широко применяемый в последнее время лоперамид (имодиум). Его назначают однократно 4 мг (2 капсулы) и затем по 2 мг после каждой дефекации, но не более 16 мг в сутки. В случае отсутствия эффекта в течение 48 ч лечение прекращают. Однако препарат, снижая перистальтику кишки, увеличивает продолжительность контакта с сальмонеллами, что может усиливать интоксикацию и задерживать очищение от возбудителя. Полипептид соматостатин обладает свойством стимулировать абсорбцию и ингибировать секрецию электролитов в кишечнике, вызываемую ЦАМФ. Но время полужизни его составляет всего 90 с, что затрудняет его практическое применение в качестве антидиарейного средства. Синтезирован более стабильный аналог соматостатина — сандостатин, который оказался эффективным при диареях инфекционной природы. Широкое распространение в лечении диарей имеет комбинированный препарат висмута субсалицилат. Фармакологически активными в данном препарате являются оба компонента. Сам висмут обладает вяжущим свойством и антимикробной активностью в отношении возбудителей кишечных инфекций, в том числе сальмонелл. Салициловая часть подавляет синтез простагландинов. Препарат назначают каждые 30 мин в виде таблеток или суспензии (взрослым 30 мл или 2 таблетки, детям до 6 лет 5 мл или 1/3 таблетки, а детям старше 6 лет в дозах, равных половине взрослой до 8 приемов). В случае тяжелой диареи дозы могут удваиваться. Антидиарейные препараты патогенетической направленности, способные снижать потери жидкости на 30% и более, делают эффективными другие способы лечения, в частности пероральную регидратацию. При подозрении на развитие генерализованных форм сальмонеллеза (лихорадка более 2 сут) антибактериальная терапия обязательна. Большинство штаммов, выделяемых в настоящее время (особенно S. typhi-murium), резистентны к ампициллину, котримоксазолу, хлорамфениколу. Поэтому рекомендуется терапия одним из следующих препаратов: цефтриаксон по 2,0 г/сут, ципрофлоксацин или офлоксацин по 0,8 г/сут внутривенно в течение 10—14 дней. При септических формах комбинируют лечение антибиотиками с хирургической санацией гнойных очагов. При хроническом бактерионосительстве сальмонелл назначают ципрофлоксацин в дозе 1,5 г/сут в течение 28 дней. Во всех случаях заболевания показаны препараты, повышающие реактивность организма и нормализующие кишечную микрофлору (витамины, пентоксил, эубиотические бактериальные препараты); проводится лечение сопутствующих заболеваний. Профилактика и мероприятия в очаге. Ветеринарно-санитарный надзор за убоем скота и птицы, технологией обработки туш, приготовлением и хранением мясных и рыбных блюд. Организация вакцинации сельскохозяйственных животных и птиц сальмонеллезными вакцинами. После госпитализации больного наблюдают за очагом в течение недели. Работники пищевых и приравненных к ним предприятий, дети, посещающие детские учреждения, подвергаются однократному бактериологическому обследованию. Выписка реконвалесцентов проводится после полного клинического выздоровления и однократного бактериологического исследования кала (для работников пищевых предприятий — двукратного) с отрицательным результатом. Работники пищевых предприятий и дети, посещающие ясли, наблюдаются в течение 3 мес с бактериологическим исследованием кала (1 раз в месяц). Бактериовыделители не допускаются на работу в пищевые и приравненные к ним предприятия.
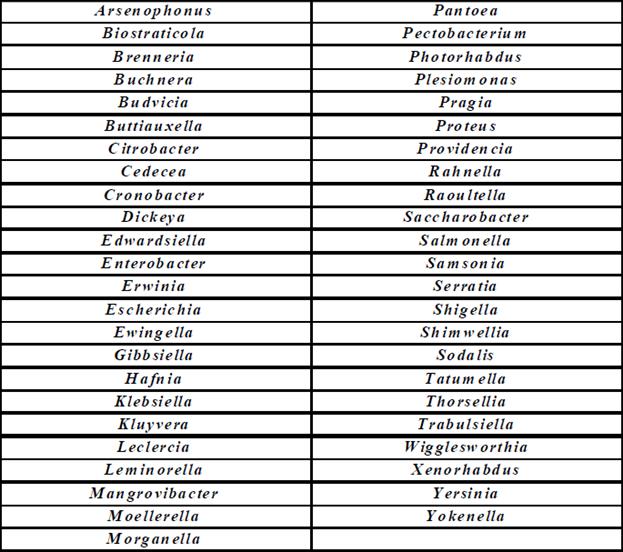
2. Характеристика семейства энтеробактерий Семейство Enterobakteriaceae включает в себя многочисленных представителей, имеющих общее местообитание – кишечник. Энтеробактерии делят на: 1) патогенные (шигеллы, сальмонеллы, эшерихии, иерсинии и др.); 2) условно-патогенные (37 родов) (табл.1.) Все патогенные энтеробактерии могут вызывать у человека острые кишечные инфекции, условно-патогенные – гнойно-воспалительные заболевания и пищевые токсикоинфекции. Таблица 1. Представители семейства Enterobakteriaceae
2.1. Биологические свойства Enterobakteriaceae Энтеробактерии – грамотрицательные палочки средней величины (длина 1-5 мкм, толщина 0,4-0,8 мкм) с закругленными концами, располагающиеся беспорядочно. Одни из них подвижны за счет жгутиков, другие неподвижны. Могут иметь капсулу. У многих штаммов, принадлежащих к разным родам: эшерихий, сальмонелл, шигелл, клебсиелл, протеев, выявлены ворсинки (пили) общего типа, а у некоторых штаммов – половые ворсинки (секс-пили), с которыми связаны их адгезивные и другие свойства. Являются факультативными анаэробами Они нетребовательны к питательным средам. На мясопептонном агаре образуют однотипные колонии. Средней величины, круглые, гладкие, выпуклые, блестящие, бесцветные. В мясопептонном бульоне растут, давая равномерное помутнение. Биохимические тесты общие для всего семейства. На основании этих тестов семейство энтеробактерий дифференцируют от других, сходных по морфологии. Все энтеробактерии: 1) ферментируют глюкозу до кислоты или до кислоты и газа; 2) редуцируют нитраты в нитриты; 3) каталаза +, оксидаза —, OF-тест ++. Антигены энтеробактерий состоят из: 1) О-антигена, который локализуется в клеточной стенке. По химической природе это глюцидолипоидный комплекс; 2) К-антигена (это поверхностный, капсульный антиген); 3) Н-антигена (термолабильного, жгутикового); его имеют подвижные энтеробактерии; 4) пилифимбриального антигена; он есть у бактерий, имеющих ворсинки, пили, фимбрии. 2.2. Классификация энтеробактерий Классификация энтеробактерий основана на их биохимических свойствах. Согласно классификации Берджи семейство энтеробактерий делится на 40 родов, роды – на виды. В ряде случаев возможна внутривидовая дифференциация на: 1) ферментовары; 2) серогруппы и серовары; 3) фаговары; 4) колециновары. Эта дифференциация необходима для эпидемиологического анализа, т. е. для установления источника и путей распространения инфекции. Кишечная инфекция – результат взаимодействия возбудителя с соответствующими структурами макроорганизма при необходимых условиях внешней среды. Этот процесс состоит из нескольких фаз: 1) адгезии; 2) инвазии; 3) колонизации; 4) продукции экзо– и энтеротоксинов. Адгезия – обязательное условие возникновения любого инфекционного процесса. Разные энтеробактерии обладают тропизмом только к определенным эпителиальным клеткам, поэтому прикрепляются только на определенном уровне ЖКТ. Адгезия идет в два этапа: 1) неспецифическая адгезия (приближение); 2) специфическая адгезия (в результате лиганд-специфического взаимодействия соответствующих структур энтеробактерий (ворсинок, фимбрий) и рецепторов плазмолеммы эпителиальных клеток). Инвазия – проникновение бактерий в эпителиальные клетки с размножением или без него. Инвазия, колонизация и продукция токсинов в разной степени выражены у разных энтеробактерий, поэтому патогенез и клиника кишечных инфекций существенно различаются. 2.2.1. Род Escherihia Род Escherihia включает в себя семь видов. Наибольшее значение имеет вид E. coli, которые по патогенности делят на: 1) патогенные (диарейные); 2) условно-патогенные (входят в состав нормальной микрофлоры кишечника). Они подвижны, капсул не образуют (рис. 2.). Биохимические свойства: 1) ферментируют глюкозу с образованием кислоты и газа; 2) ферментируют лактат.
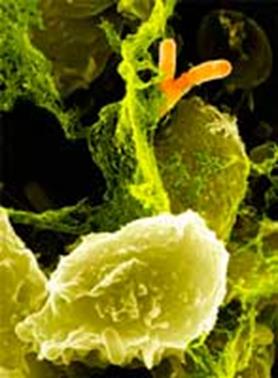
Антигенное строение: 1) по О-антигену делятся на серогруппы (более 160); 2) большинство имеют К-АГ и Н-АГ. Заболевания, вызываемые эшерихиями, делят на две группы: 1) эндогенные колиинфекции; вызываются собственной кишечной палочкой, которая при снижении иммунологической реактивности вызывает гнойно-воспалительные заболевания; 2) экзогенные колиинфекции – эшерихиозы. Это типичные кишечные инфекции, вызываются только патогенными E. coli, попавшими в организм извне. Основной источник – человек. Патогенные E. coli делят на четыре основных класса. 1. ЕТЕС – энтеротоксигенные эшерихии коли. Обладают тропизмом к эпителию тонкого кишечника. Попав в организм, они прикрепляются к рецепторам мембран энтероцитов. У них есть СФ-фактор колонизации, за счет которого они заселяют эпителиальные клетки тонкого кишечника. Внутрь клеток они не проникают, и воспаление не развивается. Они продуцируют экзоэнтеротоксин, синтез которого кодируется плазмидой. Этот токсин состоит из: 1) ЛТ-термолабильной фракции; 2) СТ-термостабильной фракции. Токсин обладает цитотоническим действием. В результате его воздействия нарушается процесс энтеросорбции, что ведет к развитию диарейного синдрома. Клинически заболевание протекает как легкая форма холеры. 2. EIEC – энтероинвазивные эшерихии коли. Обладают тропизмом к эпителиальным клеткам толстого кишечника. Факторами их вирулентности являются наличие на поверхности клеточной стенки белков наружной мембраны, способность к инвазии и внутриклеточному размножению. Размножение бактерий приводит к гибели клетки. На месте погибших клеток образуются язвы и эрозия, окруженные воспалением. 3. EPEC – энтеропатогенные эшерихии коли. Вызывают энтероколиты у детей до года. Поражается эпителий тонкого кишечника. Фактор вирулентности – способность к ограниченной инвазии. 4. EHEC – энтерогеморрагические эшерихии коли. Обладают тропизмом к эпителиальным клеткам толстого кишечника. Фактор вирулентности – продукция двух типов шигоподобных токсинов (SLT). Вызывают гемоколит. Основной метод диагностики – бактериологическое исследование. Необходимо определить: 1) принадлежность выделенной культуры E. coli к патогенной серогруппе (реакции агглютинации и преципитации); 2) наличие токсина (с помощью иммуноферментного анализа (ИФА)), если выделенная структура принадлежит к серогруппе ETEC; 3) наличие белков наружной мембраны (ИФА), если выделенная структура принадлежит к серогруппе EIEC; 4) особое белковое вещество, общее для всей группы (ИФА), – у группы EPEC; 5) наличие SLT (ИФА) – у ЕНЕС. Специфической профилактики нет. Лечение: антибиотики. 2.2.2. Род Shigella Относятся к роду Shigella. Являются возбудителями дизентерии. Морфология такая же, как и у других представителей семейства энтеробактерий. Неподвижны, капсул не образуют (рис.3.). Хорошо растут на простых питательных средах. На среде Эндо образуют бесцветные колонии.
Рис. 3. Микрофотография бактерии рода Shigella Род включает в себя четыре вида, различающихся по биохимическим свойствам (способности ферментировать маннит и лактозу) и антигенному строению: 1) Sh. disenteriae; не ферментируют лактозу и маннит; по антигенным свойствам внутри вида делятся на 12 сероваров; один из них – шигелла Григорьева—Шига – самый патогенный; 2) Sh. flexneri; ферментирует только маннит; по антигенным свойствам делится на 6 сероваров, которые делятся на подсеровары; 3) Sh. boydii; ферментирует только маннит; по антигенному строению делится на 18 сероваров; 4) Sh. sonnei; ферментирует только лактозу; в антигенном отношении вид однороден, внутри вида выделяют ферментовары, фаговары, колециновары. Шигеллы, минуя желудок и тонкий кишечник, попадают в толстый кишечник. Прикрепляются к рецепторам мембран колоноцитов и проникают внутрь с помощью белка наружной мембраны. Гибель клеток приводит к образованию эрозий и язв, окруженных перифокальным воспалением. Факторы патогенности: 1) белки наружной мембраны (обеспечивают способность к инвазии и внутриклеточному размножению); 2) контактный гемолизин (способствует лизису мембран вакуолей клетки); 3) экзотоксин (обладает энтеротропным, цито– и нейротоксическим действием); 4) эндотоксин (оказывает на организм общетоксическое действие и предохраняет попавшие в организм шигеллы от действия защитных сил макроорганизма). Различают три клинические формы дизентерии, которые отличаются по возбудителям, эпидемиологии и частично по клинике: 1) дизентерия Григорьева—Шига. Возбудитель – Sh. disenteriae, серовар – шигелла Григорьева—Шига. Пути передачи – алиментарный, контактно-бытовой. Особенности клиники: протекает тяжело, характерен кровавый понос с кровью, симптомы поражения ЦНС, может быть бактериемия; 2) дизентерия Флекснера. Возбудители – Sh. flexneri и Sh. boydii. Путь передачи водный. Особенности клиники: протекает как типичная дизентерия различной степени тяжести; 3) дизентерия Sonnei. Путь передачи пищевой. Особенности клиники: могут быть симптомы пищевой токсикоинфекции, рвота. Диагностика: 1) бактериологическое исследование; 2) иммуноиндикация (ИФА); 3) серодиагностика (имеет ретроспективное значение). Специфическая профилактика: дизентерийный бактериофаг (применяется в очагах инфекции). Этиотропная терапия: в среднетяжелой и тяжелой степени заболевания назначаются антибиотики (те, которые выводятся кишечником) с учетом чувствительности возбудителя. 2.2.3. Род Salmonella Род Salmonella включает в себя более 2500 сероваров. Морфология сходна с другими представителями семейства. Бактерии подвижны, спор и капсул не образуют. Хорошо растут на простых питательных средах. Образуют небольшие прозрачные колонии. Биохимические свойства: 1) ферментируют углеводы до кислоты и газа; 2) лактозу не разлагают; 3) дезаминируют и декарбоксилируют некоторые аминокислоты. По биохимическим различиям род делится на шесть групп. Антигенная структура: 1) О-антиген. По его строению сальмонеллы делятся на 65 серогрупп; 2) Н-антиген. По его строению внутри серогруппы сальмонеллы делятся на серовары. У человека сальмонеллы могут вызывать две группы заболеваний: 1) антропонозные – брюшной тиф и паратиф А и В; возбудители: S. typhi, S. paratyphi A, S. paratyphi B; 2) зооантропонозные – сальмонеллезы; возбудители: S. typhimurium, S. haifa, S. anatum, S. panama, S. infantis. Брюшной тиф и паратиф А и В объединены в одну группу – тифопаратифозные заболевания – из-за общего возбудителя, клиники, патогенеза. Источник инфекции – больной (или бактерионоситель). Заболевание включает в себя пять фаз. 1. Фаза внедрения возбудителя в организм, прикрепления его к рецепторам мембран энтероцитов и проникновения внутрь клеток (соответствует инкубационному периоду болезни). 2. Фаза первичной локализации: сальмонеллы проникают в лимфатический аппарат тонкого кишечника, сенсибилизируют его, размножаются в макрофагах; это сопровождается гибелью микроорганизмов и выделением эндотоксина, который попадает в кровь и вызывает эндотоксинемию (соответствует продромальному периоду). 3. Фаза бактериемии: возбудитель прорывает лимфатический барьер и попадает в кровь, распространяясь по всем паренхиматозным органам (начало болезни). 4. Фаза вторичной локализации: в паренхиматозных органах возникают брюшнотифозные гранулемы (разгар болезни). 5. Фаза выделительно-аллергическая: повторный контакт возбудителя с первичносенсибилизированным лимфатическим аппаратом тонкого кишечника; образуются язвы на слизистой оболочке. Исход болезни может быть различным: 1) выздоровление; 2) формирование носительства; 3) летальный. Диагностика тифопаратифозных заболеваний: 1) в фазу бактериемии – кровь на гемокультуру (РПГА), если есть сыпь – соскоб с розеол; 2) в фазу реконвалесценции – бактериологическое исследование фекалий, мочи, желчи; 3) для выявления носительства – серологическое исследование. Этиотропная терапия: антибиотики с учетом чувствительности возбудителя. Специфическая профилактика: убитая брюшнотифозная вакцина. Вторая группа заболеваний – сальмонеллезы – характеризуется многообразием клинических проявлений. Источники инфекции – больные животные, инфицированные продукты питания. Путь заражения алиментарный. Чаще всего сальмонеллез протекает как пищевая токсикоинфекция. При этом сальмонеллы поражают энтероциты тонкого кишечника и фиксируются в его лимфатическом аппарате. При прорыве лимфатического барьера развивается бактериемия, происходит разнос возбудителя по различным органам, регистрируются внекишечные формы сальмонеллеза. 4. Род Yersinia Род Yersinia содержит семь видов, из которых патогенными для человека являются Y. pestis (возбудитель чумы), Y. pseudotuberculesis (возбудитель псевдотуберкулеза), Y. enterocolitica – возбудитель острых кишечных инфекций, кишечного иерсиниоза. Y. enterocolitica – это грамотрицательные подвижные палочки, не образующие спор и капсул. Культивируются на простых питательных средах при температуре 20–26 °C. Биохимические свойства: 1) ферментируют сорбозу, инозит с образованием кислоты; 2) образуют уреазу. По специфичности О-антигены делятся на 30 сероваров. Чаще всего заболевание вызывают серовары О3 и О9. Иерсинии устойчивы и способны к размножению во внешней среде, выдерживают низкие температуры. Способны размножаться в молоке, овощах, фруктах, мороженом при низкой температуре. В открытых водоемах они выживают и размножаются. Иерсиниозы – зооантропонозные заболевания. Резервуар – различные грызуны, которые выделяют бактерии с фекалиями и мочой. Путь заражения алиментарный. Заболевания регистрируются в виде вспышек или спорадических случаев. Y. enterocolitica – факультативные внутриклеточные паразиты. Патогенность иерсиний связана с инвазивными свойствами и действием цитокинов, вирулентные штаммы обладают устойчивостью к фагоцитозу и бактерицидному действию сыворотки. Эти свойства кодируют гены плазмид. Маркерами вирулентности являются кальцийзависимость и аутоагглютинация. Заражение может реализоваться по-разному: от бессимптомного носительства и легких форм до тяжелых и генерализованных, септических (чаще у пожилых, страдающих хроническими заболеваниями). В патогенезе различают четыре фазы. 1. Внедрение. Иерсинии обладают тропизмом к эпителиальным клеткам тонкого кишечника, проникают в лимфатический аппарат. 2. Энтеральная. Размножение сопровождается гибелью микроорганизмов, выделением эндотоксина. Клинически выражается явлениями энтероколита и лимфаденита. На этой стадии процесс может заканчиваться, тогда развивается типичная кишечная инфекция. Если происходит прорыв лимфатического барьера, то следует третья фаза. 3. Бактериемия: развиваются сепсис и скарлатиноподобная лихорадка. 4. Вторичноочаговые и аллергические проявления. Регистрируются гепатиты, артриты, крапивница. Могут быть поражения любых органов. Диагностика: 1) бактериологическое исследование; материал – испражнения, кровь, моча; посев на среду Серова; посевы подвергаются холодовому обогащению неделю; 2) серологическое исследование (РПГА); 3) иммуноиндикация. Специфическая профилактика не проводится. Этиотропная терапия: 1) антибиотики; 2) сульфаниламиды.
Список литературы
1. Тимаков В.Д., Левашев В.С., Борисов Л.Б. Микробиология/В.Д. Тимаков, В.С. Левашев, Л.Б. Борисов.-М.:Медицина,1983.-512с. 2. Поздеев О.К. Медицинская микробиология: учебное пособие/Под ред. В.И. Покровского-4е изд.-М.:ГЭО ТАР-Медиа,2008.-768с. 3. Электронная библиотека text.tp 200/biz 4. health.centrmia.gov.ua/003.htm Сальмонеллёз 5. www.ilal.ru/mikrobys/salmonellei.htm/ Дата добавления: 2016-03-26 | Просмотры: 510 | Нарушение авторских прав |