|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
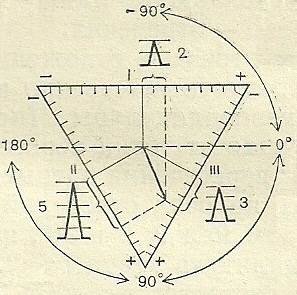
Электрическая ось сердца.Электрическая ось сердца – это вектор, отражающий среднюю величину и направление электродвижущей силы (э.д.с.), действующей во время электрической систолы сердца. Указывает, в каком направлении действует максимальная э.д.с. в течение наибольшего времени. Стандартные отведения Эйнтховена накладываются на конечности таким образом, что образуется примерно равносторонний треугольник, в центре которого расположено сердце. Алгебраическая сумма всех э.д.с. в замкнутой цепи равна 0 (закон Кирхгофа). Сумма э.д.с. I-го и III-го отведений, направленных к левой ноге (ЛН), равна э.д.с. II-го отведения, также направленной к ЛН. О величине э.д.с. можно судить по, пропорциональной ей, высоте зубцов (зубец R) в соответствующем отведении.
В норме направление электрической оси сердца колеблется от 0 до 90°. Если направление оси находится в интервале от 0 до -90°, говорят об отклонении оси влево, что, как правило, свидетельствует о смещении влево анатомической оси сердца (часто бывает у тучных людей). Отклонение вправо – это направление оси в промежутке от +90° до +180°, более подозрительно в смысле патологии сердца. Векторкардиография (ВКГ) -регистрация изменения на плоскости положения электрической оси сердца во время сердечного цикла. На экране осциллографа наблюдаются петли - p, QRS, T, отражающие пробег волны возбуждения. Сопоставление ВКГ, записанных в трех и более взаимно непараллельных плоскостях, позволяет представить динамику суммарных векторов предсердий и желудочков сердца по времени в трехмерном пространстве. Анализируют ВКГ по максимальной длине и ширине петель, их форме, углам отклонения максимальных векторов от координатных осей плоскости регистрации. Они существенно и определенным образом изменяются при гипертрофии предсердий и желудочков, блокадах сердца, нарушениях ритма и инфаркте миокарда. Применяется ВКГ для уточнения диагностики и в научных исследованиях. Магнитокардиография (МКГ) – бесконтактный метод регистрации магнитной составляющей электромагнитного поля сердца. Датчик (чаще всего тороидальная катушка с большим числом витков) размещается как можно ближе к грудной клетке. Максимальная амплитуда основных зубцов регистрируется при записи с подложечной области. Для успешной регистрации МКГ необходимы: изоляция от магнитного поля земли, отсутствие металлических предметов на теле пациента. МКГ напоминает ЭКГ; при ее описании применяют обозначения, принятые для ЭКГ. МКГ позволяет более четко регистрировать магнитные сигналы от близко расположенных участков сердца и патологическая динамика биоэлектрических процессов в этих зонах отражается на МКГ полнее, чем на ЭКГ. Из-за сложности технических условий регистрации, МКГ применяется в основном в научных исследованиях.
7.5. Методы исследования сердечнососудистой системы. Сфигмография – регистрация колебания артериальной стенки, вызванного прохождением пульсовой волны. На место, удобное для исследования пульсации сосуда, накладывается датчик (пьезоэлектрический, тензоэлектрический, емкостной, и т.д.), сигнал от которого идёт на регистрирующее устройство. В пульсовой кривой (сфигмограмме) различают 2 основные части – подъём (анакроту) и спад (катакроту). Анакрота возникает из-за повышения АД и растяжения стенки артерий при изгнании крови из желудочков. В конце систолы, когда давление начинает падать, начинается катакрота. В тот момент, когда давление в расслабляющемся левом желудочке станет ниже, чем в аорте, кровь устремляется назад к желудочку, давление в артериях резко падает и на катакроте появляется выемка – инцизура. Движение крови обратно к сердцу встречает препятствие – захлопываются полулунные клапаны. Волна отражается от клапанов и создаёт вторичную волну повышения давления, а на катакроте регистрируется дикротический подъём. Регистрация сфигмограммы вместе с ЭКГ и ФКГ (поликардиография) позволяет рассчитывать скорость распространения пульсовой волны и используется для фазового анализа сердечного цикла. Плетизмография – регистрация изменений объёма органа или части тела, связанного с изменением его кровенаполнения. Применяется для оценки сосудистого тонуса. Простейший метод механической плетизмографии состоит в том, что конечность, например рука, помещается в сосуд, частично заполненный водой. Изменение объёма, возникающее при кровенаполнении, передаются на сосуд – в нём изменяется уровень, показывающий объём воды. Фотоэлектрическая плетизмография основана на оценке светопроницаемости части тела в зависимости от степени кровенаполнения. Реография основана на регистрации колебаний сопротивления ткани организма переменному току высокой частоты (40 – 500 кГц) и малой силы (не более 10 мА). При высокой частоте величина ёмкостного сопротивления приближается к нулю и общее сопротивление (импеданс) в основном зависит от омического сопротивления и, соответственно, от кровенаполнения. По форме реограмма, когда ток проходит через крупные артериальные сосуды, напоминает сфигмограмму. При анализе реограмм рассчитываются амплитудные характеристики систолической волны (отражают величину кровенаполнения), амплитуду диастолической волны (дикротической волны), уровень инцизуры (характеризует величину периферического сопротивления), временные интервалы, характеризующие тонус и эластичность сосудов. Реографическое определение МОК. Т.к. периодические резкие уменьшения сопротивления возникают в момент выброса сердцем в аорту и лёгочную артерии систолического объёма крови, величина уменьшения сопротивления пропорциональна величине систолического выброса. Поэтому, используя специальные формулы, учитывающие размеры тела, особенности конституции, можно по реографическим кривым определить величину систолического объёма крови, а умножив его на число сердечных сокращений – получить величину МОК. Определение МОК методом Фика. Впервые был применён для определения МОК у животных в 1870 г. Основан на определении разницы содержания О2 в артериальной и венозной крови и объёма О2, поглощаемого лёгкими за 1 минуту. Например, за 1 минуту через лёгкие поглощается 400 мл О2, а количество О2 в артериальной крови на 8 объёмных % больше, чем в венозной. Т.е. каждые 100 мл крови поглощают 8 мл О2. Чтобы за 1 минуту поглотилось 400 мл О2, необходимо, чтобы через лёгкие прошло: 100 × 400 / 8 = 5000 мл крови. Объёмы крови, проходящие за 1 минуту по малому и большому кругу кровообращения, равны. В клинической практике метод начал применяться в начале 40-х гг. ХХ века. Для определения содержания О2 в крови необходимо с помощью катетера (через плечевую вену) брать смешанную венозную кровь из правого предсердия, а для получения артериальной крови проводить пунктирование артерии. Определение МОК методом разведения индикаторов. Определяют разведение и скорость циркуляции какого-либо вещества (краска, радиоактивное вещество), введённого в вену. Введённое вещество проходит через правые отделы сердца, малый круг кровообращения, левые отделы сердца и поступает в артерии большого круга кровообращения, где и определяют его концентрацию. Сначала она волнообразно растёт, затем падает. Через некоторое время, когда порция крови, содержавшая максимальное количество вещества, вторично пройдёт через левые отделы сердца, его концентрация в артериальной крови вновь немного увеличится (волна рециркуляции). Замечают время от момента введения вещества до начала рециркуляции и вычерчивают кривую разведения, т.е. изменения концентрации (нарастания и убыли) исследуемого вещества в крови. МОК вычисляют по формуле: МОК = 60×J/C×T, где J - количество введённого вещества, мг; С – средняя концентрация разведённого вещества, вычисленная по кривой разведения, мг/л; Т – длительность первой волны циркуляции, с.
7.6. Механизмы регуляции деятельности сердца. Подразделяются на: внутриклеточные, внутрисердечные, внесердечные. Внутриклеточные механизмы регуляции. 1. Миокард состоит из отдельных клеток, соединённых вставочными дисками. В каждой клетке – механизм регуляции синтеза белков, поддерживающий уровень воспроизводства в соответствии с интенсивностью раздражения. При увеличении нагрузки на сердце (регулярная мышечная деятельность) усиливается синтез сократительных белков миокарда и структур, обеспечивающих их деятельность (рабочая гипертрофия миокарда). 2. Гетерометрическая регуляция. Сила сокращения сердца пропорциональна степени его кровенаполнения в диастолу (степени растяжения), т.е. исходной длине его мышечных волокон («закон сердца» Франка-Старлинга). При растяжении миокарда во время диастолы в каждой миофибрилле актиновые нити в большей степени выдвигаются из промежутков между миозиновыми нитями, при этом увеличивается количество резервных мостиков – тех актиновых точек, которые соединяют актиновые и миозиновые нити в момент сокращения. Чем больше растянута каждая клетка миокарда во время диастолы, тем больше она сможет укоротиться. В результате сердце перекачивает в артерии то количество крови, которое притекает из вен. 3. Гомеометрическая регуляция – изменение силы сокращений сердца при неменяющейся исходной длине волокон миокарда. Это ритмозависимые изменения силы сокращения. Если стимулировать полоску миокарда при равном растяжении с увеличивающейся частотой, то наблюдается увеличение силы каждого последующего сокращения («лестница Боудича»). Это связано с повышением внутри миокардиоцита свободного кальция. В момент генерации ПД Са2+ через медленные Na+-Ca2+-каналы входит внутрь миокардиоцита. Са2+ - взаимодействует с тропонином и инициирует этим изменение положения тропомиозина на актиновой нити, с которой миозиновые мостики способны вступить в контакт, т.е. инициирует сокращение. Чем больше ионов Са2+, тем больше число взаимодействующих мостиков, тем выше сила сокращения. Резкое увеличение сопротивления выбросу крови из левого желудочка в аорту приводит к увеличению в определённых границах силы сокращений миокарда (проба Анрепа). Механизм имеет 2 фазы: 1) – при увеличении сопротивления растёт конечный диастолический объём и увеличение силы реализуется по гетерометрическому механизму; 2) – когда конечный диастолический объём стабилизируется, увеличенная сила сокращений поддерживается гомеометрическим механизмом. Внутрисердечные механизмы регуляции. Обеспечиваются внутрисердечными периферическими рефлексами. Дуга этих рефлексов замыкается не в ЦНС, а в интрамуральных ганглиях миокарда. В этих ганглиях выделено (А.С. Догель, 1899 г.) 3 типа нервных клеток: 1) с короткими дендритами и аксоном, образующим окончание на волокнах миокарда – типичные эфферентные нейроны; 2) с длинными дендритами и длинным аксоном, выходящим за пределы ганглия и заканчивающимся на нейронах в других ганглиях – афферентные нейроны. Дендриты афферентного нейрона образуют рецепторы растяжения на волокнах миокарда и венечных (коронарных) сосудах; 3) с короткими отростками, не выходящими за пределы ганглия – вставочные нейроны. Гетеро- и гомеометрические внутриклеточные механизмы способны лишь увеличивать энергию сердечного выброса. Внутрисердечные рефлексы обеспечивают более сложный уровень регуляции, соответствующий текущим условиям в системе кровообращения. На фоне низкого кровенаполнения сердца и незначительной величины давления крови в устье аорты и коронарных сосудах, увеличение растяжения миокарда правого предсердия приводит к рефлекторному усилению сокращения миокарда левого желудочка. Переполнение камер сердца кровью вызывает снижение силы сокращения миокарда посредством внутрисердечных рефлексов. Сердце выбрасывает меньшее количество крови. Задержка дополнительного количества крови в полостях сердца снижает диастолическое давление и вызывает снижение притока венозной крови к сердцу. Излишний объём задерживается в венозной системе. При недостаточности наполнения кровью камер сердца внутрисердечные рефлексы вызывают усиление сокращений миокарда. Желудочки выбрасывают большее количество крови, что способствует усилению притока венозной крови к сердцу. В нормальных естественных условиях внутрисердечная система нервной регуляции не является автономной. Это – низшее звено иерархии нервных механизмов, регулирующих деятельность сердца. Внесердечные регуляторные механизмы – это нервная экстракардиальная регуляция. Осуществляется импульсами, поступающими из ЦНС по волокнам блуждающего и симпатических нервов. Парасимпатические волокна: тела 1-х нейронов, отростки которых составляют блуждающие нервы, располагаются в продолговатом мозге. Заканчиваются в интрамуральных ганглиях сердца. Здесь находятся 2-е нейроны, отростки которых идут к проводящей системе, миокарду и коронарным сосудам. Симпатические волокна: 1-е нейроны в боковых рогах 5-ти верхних сегментов грудного отдела спинного мозга. Отростки заканчиваются в шейных и верхних грудных симпатических узлах. В этих узлах – 2-е нейроны, отростки которых идут к сердцу. Большая часть отходит к сердцу от звёздчатого узла. Раздражение блуждающих нервов, идущих к сердцу, тормозит работу сердца вплоть до полной его остановки в диастолу (братья Вебер, 1845 г.). Первый случай обнаружения в организме тормозящего влияния нервов. При электрическом раздражении перерезанного блуждающего нерва происходит: урежение ЧСС – отрицательный хронотропный эффект; уменьшение амплитуды сокращений – отрицательный инотропный эффект. При сильном раздражении работа сердца на некоторое время прекращается. В этот период возбудимость сердца понижена – отрицательный батмотропный эффект; проведение возбуждения замедлено – отрицательный дромотропный эффект. Нередко наблюдается полная блокада проведения возбуждения в предсердно-желудочковом узле. При продолжительном раздражении блуждающего нерва сокращения сердца восстанавливаются – «ускользание сердца из-под влияния блуждающего нерва». Микроэлектродные отведения от одиночных мышечных волокон предсердий выявили гиперполяризацию МП при сильном раздражении блуждающего нерва. Влияние симпатических нервов на сердце исследовалось братьями Цион (1867 г.), затем И.П.Павловым (1887 г.). Были выявлены: положительный хронотропный эффект – учащение ритма сердечных сокращений (Ционы – нервы «ускорители сердца»); положительный дромотропный эффект – улучшение проведения возбуждения в сердце; положительный батмотропный эффект – повышение возбудимости сердца; положительный инотропный эффект – усиление сердечных сокращений без заметного учащения ритма («усиливающий нерв» по И.П.Павлову). Медиатор ацетилхолин, образующийся в окончаниях блуждающего нерва, быстро разрушается ацетилхолинэстеразой и, поэтому, оказывает только местное действие. Норадреналин, выделяющийся в окончаниях симпатических нервов, разрушается значительно медленнее и действует дольше. После прекращения раздражения симпатического нерва в течение некоторого времени сохраняются учащение и усиление сердечных сокращений. Наряду с основным медиатором в синаптическую щель могут выделяться вещества, обладающие модулирующим действием. Нервная экстракардиальная регуляция оказывает корригирующее влияние на ритм и работу сердца. Сам ритм зарождается в пейсмекере 1-го порядка, а нервные влияния ускоряют или замедляют скорость спонтанной деполяризации клеток водителей ритма, изменяя режимы работы сердца. По мнению И.П.Павлова имеет место и трофическая стимуляция процессов обмена веществ. Однако, известны и пусковые влияния ЦНС, когда сигналы, приходящие по нервам, инициируют сокращения сердца. Это наблюдается в опытах с раздражением блуждающего нерва в режиме, близком к естественному, т.е. «залпами» («пачками») импульсов, а не непрерывным потоком, как делается традиционно. При раздражении блуждающего нерва «залпами» импульсов сердце сокращается в режиме этих «залпов». Каждому «залпу» соответствует одно сокращение сердца. Меняя частоту и характеристику «залпов», можно управлять ритмом сердца в широких пределах. Воспроизведение сердцем центрального ритма резко изменяет электрофизиологические параметры деятельности синоатриального узла. При работе узла в режиме автоматии, а также при изменениях частоты под влиянием обычного раздражения блуждающего нерва, возбуждение возникает в одной точке узла. В случае же воспроизведения центрального ритма в инициации возбуждения принимает участие одновременно множество клеток узла. Сигналы, обеспечивающие синхронное воспроизведение сердцем центрального ритма, отличаются по своей медиаторной природе от общепризнанных влияний блуждающего нерва. Наряду с ацетилхолином выделяются регуляторные пептиды различного состава. Т.е. реализация каждого типа эффектов блуждающего нерва обеспечивается своим «медиаторным коктейлем». Изменение частоты посылок «пачек» импульсов из сердечного центра продолговатого мозга у людей можно продемонстрировать в следующем исследовании. Человеку предлагают дышать чаще, чем сокращается его сердце. Для этого он следит за миганием лампочки фотостимулятора и на каждую вспышку света производит одно дыхание. Фотостимулятор устанавливают с частотой, превышаюшей исходную частоту сердцебиений. В результате этого в продолговатом мозге происходит иррадиация возбуждения с нейронов дыхательного центра на нейроны сердечного центра, а в сердечных эфферентных нейронах блуждающего нерва формируются «пачки» импульсов в новом ритме, общем для дыхательного и сердечного центров. В опытах на собаках учащённое дыхание вызывается перегреванием. Как только ритм учащающегося дыхания становится равным ЧСС, оба ритма синхронизируются и далее учащаются или урежаются в определённом диапазоне синхронно. При перерезке или блокаде блуждающих нервов эффект синхронизации ритмов исчезает. Т.о., наряду с внутрисердечным, существует и центральный генератор ритма сердца. В естественных условиях он формирует адаптивные (приспособительные) реакции сердца, навязывая сердцу ритм сигналов, приходящих по блуждающим нервам. Внутрисердечный генератор обеспечивает поддержание насосной функции сердца в случае выключения центрального генератора. Центры блуждающего и симпатических нервов – это 2-я (после внутрисердечных) ступень в иерархии нервных центров, регулирующих работу сердца. Они интегрируют влияние, нисходящее из высших отделов головного мозга. Более высокая ступень иерархии – центры гипоталамуса. При электрическом раздражении гипоталамуса наблюдаются реакции сердечнососудистой системы, которые по выраженности превосходят реакции, возникающие в естественных условиях. При локальном точечном раздражении некоторых зон гипоталамуса наблюдались: изменения ритма, силы сокращения левого желудочка, степени расслабления левого желудочка и т.д. Т.е. в гипоталамусе имеются структуры, способные регулировать отдельные функции сердца. Но в естественных условиях эти структуры не работают изолированно. Гипоталамус – исполнительный орган. Он обеспечивает интегративную перестройку функций сердечнососудистой системы (и других систем) по сигналам, поступающим из лимбической системы или новой коры. Рефлекторная регуляция деятельности сердца. Рефлекторные реакции, возникающие при раздражении различных рецепторов, могут, как тормозить, так и возбуждать сердечные сокращения. Особое значение имеют рецепторы, расположенные в некоторых участках сосудистой системы, реагирующие на изменение давления или на действие химических раздражителей («сосудистые рефлексогенные зоны»). В дуге аорты и в области разветвления сонной артерии находятся нервные окончания (барорецепторы) центростремительных нервов. Растяжение сосудистой стенки при повышении давления вызывает поток афферентных импульсов, повышается тонус ядер блуждающих нервов, замедляется ЧСС. Замедление работы сердца наблюдается и при повышении давления в других сосудах, например в лёгочной артерии. Есть рецепторы и в самом сердце (эндокарде, миокарде, эпикарде). Их раздражение рефлекторно изменяет и работу сердца, и тонус сосудов. В правом предсердии и в устьях полых вен имеются механорецепторы – реагируют на растяжение, возникающее при повышении давления в полости сердца или в полых венах. Афферентные импульсы идут по центростремительным волокнам блуждающего нерва к сердечно-сосудистому центру, который вызывает активацию симпатического отдела и рефлекторное учащение сердечных сокращений. Импульсы, идущие в ЦНС от механорецепторов предсердий, влияют и на работу других органов и наоборот. Лёгкое поколачивание по желудку или кишечнику лягушки вызывает замедление или остановку сокращений сердца (рефлекс Гольца, 1860-е гг.). У человека также наблюдается рефлекторная остановка сердца при ударе по передней брюшной стенке. Центростремительные пути идут от желудка и кишечника по чревному нерву в спинной мозг, достигают ядер блуждающих нервов в продолговатом мозге, а центробежные пути идут к сердцу. Рефлекс Ашнера – глазосердечный рефлекс – урежение сердцебиений на 10 – 20 ударов в минуту при надавливании на глазные яблоки. Рефлекторное изменение сердечной деятельности наблюдается при болевых раздражениях, мышечной работе, эмоциональных состояниях. Воспоминания о факторах, вызывающие определённые эмоции, вызывают и определённые изменения ритма и силы сокращений сердца. Это свидетельствует о корковой регуляции деятельности сердца. Другое свидетельство корковой регуляции – условнорефлекторная регуляция. Если какой-нибудь раздражитель (например, звуковой) сочетать многократно с надавливанием на глазные яблоки, вызывающим уменьшение ЧСС, то затем один этот раздражитель будет вызывать урежение сердечной деятельности – условный глазосердечный рефлекс. КБМ обеспечивает приспособительные реакции и к текущим, и к будущим событиям. Сигналы, предвещающие значительную вероятность возникновения какого-либо события, могут вызвать необходимую для предстоящей деятельности перестройку функций сердечнососудистой системы в целом и сердца в частности. При сложных ситуациях возможны нарушения и срывы этих корковых регуляторных механизмов (неврозы по И.П.Павлову), сопровождающиеся нарушениями деятельности сердца и сердечнососудистой системы. Эти нарушения могут закрепляться по типу патологических условных рефлексов. Гуморальная регуляция деятельности сердца. Катехоламины (адреналин, норадреналин) увеличивают силу и учащают ритм сердечных сокращений. Они стимулируют рецепторы миокарда, в результате чего активируется внутриклеточная аденилатциклаза, ускоряющая образование цАМФ, активирующего фосфорилазу. Последняя вызывает с одной стороны расщепление гликогена и образование глюкозы, с другой активацию ионов Са2+, необходимую для сопряжения возбуждения и сокращения в миокарде. Также повышается проницаемость клеточных мембран для Са2+, усиливается поступление Са2+ из межклеточного пространства в клетку и мобилизация Са2+ из внутриклеточных депо. Глюкагон, гормоны коры надпочечников, ангиотензин, серотонин увеличивают силу сокращений сердца. Тироксин – учащает ритм. Гипоксемия, гиперкапния, ацидоз угнетают сократительную активность. Эндокринная функция сердца. Миоциты предсердий образуют натрийуретический гормон. Его секреция стимулируется: растяжением предсердий, изменением уровня Na+, содержанием в крови вазопрессина, экстракардиальными нервами. Натрийуретический гормон повышает экскрецию почками Na+ и Cl+, подавляя их реабсорбцию в канальцах нефронов; увеличивает клубочковую фильтрацию и подавляет реабсорбцию воды в канальцах; подавляет секрецию ренина, ингибирует эффекты ангиотензина II и альдостерона; расслабляет ГМК кишечника и мелких сосудов, способствует снижению артериального давления.
7.7. Регуляция тонуса сосудов. Постоянство артериального давления сохраняется благодаря непрерывному поддержанию точного соответствия между величиной сердечного выброса и величиной общего периферического сопротивления сосудистой системы, которая зависит от тонуса сосудов. Базальный тонус проявляется при отсутствии внешних нервных и гуморальных влияний. В некоторых участках гладкой мускулатуры сосудистой стенки имеются очаги автоматии, генерирующие ритмические импульсы, распространение которых на остальные ГМК вызывает их возбуждение. Гладкие мышцы сосудистых стенок находятся под влиянием постоянной тонической импульсации, поступающей по волокнам симпатических нервов. Симпатические влияния формируются в сосудодвигательном центре и поддерживают определённую степень сокращения гладкой мускулатуры сосудов. Эффект вазоконстрикции, т.е. сужения артерий и артериол, был обнаружен Вальтером (1842) в опытах на лягушках, затем Бернаром (1852) в эксперименте на ухе кролика. Перерезка симпатического нерва на одной стороне шеи у кролика вызывает расширение сосудов (покраснение и потепление уха оперированной стороны). Раздражение симпатического нерва вызывает сужение артерий и артериол – ухо бледнеет, температура понижается. Главные сосудосуживающие нервы органов брюшной полости – симпатические волокна, проходящие в составе внутренностного нерва. После их перерезки кровоток через сосуды брюшной полости резко увеличивается, вследствие расширения артерий и артериол. При их раздражении, наоборот, сосуды желудка и тонкой кишки суживаются. Симпатические сосудосуживающие нервы к конечностям идут в составе спинномозговых смешанных нервов, а также по стенкам артерий. Эти артерии и артериолы находятся под непрерывным сосудосуживающим влиянием симпатических нервов. Перерезка вызывает расширение этих сосудов. Чтобы восстановить нормальный уровень артериального тонуса достаточно раздражать периферические отрезки этих нервов электрическими стимулами с частотой 1-2 Гц. Увеличение частоты стимуляции приводит к сужению сосудов. Сосудорасширяющие эффекты (вазодилатация) впервые обнаружены при раздражении веточек, относящихся к парасимпатическому отделу АНС. Так можно вызвать расширение сосудов подчелюстной железы и языка, расширение сосудов пещеристых тел полового члена. Т.е. такие эффекты можно наблюдать в сосудах, имеющих двойную (и симпатическую, и парасимпатическую) иннервацию. Но артерии и артериолы в скелетной мускулатуре имеют исключительно симпатическую иннервацию. Однако в составе симпатических нервов, кроме вазоконстрикторов, могут быть вазодилататоры. Активация α-адренорецепторов на постсинаптической мембране вызывает констрикцию, а активация β-адренорецепторов вызывает вазодилатацию. Расширение сосудов кожи можно вызвать раздражением периферических отрезков задних корешков спинного мозга, в составе которых проходят афферентные волокна. По теории Бейлиса и Орбели, одни и те же заднекорешковые волокна передают импульсы в обоих направлениях: одна веточка идёт к рецептору, другая – к кровеносному сосуду. Рецепторные нейроны, тела которых находятся в спинномозговых узлах, обладают двоякой функцией: передают афферентные импульсы в спинной мозг и эфферентные – к сосудам. Согласно другой точке зрения, при раздражении задних корешков в рецепторных окончаниях образуются ацетилхолин и гистамин, которые диффундируют по тканям и вызывают расширение близлежащих сосудов. Сосудодвигательный центр. Впервые был описан Ф.В.Овсянниковым (1871). Располагается в продолговатом мозге на дне IV желудочка, состоит из прессорного и депрессорного отделов. Раздражение прессорного отдела вызывает сужение артерий и подъём АД. Раздражение депрессорного отдела вызывает расширение артерий и падение АД. Считается, что депрессорный отдел понижает тонус прессорного отдела, снижая тем самым сосудосуживающий эффект. Влияния, идущие от сосудодвигательного центра продолговатого мозга, приходят к нервным центрам симпатического отдела АНС в боковых рогах грудных сегментов спинного мозга, регулирующих тонус сосудов отдельных участков тела. Спинномозговые центры способны через некоторое время после выключения сосудодвигательного центра продолговатого мозга самостоятельно повышать давление, снизившееся после расширения артерий и артериол. На сосудодвигательный центр продолговатого мозга влияют центры промежуточного мозга (гипоталамус, таламус) и коры больших полушарий. Рефлекторная регуляция сосудистого тонуса. Сосудистые рефлексы бывают собственные и сопряжённые (В.Н.Черниговский). Собственные рефлексы вызываются сигналами от рецепторов самих сосудов. Сопряжённые рефлексы - рецепторами, располагающимися в других системах и органах. Для собственных рефлексов особенное значение имеют рецепторы, сосредоточенные в дуге аорты и в области разветвления сонной артерии (сосудистые рефлексогенные зоны) – механорецепторы и хеморецепторы. Механорецепторы возбуждаются при повышении давления крови в сосудах (прессорецепторы или барорецепторы). Прессорецепторы, расположенные в дуге аорты, являются окончаниями центростремительных волокон, проходящих в составе аортального нерва (Цион и Людвиг обозначили его как депрессор). Его раздражение приводит к падению АД вследствие рефлекторного повышения тонуса ядер блуждающего нерва и депрессорного отдела сосудодвигательного центра. Если блуждающие нервы перерезаны, наблюдается рефлекторное расширение сосудов без замедления сердечного ритма. Растяжение стенки сонной артерии возбуждает прессорецепторы каротидного синуса, от которых идут центростремительные волокна, образующие синокаротидный нерв (нерв Геринга). Он вступает в мозг в составе языкоглоточного нерва и при возбуждении рефлекторно повышает тонус депрессорного отдела сосудодвигательного центра и ядер блуждающего нерва. Понижение АД (вследствие уменьшения объёма крови) ведёт к тому, что прессорецепторы дуги аорты и сонных артерий раздражаются менее интенсивно, тормозное влияние аортального и синокаротидного нервов на прессорный отдел сосудодвигательного центра ослабляется, сосуды суживаются, работа сердца усиливается, АД нормализуется. Эти рефлексы – пример регуляции «на выходе по рассогласованию» по принципу отрицательной обратной связи, включающей компенсаторные реакции восстановления нормального АД. Регуляция АД «на выходе по возмущению» включает компенсаторные реакции ещё до того, как АД изменится, т.е. предупреждает его отклонение от нормы. Запускаются сигналами, возникающими в рецепторах растяжения миокарда и коронарных сосудов, несущих информацию о степени наполнения кровью полостей сердца и артериальной системы. Т.е. эти реакции реализуются через внутрисердечную нервную систему и через вегетативные центры ЦНС. Сосудистые рефлексы могут возникать также при повышении давления в сосудах лёгкого, кишечника, селезёнки. Рефлексы регуляции давления крови осуществляются с помощью не только механорецепторов, но и хеморецепторов аорты и сонной артерии. Они чувствительны к СО2, недостатку О2 в крови, адреналину, никотину, СО, цианидам. Их возбуждение вызывает повышение тонуса прессорного отдела сосудодвигательного центра, сосуды суживаются, давление повышается. Одновременно возбуждается дыхательный центр. Т.о., в отличие от механорецепторов, возбуждение хеморецепторов аорты и сонной артерии вызывает прессорные сосудистые рефлексы. Хеморецепторы обнаружены также в сосудах селезёнки, надпочечников, почек, костного мозга. Сопряжённые сосудистые рефлексы преимущественно вызывают повышение АД за счёт сужения сосудов. При болевых раздражениях поверхности тела особенно суживаются сосуды брюшной полости. При раздражениях кожи холодом суживаются, главным образом, кожные артериолы. Кортикальная регуляция сосудистого тонуса была доказана как путём раздражения определённых участков коры, так и методом условных рефлексов. Многократное сочетание индифферентного раздражителя с согреванием, охлаждением, болевым раздражением приводит к выработке условного рефлекса, после чего в ответ на действие этого индифферентного ранее раздражителя возникают соответствующие сосудистые реакции. При этом часто возникают и соответствующие ощущения (тепла, холода, боли). Гуморальные влияния на сосуды. Сосудосуживающие вещества. Катехоламины (адреналин, норадреналин) суживают артерии и артериолы кожи, органов брюшной полости, лёгких. Оказывают влияние в очень малых концентрациях (1×10-7 г/л). Вазопрессин действует преимущественно на артериолы и прекапилляры. Серотонин суживает сосуды и препятствует кровотечению из повреждённого участка. Однако во II-й фазе свёртывания крови, после образования тромба, наоборот, расширяет сосуды. Ангиотензин II – активное сосудосуживающее вещество, разрушающееся ангиотензиназой. Для его образования необходим ренин. Ренин расщепляет ангиотензиноген, в результате чего образуются ангиотензин I, затем ангиотензин II. Образование ренина в почках увеличивается при снижении кровоснабжения. Сосудорасширяющие вещества. Медуллин – образуется в почках. Во многих тканях тела образуются простагландины – производные ненасыщенных жирных кислот. Брадикинин – полипептид, получен из подчелюстной, поджелудочной желёз, лёгких. Вызывает расслабление артериол. Ацетилхолин – быстро разрушается в крови, местное действие. Гистамин – расширяет артериолы. При введении больших доз вызывает шок, снижение АД, нарушения мозгового кровообращения. Обуславливает покраснение кожи при различных воздействиях на неё. При работе скелетной мускулатуры образуются адениловая, молочная и угольная кислоты и др. Дата добавления: 2016-03-26 | Просмотры: 633 | Нарушение авторских прав |