 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Свойства коллоидных растворов.1. Оптические свойства. Если взять два стакана – один с раствором NaCl, а другой – с гидрозолем, то на вид трудно установить, где истинный раствор, а где коллоидный, т. к. на вид обе жидкости прозрачны. Но их можно отличить по оптическим свойствам. Если в темноте через растворы пропустить узкий и яркий луч света, то в истинном растворе NaCl он будет невидим («истинные растворы оптически пусты»). А в стакане с золем будет видна световая дорожка – конус Фарадея-Тиндаля. Этот эффект характерен для всех дисперсных систем с размером частиц 1 – 100нм. Он объясняется рассеиванием света коллоидными частицами, размер которых соизмерим с длиной волны падающего света. Свет как бы огибает каждую частицу и меняет направление – рассеивается. Этим объясняется голубоватая опалесценция коллоидных растворов. Сильнее всего рассеиваются короткие волны, что придаёт голубую окраску небу. Меньше всего рассеиваются длинноволновые участки спектра. Поэтому стоп-фонари у машин, светофоров имеют красную окраску, чтобы было дальше видно. На явлении рассеивания света коллоидными частицами основано применение ультрамикроскопа для изучения коллоидных растворов. Как известно, малый размер коллоидных частиц не позволяет наблюдать их в обычный микроскоп. В ультрамикроскопе применяют боковое освещение, когда свет не попадает в глаз наблюдателя. Поэтому фон остается темным и на нем видны светящиеся точки коллоидных частиц. Здесь можно видеть броуновское движение, подсчитать число частиц. Но особенности структуры можно наблюдать только в электронном микроскопе. 2. Окраска коллоидных растворов. Часть падающего света коллоидный раствор поглощает. Избирательное поглощение света коллоидным раствором приводит к его окрашиванию в тот или иной цвет. Золи одного и того же вещества могут приобретать разную окраску в зависимости от способа приготовления, так как в этом случае будет разной степень дисперсности частиц. Например, золи золота в грубодисперсном состоянии имеют синюю, при большей дисперсности – фиолетовую, в высокодисперсном состоянии – ярко-красную окраски. Причем окраска золей является очень интенсивной. Например, для приготовления искусственного рубинового стекла для автомобильных фар, светофоров и т.д. на 1 т стеклянной массы надо добавить 100 г коллоидного золота. Красивая и яркая окраска драгоценных камней (рубинов, сапфиров, изумрудов) обусловлена наличием в них ничтожно малых количеств примесей тяжелых металлов и их оксидов, находящихся в коллоидном состоянии. 3. Молекулярно-кинетические свойства вызваны тепловым движением частиц в растворе. Эти свойства у коллоидных растворов принципиально не отличаются от свойств истинных растворов, но из-за большего размера коллоидных частиц и меньшей их концентрации эти свойства выражены значительно слабее. а) Броуновское движение. Частицы дисперсной фазы золя под влиянием ударов молекул растворителя находятся в состоянии непрерывного хаотического движения. Это движение хорошо видно в ультрамикроскоп. Броуновское движение коллоидных частиц можно сравнить с движением волейбольного мяча под ударами игроков. б ) Диффузия. Благодаря броуновскому движению коллоидных частиц в коллоидных растворах также возможен самопроизвольный процесс выравнивания концентрации, то есть диффузия. Коэффициент диффузии, который зависит от размеров частиц и определяется по уравнению Эйнштейна,
для коллоидных растворов будет в сотни и тысячи раз меньше, чем для истинных растворов. в) Осмотическое давление. Для разбавленных растворов неэлектролитов осмотическое давление, согласно закону Вант-Гоффа, пропорционально молярной концентрации кинетически активных частиц.
Если учесть, что объем и масса коллоидной частицы больше, чем объем и масса низкомолекулярных веществ, то в единице объема коллоидных частиц будет меньше при одной и той же массовой концентрации. А значит и меньше осмотическое давление (в сотни и тысячи раз). г) Седиментация – осаждение частиц под действием силы тяжести, отстаивание. Скорость оседания частиц зависит от их размеров, от вязкости среды, от скорости диффузии, которая противоположна седиментации. Это явление используется для разделения компонентов коллоидного раствора, например, плазму отделяют от эритроцитов. Поскольку оседание таких мелких частиц под действием силы тяжести происходит очень медленно, для ускорения применяют центрифуги и ультрацентрифуги, развивающие центробежную силу, в миллион раз превышающую силу тяжести. С помощью ультрацентрифуг определяют молекулярные массы белков и ВМС, так как скорость осаждения пропорциональна молекулярной массе. Дата добавления: 2015-12-16 | Просмотры: 595 | Нарушение авторских прав |
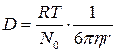 (2.1)
(2.1)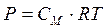 (2.2)
(2.2)