|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
На тестові завдання
Матеріали методичного забезпечення Самопідготовки студентів (орієнтовна карта для організації самостійної роботи студентів з навчальною літературою)
Література А) Навчальна Основна: 1. Акушерство и гинекология: у 2-х кн.. - Кн.. 1: Акушерство: учебник / Под ред. В.Н.Запорожана. К. «Здоров'я», 2001. С. 329-332. С. 398-406., 2. Акушерство і гінекологія: у 2-х кн. – Кн. 1: Акушерство: підручник / Кол. авторів; за ред. В.І. Грищенка, М.О. Щербини. – К.: ВСВ «Медицина», 2011. – С. 231-246. 3. Імуноконфліктна вагітність. Модуль 8.3. // Ефективний антенатальний догляд: навчальний посібник / Швейцарський інститут охорони здоров'я та тропічної медицини. - К., 2012. – Ч.I (для слухача). С. 168- 181.
Додаткова:
1. Айламазян Э.К. Акушерство. С-П., «Специальная литература», 1997. с. 362-368, с. 229-232 2. Ведення вагітності у жінок з імунними конфліктами. Клінічний протокол, затверджений наказом МОЗ України від 31.12.2004 р. № 676 3. Веропотвелян М.П. Діагностика та лікування гемолітичної хвороби плода. – З турботою про жінку. №1 (40). 2013. С 38-42.
Б) Наукова:
1. Групповые системы крови человека и гемотрансфузионные осложнения. Под ред. М.А. Умновой. Москва. «Медицина», 1998 г.
В) Методична:
1. Мірелян В.Є. Методичні основи підготовки та проведення навчальних занять в медичних вузах (методичний посібник). Видання друге, перероблене та доповнене. Київ, «Хрещатик», 2006, 80 с. 2. Імуноконфліктна вагітність. Модуль 8.3. // Ефективний антенатальний догляд: навчальний посібник / Швейцарський інститут охорони здоров'я та тропічної медицини. - К., 2012. – Ч.II (для викладача). С. 424- 429.
ДОДАТОК 1
МОДУЛЬ 8.3. ІМУНОКОНФЛІКТНА ВАГІТНІСТЬ Витяг з книги«Ефективний антенатальний догляд: навчальний посібник» / Швейцарський інститут охорони здоров'я та тропічної медицини. - К., 2012. – Ч.I (для слухача). С. 168- 181.
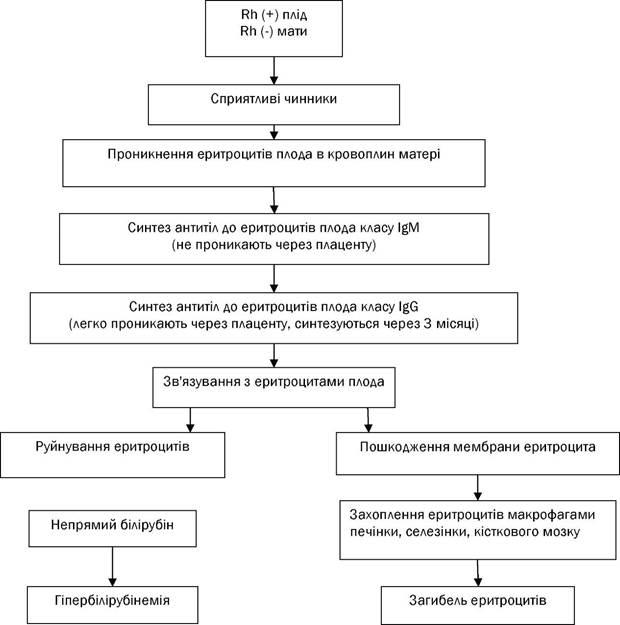
Резус-ізоімунізація під час вагітності - поява у вагітних жінок резус-антитіл у відповідь на вступ в кровоток фетальних еритроцитарних резус-антигенів. Історична довідка Ізоімунізація (імунізація матері антигенами еритроцитів плода) впродовж століть залишалася нерозв'язною загадкою для акушерів. І тільки у 1937 році Ландштейнер і Вінер за допомогою сироватки кролика, імунізованого еритроцитами мавпи виду Масасus гhеsus, відкрили в еритроцитах людини систему антигенів, що дістала згодом назву системи резус. Пізніше Левін із співавторами показали, що саме призводить до гемолітичної хвороби новонароджених. Відкриття системи резус поклав початок сучасної імуногематології. На часі розроблені високочутливі проби для виявлення антирезусних антитіл, з'явилися ефективні методи лікування і профілактики ізоімунізації. Поширеність резус-негативної крові залежить від етнічної групи. Так, найчастіше вона зустрічається у іспанських басків (30-32%), рідше у американських чорношкірих (8%) і майже не зустрічається у африканців. Серед білого населення Землі резус-негативна кров є приблизно у 15-16%. 95% усіх клінічно значущих випадків гемолітичної хвороби плода обумовлені несумісністю саме по резус (Rh) - фактору, 5% - за системою АВ0. Відома сенсибілізація і по інших еритроцитарних антигенах (описано більше 10 ізосерологічних систем), проте сенсибілізація по ним зустрічається украй рідко. Резус-фактор - система алогених еритроцитарних антигенів людини, не залежна від чинників, що обумовлюють групу крові (системи АВ0), і інших генетичних маркерів. Rh-ізоімунізація - гуморальна імунна відповідь на еритроцитарні антигени плода Rh-групи з проникненням антитіл, що утворюються, через плаценту. Це викликає екстраваскулярний гемоліз (опсонізація еритроцитів плода антитілами жінки і фагоцитоз еритроцитів) і анемію, і призводить до еритробластозу плода. Нині відомо більше десяти ізосерологічних систем червоної крові, однак основними чинниками системи резус є фактори D, d, С, с, Е, е (термінологія Фішера) або відповідно Rh0, Rh', Rh" (термінологія Вінера). Всі резус-позитивні еритроцити містять D-фактор (Rh0-фактор за термінологією Вінера), а так звані резус-негативні еритроцити його не мають, хоча в них обов'язкове інші антигени системи резус (d, c, e). Коли пишуть D - антиген, мають на увазі відсутність d - антигена. D (Rh0) - антиген – це ліпопротеїн, розташований на внутрішній поверхні плазмової мембрани еритроцитів, тоді як АВ-антигени - на зовнішній. Повна відсутність резус-антигенів буває дуже рідко. Вважається, що природні антитіла до антигенів системи резус відсутні. Ізосенсибілізація до антигенів цієї системи може виникати при переливанні несумісної крові або у жінок в результаті вагітності у тому випадку, коли плід має антигени, що відсутні в крові матері. Ізосенсибілізація до резус-фактора виникає при попаданні Rh-позитивних еритроцитів плода в кров матері з негативним резусом. Для сенсибілізації матері досить 0,1 мл фетальних еритроцитів. Антиген D (Rh0) міститься в крові 85% людей; антиген С (Rh')- в крові 70% людей і антиген Е (Rh") - в крові у 30% осіб. За наявності хоч би одного з цих антигенів на еритроцитах людина являється резус-позитивною. Як показали подальші дослідження, кров резус-негативних людей також не позбавлена антигенних властивостей. Є три різновиди антигена Нr: антигени d, с, е. Чинник «d» не має здатності викликати утворення антитіл; антиген «с» зустрічається в крові 85% людей, володіє вираженими антигенними властивостями. У літературі описані випадки гемолітичної хвороби внаслідок несумісності крові матері і плода по антигену «с». Антиген «е» зустрічається в крові 98% людей і має слабкі антигенні властивості. Перебіг імуноконфліктної вагітності може супроводжуватися загрозою переривання вагітності, анемією, вегетосудиними реакціями, появою раннього і пізнього гестозу, мимовільними викиднями, передчасними пологами, внутрішньоутробною загибеллю плода, народженням дітей з гемолітичною хворобою. Подібні ускладнення вагітності можуть з'являтися у жінок і за відсутності антитіл і в певних умовах сприяти виникненню ізосенсибілізації або її посиленню. До недавнього часу вважалося, що кровообіг плода ізольований від материнського і обмін клітинами між ними практично неможливий. На разі можливість переходу формених елементів фетальної крові в материнський кровоток і материнської крові в кровоток плода можна вважати доведеною. Більшість авторів вважають, що такі ускладнення вагітності як гестоз і різні ушкодження плаценти сприяють переходу фетальних еритроцитів в кровоток матері та її сенсибілізації антигенами плода.
Патогенез розвитку ізосенсибілізації при резус-конфліктній вагітності
Резус-ізоімунізація під час першої вагітності • До пологів резус-ізоімунізація під час першої вагітності має місце у 1% резус-негативних жінок, вагітних резус-позитивним плодом. • Ризик зростає із збільшенням терміну вагітності. • Еритроцити проникають через плацентарний бар'єр у 5% випадків впродовж I триместру, в 15% - впродовж II триместру і в 30% - у кінці III триместру. Проте в переважній більшості випадків, кількість клітин плода, що потрапляють в кров матері, невелика і недостатня для розвитку імунної відповіді. • Ризик зростає при використанні інвазивних процедур і при перериванні вагітності. • Плодово-материнська кровотеча при амніоцентезі в II і III триместрах має місце у 20% вагітних, а при мимовільних або штучних абортах - у 15%. Резус-імунізація під час пологів Резус-ізоімунізація матері - наслідок потрапляння еритроцитів плода в кровоток матері під час пологів. Після пологів ізоімунізація спостерігається лише у 10-15% резус-негативних жінок, що народжують резус-позитивних дітей. Чинники, що впливають на виникнення резус-ізоімунізації при першій вагітності і перших пологах: • об'єм плодово-материнської трансфузії: чим більше антигенів потрапляє в кровоток, тим вище вірогідність імунізації. При плодово-материнській кровотечі менше 0,1 мл вірогідність імунізації складає менше 3%, від 0,1 до 0,25 мл - 9,4%, 0,25-3,0 мл - 20%, більше 3 мл - до 50%; • невідповідність матері і плода за системою АВ0. Якщо вагітна має групу крові 0, а батько - А, В або АВ, то частота резус-ізоімунізації знижується на 50-75%; • наявність впродовж цієї вагітності травматизації плаценти при амніоцентезі, а також кровотеч при нормальному і низькому розташуванні плаценти, ручному відділенні плаценти і виділенні посліду, кесаревому розтині; • генетичні особливості імунної відповіді: близько 1/3 жінок не імунізуються резус- антигеном під час вагітності. Якщо у жінки вагітність не перша, то на підвищення ризику резус-імунізації, окрім вказаних вище чинників, впливають мимовільний і штучний аборт, операції по видаленню плодового яйця при позаматковій вагітності.
1. Чинники, пов'язані з попередніми вагітностями: • позаматкова вагітність; • переривання вагітностей (мимовільний викидень, штучний аборт, антенатальна загибель плода); • інвазивні процедури впродовж попередніх вагітностей (амніоцентез, кордоцентез); • кровотечі впродовж попередніх вагітностей (відшарування нормальної і низько розташованої плаценти, травми живота, тазу); • особливості розродження (кесарів розтин, ручне обстеження післяпологової матки, ручне відділення плаценти і виділення посліду); • проведення профілактики резус-імунізації впродовж попередніх вагітностей або в післяпологовому періоді (яким препаратом, в яких дозах). 2. Чинники, не пов'язані з вагітністю: • гемотрансфузії без урахування резус-фактора, використання одного шприца наркоманами. 3. Інформація про попередніх дітей або результати попередніх вагітностей, особливий акцент ставиться на тяжкості гемолітичної хвороби у попередньої дитини. У зв'язку із зростаючим ризиком для плода при наступній вагітності важливо з'ясувати, на якому гестаційному терміні проявилися ознаки гемолітичної хвороби у попередньої дитини і тяжкість гемолітичної хвороби новонародженого. Необхідно з'ясувати собливості терапії попередньої дитини, зокрема, чи проводилося замінне переливання крові (скільки разів) або фототерапія, побічно вказують на міру гіпербілірубінемія і анемії.
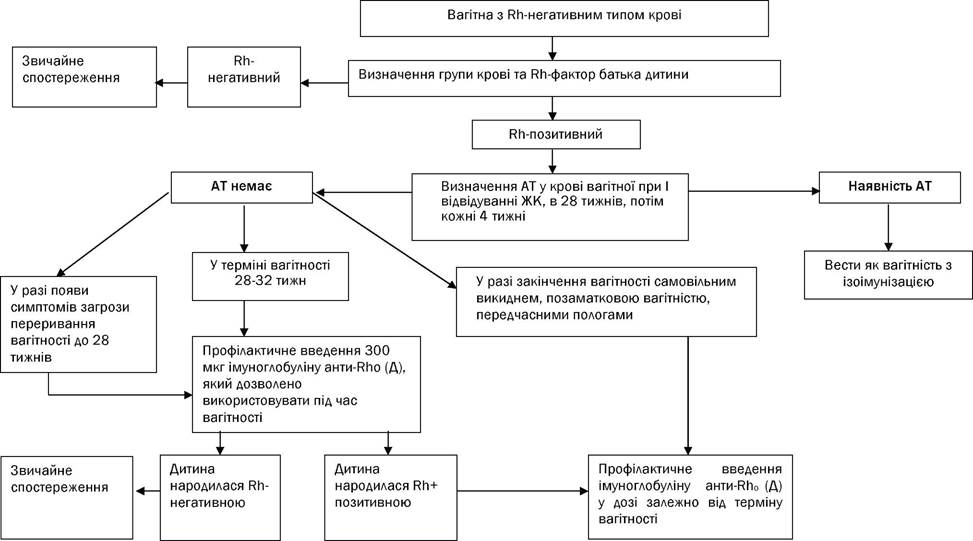
Діагностика Ретельний збір анамнезу: 1. Визначення групи крові, резус-фактора подружжя, наявність та титри резус - антитіл при постановці на облік. 2. Оцінка чинників ризику Rh-імунізації (табл.1) Оцінка резус-імунізації вагітної • Якщо мати і батько мають резус-негативну кров, немає необхідності в подальшому динамічному визначенні рівнів антитіл. • У разі, коли вагітна з резус-негативною кров'ю має партнера з резус-позитивною кров'ю, наступним етапом повинне стати визначення титру антитіл в динаміці. • Наявність інформації про попередні титри антитіл потрібна для вирішення питання про те, чи була імунізація раніше, чи вона з'явилась при цій вагітності. • Визначення класу антитіл^ повні антитіла не представляють ризику для плода, а неповні антитіла можуть викликати гемолітичну хворобу плода, тому при їх виявленні потрібне визначення титру антитіл. • За наявності попередньої імунізації гемолітична хвороба плода може розвинутися і при першій вагітності. Спеціальні методи дослідження: • Визначення Rh-приналежності і титру антитіл при постановці на облік. • Визначення титру антитіл у Rh -негативної жінки, чоловік якої Rh –позитивний. Величина титру резус-антитіл не завжди відображує ступінь тяжкості резус-конфлікту. У динаміці вагітності доцільно розрізняти наступні типи зміни рівня антитіл: • постійний (важка ГХПН - 8%; здорові діти - 30%; гине до 10% новонароджених); • що знижується (важка ГХПН - 9%; здорові діти - 24%; гине до 10% новонароджених); • що зростає (важка ГХПН - 15%; здорові діти - 20%; гине до 19% новонароджених); • що "скаче" (важка ГХПН - до 30%; здорові діти - 15%; гине до 25% новонароджених). Стани, коли титр антитіл втрачає свою інформативність і потребує контролю динаміки перебігу вагітності за даними дослідження амніотичної рідини: 1. Титр антитіл при першому ж визначенні знаходиться на критичному рівні і вище; 2. Титр досягає або перевищує критичний рівень при будь-якому терміні вагітності; 3. Виявляється значне збільшення (на 2 і більше розведення) титру між двома будь-якими послідовними пробами, навіть якщо найвище дослідження не досягає критичного рівня; 4. Будь-яке наростання титру антитіл і ультразвукові ознаки гемолітичної хвороби у плода; 5. Мертвонародження або народження дітей з гемолітичною хворобою в анамнезі у поєднанні з УЗ ознаками гемолітичної хвороби при цій вагітності. Діагностиці допомагає реакція Кумбса. За наявності неповних (блокуючих) антитіл на поверхні еритроцитів досліджуваного пацієнта відбувається аглютинація еритроцитів при інкубації їх з антиглобуліновою сироваткою (непрямий тест Кумбса) або з розведеннями сироватки пацієнта в реакції із заздалегідь сенсибілізованими еритроцитами донора сольовими розчинами (прямий тест). Повні антитіла відносяться до класу IG М, не проходять через плаценту і не є небезпечними для плода. Непрямі антитіла відносяться до класу IG G, вони легко проникають через плаценту до плода, викликаючи гемолітичну хворобу плода). Ведення не імунізованих вагітних. • Визначення титру антитіл при постановці на облік по вагітності і в 28 тижнів. • У разі виявлення на будь-якому терміні вагітності резус-анти D-антитіл вагітну слід вести як вагітну з резус-імунізацією. • За відсутності ізоімунізації вагітної вводять анти – Rh0 (D) - імуноглобулін на 28-му тижні вагітності. • Якщо в 28 тижнів проводилася профілактика анти – Rh0 (D) - імуноглобуліном, то визначення антитіл в крові вагітній уже не має клінічного значення. Профілактика резус-імунізації Впровадження в практику анти - Rh0 (D) -імуноглобуліну стало одним з найбільших досягнень в акушерстві за декілька останніх десятиліть. Механізм дії. Доведено, що якщо антиген і його антитіло вводити разом, то не відзначається імунної відповіді за умови адекватної дози антитіл. За тим же принципом анти-Rh0 (D)-імуноглобулін (антитіло) захищає від імунної реакції, коли резус-негативна жінка піддається дії Rh0(+)[D (+)] клітин плода (антиген). Анти-Rh0 (D)- імуноглобулін не має негативної дії на плід і новонародженого. Доза, рівна 300 мкг анти- Rh0 (D)- імуноглобуліну, введеного в 28 тижнів вагітності, дозволяє зменшити ризик ізоімунізації впродовж першої вагітності з 1,5 до 0,2%. Тому в 28 тижнів гестації усі резус-негативні не імунізовані вагітні (відсутні антитіла), коли батько плода резус-позитивний, повинні отримувати профілактично 300 мкг анти - Rh0 (D)-імуноглобуліну. Якщо профілактика під час вагітності в терміні 28 тиж. не була проведена, то кожній не імунізованій жінці з резус- негативною кров'ю в межах 72 годин після пологів при народженні дитини з резус-позитивною кров'ю вводиться 300 мкг (1500 МЕ) анти-Rh0(D)-імуноглобуліну. Такої ж тактики дотримуються, якщо з тих або інших причин резус-приналежність дитини не може бути визначена. Призначення анти-Rh0(D)-імуноглобуліну резус-негативним не імунізованим жінкам під час вагітності необхідно після проведення процедур, що супроводжуються небезпекою плодово- материнської трансфузії: • штучного переривання вагітності або мимовільного аборту; • ектопічній вагітності; • евакуації міхурового заносу; • амніоцентезу (особливо трансплацентарного), біопсії хоріону, кордоцентезу; • кровотечі під час вагітності, обумовленої передчасним відшаруванням нормально розташованої плаценти або передлежанням плаценти; • закритої травми очеревини матері (автокатастрофа); • зовнішнього повороту при тазовому передлежанні; • загибелі плода; • випадкового переливання резус-позитивної крові резус-негативній жінці; • трансфузії тромбоцитів. При терміні вагітності до 13 тижнів доза анти-Rh0 (D)-імуноглобуліну складає 50-75 мкг, при терміні більше 13 тижнів - 300 мкг. Введення анти - Rh0 (D)-імуноглобуліну Анти-Rh0(D)-імуноглобулін вводять внутрішньом'язево в дельтовидний (переважно) або сідничний м'яз, строго, інакше при попаданні в підшкірну жирову клітковину всмоктування буде відстроченим. Стандартна доза 300 мкг (1500 МЕ) анти - Rh0 (D)-імуноглобуліну перекриває плодово-материнська кровотечу в об'ємі 30 мл цілісної резус-позитивної крові або 15 мл еритроцитів плода. Корекція дози анти-Rh0 (D)-імуноглобуліну потрібна при підозрі на значну плодово-материнську кровотечу. За допомогою тесту Клейхауера-Бертке (Кlеіnhauег - Веrtке) встановлюють кількість фетальних еритроцитів в материнській циркуляції. Якщо об'єм плодово- материнської кровотечі не перевищує 25 мл, вводять 300 мкг анти-Rh0 (D)-імуноглобуліну (стандартна доза), то при об'ємі 25-50 мл - 600 мкг. Необхідно збільшити дозу анти - Rh0 (D)-імуноглобуліну при: • кесаревому розтині; • передлежанні плаценти; • передчасному відшаруванню плаценти; • ручному відділенні плаценти і виділенні посліду. Профілактика може бути неефективною в наступних ситуаціях: • введена доза занадто мала і не відповідає об'єму плодово-материнської кровотечі; • доза введена надто пізно. Анти-Rh0(D ) -імуноглобулін ефективний, якщо використовується в межах 72 годин після пологів або дії резус-позитивних клітин на організм матері; • пацієнтка вже була імунізована, але рівень антитіл при цьому менше, ніж це необхідно для лабораторного визначення; • введений нестандартний анти-Rh0(D ) -імуноглобулін (недостатньої активності) для нейтралізації фетальних еритроцитів, що проникли в організм матері.
Діагностика гемолітичної хвороби
Окрім визначення титру антитіл у вагітної діагностика ГХ плода проводиться послідовно за допомогою неінвазивних (УЗД, КТГ) та інвазивньїх (амніо-, кордоцентез) методів дослідження. Велике значення в діагностиці ГХ плода має ультразвукове дослідження (УЗД), що дозволяє виявити зміни як товщини плаценти, так і стану плода. Кожному терміну гестації відповідає певна товщина плаценти, розміри окружності живота та печінки плода. УЗД у вагітних з резус-сенсибілізацією необхідно проводити, починаючи з 18 - 20 тижнів. До цього терміну ультразвукові ознаки ГХ плода, як правило, не визначаються. До 32 тижнів повторні УЗД проводяться через кожні 2-4 тижні, в подальшому - кожні 1-2 тижні. При підозрі на тяжку форму ГХ плода інтервал між дослідженнями може скорочуватися до 1 - 3 днів. У кожної вагітної терміни повторних сканувань визначаються індивідуально. Анемія плода не має патогномонічних ехографічних ознак, і навіть важкі ступені її вираженості можуть не супроводжуватися розвитком водянки. При ГХ плода по мірі зростання тяжкості захворювання спостерігається збільшення товщини плаценти. Перевищення нормальної для терміну вагітності товщини плаценти на 0,5 - 1,0 см є однією з ранніх ознак ГХ плода. Характерними для ГХ плода ультразвуковими критеріями також є збільшення розмірів печінки і селезінки плода. Найбільш точно при УЗД діагностується набрякова форма ГХ плода, критеріями якої є: • виражена плацентомегалія, • гепатоспленомегалія, • асцит, • багатоводдя. При вираженій водянці плода спостерігаються, крім цього, кардіомегалія і перикардіальний випіт, гідроторакс, підвищена ехогенність кишківника внаслідок набряку його стінки, набряк підшкірної клітковини голови («подвійний контур» голівки), тулуба і кінцівок плода. Додатковим ультразвуковим критерієм тяжкості захворювання плода може служити розширення вени пуповини (більше 10 мм). У діагностиці важкої анемії плода є ще один важливий момент - трикуспідальна регургітація, яка передує асциту і набряку плода. Використання цієї патологічної ознаки може допомогти у зниженні кількості хибнопозитивних результатів. Якщо у плода, що має ризик розвитку анемії з нормальними значеннями пікової систолічної швидкості (ПСШ) кровотоку в средньомозковій артерії (СМА) визначається трикуспідальна регургітація - найвірогідніше у нього анемія. Практично всі УЗ маркери (крім показника ПСШ в СМА, виміреного за допомогою допплерометрії) мають низьку чутливістю, пізно проявляються, тому не можуть використовуватися в якості раннього предиктора, який прогнозує розвиток ГХ плода. У деяких ситуаціях УЗ метод являється єдино можливим для спостереження за станом плода. Зокрема, при підтіканні навколоплідних вод, відсутності технічних можливостей для проведення амніоцентезу і кордоцентезу, при забрудненні навколоплідних вод кров'ю або меконієм, при відмові пацієнтки від інвазивних процедур. Функціональний стан плода у вагітних з резус-сенсибілізацією оцінюють, використовуючи також кардіотокографію і біофізичний профіль плода, які доцільно проводити в амбулаторних умовах, починаючи з 30-32 тижнів вагітності до розродження. За наявності ознак порушення стану плода моніторинг необхідно проводити щодня з метою визначення подальшої тактики ведення та часу розродження. При КТГ відзначаються характерні для гіпоксії плода зміни, міра вираженості яких збільшується з наростанням важкості гемолітичної хвороби плода. Реєстрація при КТГ кривої «синусоїдального» типу свідчить про наявність тяжкої форми гемолітичної хвороби і вкрай важкого стану плода. Однак КТГ в ізольованому використані не має суттєвого діагностичного значення, так як ознаки тяжкості стану плода на кривих КТГ з'являються значно пізніше, ніж при доплерометрії у СМА. Оцінка ступеня тяжкості ГХ плода грунтується у тому числі і на інвазивних пренатальних втручаннях (амніоцентез, кордоцентез). Амніоцентез при ГХ плода проводиться вже з 22-24 тижнів вагітності під УЗ контролем для запобігання травматизації плаценти або пуповини. При травмі виникає кровотеча у плода і матері, що збільшує ступінь імунізації. Отриману амніотичну рідину піддають спектрофотометрії (після виконання амніоцентезу вагітній необхідно ввести анти-Rh0(D)-імуноглобулін у дозі 300 мкг). Діагностична цінність амніоцентеза обумовлена тим, що при ГХ за рахунок гемолізу еритроцитів відбувається підвищення концентрації білірубіну в крові плода (у сечі, в навколоплідних водах) і, відповідно, оптичної щільності білірубіну (ОЩБ) в амніотичній рідині. ОЩБ в амніотичній рідині визначають з 24 тижнів вагітності за допомогою спектрофотометра з довжиною хвилі від 400 до 700 нм і отримані дані аналізують відповідно до модифікованої шкали Лілі, яка має на увазі додатковий розподіл 2 зони шкали Лілі на три сегменти - А, В і С. Це дозволяє уточнити показання до кордоцентезу (при відповідності значень ОЩБ зонам 2В і 2С) і тим самим підвищити діагностичну значимість методу. Якщо значення ОЩБ відповідає 1-ій зоні, то у плода можна виключити ГХ. Чим ближче величина ОЩБ до 3-ї зони (2С), тим більш імовірний важкий ступінь захворювання плода і, навпаки, чим далі розташована величина ОЩБ від 3-ї зони (2А), тим менш імовірна ГХП. В залежності від величини ОЩБ по відношенню до відповідних зон шкали рекомендуються подальші діагностичні заходи: якщо значення ОЩБ знаходяться в зоні 2А, то амніоцентез необхідно повторити через 4 тижні; при відповідності зоні 2В процедуру проводять через 1 - 2 тижні. Значення ОЩБ, що знаходяться в межах зони 2С і 3-ї зони, є показанням до діагностичного кордоцентезу і, можливо, внутрішньоутробного переливання крові. В даний час амніоцентез представляє історичний інтерес і має відносну цінність, оскільки він неінформативний при апластичній анемії у плода. Його використовують тільки в якості додаткового методу при виконанні діагностичного кордоцентезу. Оптимальним діагностичним тестом ГХ плода є дослідження крові плода, отриманої шляхом кордоцентеза. Аналіз 1-2 мл плодової крові дає можливість визначити: резус належність, гематокрит (Нt), гемоглобін (Нb), кількість еритроцитів, білірубін, кислотнолужну рівновагу (КЛР), а також кількість ретикулоцитів, рівень сироваткового білку, антитіла, пов'язані з фетальними еритроцитами. Зниження гематокриту на 15% від норми свідчить про тяжкість захворювання і служить одним з визначальних чинників у показаннях до внутрішньоутробного переливання крові (ВПК). Показники кислотнолужної рівноваги дозволяють виявити наявність гіпоксії плода. Визначення кардіотропоніна Т в крові плода з ГХ дозволяє зробити прогностичну оцінку стану його серцево - судинної системи, при позитивному тесті - прогноз несприятливий. У таких випадках ВПК малоефективне. Кордоцентез здійснюється під контролем УЗД і при відповідному досвіді не представляє великих труднощів. Показаннями до кордоцентезу, який при ізоіммунізаціі і анемії плода зазвичай проводиться з 24 тижнів вагітності (але можливо і раніше - з 20 тижнів), є: · відповідність рівня ОЩБ зоні 3 або 2С шкали Лілі, ультразвукові маркери ГБ плода; · підвищення максимальної систолічної швидкості кровотоку в СМА плода; · рідше обтяжений акушерський анамнез (анте-, інтра-, постнатальна загибель дітей від ГХ або коли вони перенесли кількаразові замінні переливання крові в неонатальному періоді); · титр антитіл більш 1:16. До 2000 року стандартом ведення плода з ризиком анемії була інвазивна тактика відповідно до акушерського анамнезу або по досягненні «критичного титру АТ». Останнім часом стало можливо більш точно передбачити анемію плода з використанням неінвазивної методики: вимірювання пікової систолічної швидкості (ПСШ) в середній мозковій артерії (СМА). Дослідження G.Маrі (1987 р.) показали високу ступінь кореляції між гематокритом і максимальною швидкістю кровотоку в середньомозковій артерії. Діагностичне значення даного методу визначається тим, що в результаті анемії і, відповідно, гіпоксії у плода виникає периферична вазодилятація і стимуляція хеморецепторів. Це призводить до збільшення скорочувальної здатності міокарда і, отже, до збільшення серцевого викиду. Поряд з цим при ГХ плода відбувається зниження в'язкості крові, що, в свою чергу, сприяє збільшенню венозного повернення і серцевого викиду. Таким чином, виникає гіпердинамічний стан кровообігу і максимальна швидкість кровотоку в середній мозковій артерії плода збільшується, корелюючи з тяжкістю анемії у плода при ГХ. Метод допплерометрії ПСШ в СМА плода найбільш точний, достовірний з низьким хибнопозитивним результатом, однак вимагає строгого дотримання методики вимірювання. Цей критерій, оцінений в динаміці, в даний час використовується як маркер тяжкості анемії у плода для визначення оптимальних термінів початку інфузій та їх повторів при анемічній формі гемолітичної хвороби. Оптимальне граничне значення пікової систолічної швидкості кровотоку, що характеризує легку анемію - 1,29 МоМ, середньої тяжкості анемію - 1,50 МоМ, важку анемію - 1,55 МоМ. Пікова систолічна швидкість кровотоку 1,5 МоМ і більше відповідає анемії середнього або важкого ступеня з чутливістю 100% і частотою хибнопозитивних результатів 12%. Більш простим способом для швидкого визначення порогового значення ПСШ (см / сек) в СМА, відповідного 1,5 МоМ, є подвоєння терміну вагітності (тижнів); при якому проводиться УЗД. Отримана величина практично буде відповідати 1,5 МоМ - ПСШ в СМА виміряної в см / сек. Однак, для найбільш точного розрахунку краще використовувати спеціальні таблиці або електронний калькулятор. У разі відповідності максимальної швидкості кровотоку в СМА рівню медіани значень для терміну вагітності повторні вимірювання проводять через 2 тижні, при збільшенні швидкості до 1,2 МоМ - через 7-10 днів, при швидкості 1,2-1,4 МоМ - через 5 - 7 днів. Якщо швидкість становила 1,5 МоМ, виконується кордоцентез з метою діагностики анемії у плода та підбору донора. Розрахунок гемоглобіну плода в МоМ здійснюється за формулою на основі показника ПCШ в СМА: У = 1.185 - 0.341 х, де У - гемоглобін плода (МоМ), Х - максимальна швидкість кровотоку в середній мозковій артерії у плода (МоМ). Отриманий результат розцінюється таким чином: Нb <0,84 МоМ - легкий ступінь анемії; <0,65 МоМ - середня і <0,55 МоМ - важка. Вимірювання максимальної швидкості кровотоку в СМА та застосування цього критерію для діагностики анемії плода є одним з відкриттів у фетальної медицині. Воно значно змінило стандарти курації вагітних з ізоіммунізацією і ГХ плода. Це дозволило більш ніж на 70% знизити кількість інвазивних процедур, частина з яких супроводжуються втратою вагітності, і значно поліпшити перинатальні наслідки при імуноконфліктній вагітності.
Тактика ведення вагітності при Rh-ізоіммунізаціі вагітної
Тактика ведення вагітності при Rh-ізоіммунізаціі вагітної жінки залежить від Rh-належності плода. Люди з резус-позитивною кров'ю можуть бути гомозиготними (DD) і гетерозиготними (Dd). Якщо батько гомозиготний (DD), що відзначається у 40-45% всіх чоловіків з резус-позитивною кров'ю, то домінантний ген D завжди передається плоду. Отже, у жінки з резус-негативною кров'ю (DD) плід буде Rh-позитивним у 100% випадків. Якщо батько гетерозиготний (Dd), що спостерігається у 55-60% всіх резус-позитивних чоловіків, то плід буде резус-позитивним у 50% випадків, оскільки можливо спадкування і домінантного, і рецесивного гена. Метод ПЛР визначення гетерозиготності батька на даний період часу є доступним і впроваджений у рутинну практику. Існує можливість визначення Rh-генотипу плода за допомогою молекулярно-генетичних методів з використанням будь-яких клітин плодового походження, що дає унікальну можливість визначати тактику ведення Rh -імунізованих жінок вже на початку вагітності. Полімеразна ланцюгова реакція має 100% чутливість і специфічність при визначенні Rh - генотипу плода. Для проведення пренатальних молекулярно-генетичних досліджень відбирають зразки ворсин хоріону, плаценти, амніотичної рідини чи крові плода (в залежності від терміну вагітності). Амніоцентез є найбільш безпечним інвазивним втручанням для плода в період з 14-го по 18-й тиждень вагітності, так як це найкращий термін для Rh-типування плодів у Rh -імунізованих вагітних жінок. При дослідженні плідного матеріалу виділення ДНК (для наступного типування гену Rh D тощо) проводиться мікрометодом (зважаючи на невелику кількість матеріалу, що можна отримати). Однак, враховуючи певний ризик самовільних викиднів (0,5-1,5%) та ще більшої Rh - імунізації жінки при проведені інвазивних процедур, для отримання зразків ДНК плода в найближчому майбутньому в клінічній практиці широко будуть застосовуватися неінвазивні методи досліджень. Неінвазивні методи базуються на виділенні циркулюючої позаклітинної плідної ДНК (виявляється вже з 4-го тижня вагітності за рахунок плодово-маткових трансфузій) з периферійної крові матері. Необхідна для діагностики концентрація накопичується же з 10-го тижня. Зараз для виділення плідної ДНК переважно використовують методи, засновані на застосуванні сорбції ДНК на мікромембрані (з подальшою екстракцією в робочий розчин). Однак такі методи мають суттєвий недолік - застосовується обмежена кількість крові, що може містити недостатньо плідної ДНК. Такого недоліку позбавлені методи виділення з застосуванням різноманітних неорганічних сорбентів, але вони менш чутливі. Тому на даний час методики виділення вільної циркулюючої ДНК плідного походження знаходяться на етапі вдосконалення, що не дає можливості широко застосовувати даний вид діагностики.
Лікування гемолітичної хвороби плода
До теперішнього часу етіопатогенетичних методів лікування ГХ плода на початковій стадії розвитку не існує. Лікування ізосерологічної несумісності крові матері і плода не проводять. До теперішнього часу визнані неефективними методи, «що знижують» ступінь сенсибілізації (рівень титру АТ): неспецифічна десенсибілізуюча терапія, трансплантація шкірного клаптя від чоловіка, гемосорбція, плазмоферез. Сьогодні можна стверджувати, що основним методом («золотим стандартом») лікування важких форм ГХ плода є проведення внутрішньоутробного переливання крові (ВПК), а точніше - відмитих/ фільтрованих еритроцитів донора під ультразвуковим контролем у вену пуповини. В окремих клініках ВПК проводиться під внутрішньопечінковий відділ пуповинної вени. Запропоновані раніше інтраперитонеальні, а також інтракардіальні переливання крові в даний час практично не проводяться. ВПК плода підвищує рівень гемоглобіну і гематокриту, знижує ризик розвитку набрякової форми ГХ і дозволяє пролонгувати вагітність. Показанням до ВПК є зниження показників гемоглобіну і гематокриту на 15% і більше по відношенню до гестаційної норми. При відсутності набряку у плода після переливання спостерігається повна нормалізація показників його крові, зокрема, гематокрит підвищується в середньому в 1,9 рази. Навіть при важкій гемолітичній анемії на тлі розвиненого набряку у плода цей метод дозволяє здійснити повну корекцію анемії при збільшенні значень гематокриту в 3 рази. ВПК можуть проводитися неодноразово до 32 - 34- х тижнів вагітності, після цього строку вирішується питання про дострокові пологи. У більш пізні терміни перед пологами відбувається посилення транспорту ізоантитіл через плаценту і наростання тяжкості ГХ. Інвазивні маніпуляції проводяться методом «вільної руки», одно- або двохголковим способом, голками 186 - 226 під ультразвуковим контролем, місцевою анестезією і токолізом. Трансамніально або трансплацентарно виконується кордоцентез і пункція кореня пуповини або її вільної петлі. Релаксація плода (тільки для трансфузії) досягається введенням у вену пуповини розчину ардуану в дозі 0,05-0,08 мг/кг передбачуваної маси плода. При набряковому синдромі плода необхідно визначати каріотип. У разі зниження гемоглобіну менше 90 г/л і гематокриту менше 30% проводять трансфузію крові, відповідно з регламентуючими нормативними документами. Обсяг трансфузії визначається за формулою: V = Ht3-Нt1 / Нt2 х ПМП х V1, де - V - необхідний обсяг трансфузії, Нt1 - передопераційний гемотокрит плода, Нt2 - гематокрит донорської крові, Нt3 - нормальний рівень гематокриту для даного гестаційного віку, ПМП - передбачувана маса плода, V1 - ОЦК плода для даного терміну вагітності/ Для розрахунку обсягу трансфузії можуть також використовуватися показники гемоглобіну. Окремі клініки практикують внутрішньоутробні замінні переливання крові плода, які виконуються невеликими обсягами, дробно в процесі трансфузії, виходячи з ОЦК плода і його гестаційного віку. Повторне ВПК призначається, виходячи із середньої швидкості падіння гематокриту на 1-2% в добу. Зниження рівня гематокриту пояснюється подальшим зростанням плода, збільшенням фетоплацентарного обсягу і частково внаслідок руйнування донорських еритроцитів. При використанні ПСШ кровотоку в СМА, в якості критерію відбору для повторного ВПК вже після другої гемотрансфузії рекомендується застосувати порогове значення - 1,4 МоМ. З кожним наступним ВПК істотно зростає похибка при оцінці ПСШ в СМА, частіше в бік хибно - негативного результату. Зазвичай для внутрішньоутробних трансфузій застосовують донорські «відмиті» еритроцити з терміном зберігання не більше 24 години з гематокритом 80-85%. Крім того для фетальної гемотрансфузії при гемолітичної хвороби плода стали використовувати свіжу фільтровану еритроцитарну масу, збіднену на лейкоцити і тромбоцити (ЕМЗЛТ) 0 (І) резус-негативної крові. Використання свіжих відмитих еритроцитів для цієї мети до теперішнього часу практикується в різних країнах світу, проте відмиті еритроцити поступаються по ряду своїх якостей фільтрованим еритроцитам, одержаних за допомогою більш досконалих технологій. Вони мають кращі реологічні властивості і значно більшу тривалість «життя» і термін зберігання. Такі переваги є наслідком того, що при їх виготовленні використовуються замкнуті, закриті системи пластикових контейнерів для донорської крові та її компонентів з інтегрованим лейкофільтром, в той час як відмиті еритроцити виходять за допомогою 3-5 кратного відмивання у фізіологічному розчині, що збільшує механічне навантаження на еритроцити. Оскільки відмивання еритроцитарної маси (ЕМ) проводиться у відкритій системі, то термін її зберігання до використання (через ризик бактеріального забруднення) може бути не більше 24 години при температурі +1-+6°С. На відміну від фільтрації, відмивання повністю не очищає еритроцитарну масу від клітин лейкоцитарного ряду, що зберігає деяку небезпеку ізосенсібілізаціі, а також повністю не рятує ЕМ від трансмісії вірусів гепатиту, ВІЛ, цитомегаловірусу та інших інфекцій. Крім того в вимитій у сольовому розчині ЕМ через 24 години збільшується рівень вільного гемоглобіну, тобто відбувається гемоліз еритроцитів, який наростає з часом і до третього дня більше 35-40% еритроцитів руйнується (термін життя вимитій ЕМ можна збільшити до 3-4 діб і більше, якщо відразу після відмивання в пакет додати 50-100 мл декальціновану модифіковану желатіноль, однак це суттєво знизить показник гематокриту і вимагатиме збільшення обсягу трансфузії плода). Тому переважніше використання фільтрованої ЕМЗЛТ. Переливання здійснюється за допомогою шприців об'ємом 10 мл через систему, що складається з провідника і триходового крана, у вену пуповини зі швидкістю від від одного до трьох-п'яти мл/хв. Для верифікації положення голки у вені пуповини використовують такі критерії: оцінка положення голки в В-режимі, колір витягуваної крові (з вени вона яскраво червона), візуалізація потоку розчину піпекуронія у вені пуповини. Пункція артерії в 5 разів збільшує ризик брадикардії та може стати причиною асистолії у плода. Протягом всієї операції здійснюється спостереження за положенням голки, потоком донорської крові в вені пуповини, видимим у В-режимі та режимі КДК і серцебиттям плода (зміщення голки може викликати різні ускладнення: гематома, наскрізна перфорація вени, кровотеча та ін.) Перед початком і в кінці трансфузії проводиться експрес оцінка показників гемоглобіну і гематокриту. Трансфузія завершується при досягненні гематокриту 48-55%, у разі водянки плода - 40-45% (або менше в залежності від стану плода). Контроль за станом плода під час ВПК, щоб уникнути перевантаження його серцево-судинної системи і розвитку важкої брадикардії, проводиться шляхом постійного кардіомоніторного спостереження за серцевим ритмом. Для знерухомлення плода внутрішньосудинно вводиться міорелаксант піпекуроній (ардуан). Ардуан не пригнічує серцеву діяльність у плода та в дозі 0,05 мг на 1 кг розрахункової маси плода викликає повну його іммобілізацію протягом 40-50 хвилин. Знерухомлення плода дозволяє скоротити тривалість внутрішньоматкових втручань, значно знизити частоту випадків виходу кінця пункційної голки з просвіту судини пуповини і, отже, уникнути трансфузії крові донора в амніотичну порожнину і необхідності виконання повторних кордоцентезів в цілях продовження переливання. Введені плоду міорелаксанти сприяють збільшенню частоти серцевих скорочень. Без них виникають брадикардії (особливо при водянці плода) і зниження серцевого викиду, який необхідний для виведення кислих продуктів консервованої крові. Ардуан дозволяє зберегти частоту серцебиття плода на колишньому рівні. Для зменшення стресу плода при тривалій іммобілізації доцільно введення: фентанілу 10 мкг/кг із наступним введенням піпекуронія броміду 50-60 мкг/кг на тлі попередньої премедикації матері - гідазепам 40-60 мг всередину; атропін 0,5-0,7 мг в/в; седація пропофолом - за показаннями. Ризик ускладнень, безпосередньо пов'язаних з діагностичними втручаннями при проведенні тільки кордоцентеза, незначно перевищує 1%. При проведенні тривалих внутрішньоматкових втручань - а саме такими є трансфузії - ризик підвищується до 2,6 - 4,0%. Тому ВПК повинні виконувати лікарі, які досконально знають проблему ГХ плода і мають великий особистий досвід проведення інвазивних пренатальних втручань під контролем ехографії. В той же час у досвідчених руках фетальна гемотрансфузія є достатньо безпечною процедурою. Існують деякі особливості застосування фетальних трансфузій у плодів з анемією і набряклою формою ГХ. Набрякла форма ГХ може розвиватися вже протягом II триместру вагітності і в цьому випадку практично 100% таких плодів гинуть антенатально до 30-го тижня вагітності. Водянка плода розвивається при вираженій анемії, коли гемоглобін знижується на 6-7 стандартних відхилень відносно нормативних значень для даного гестаційного віку плода. Тим не менше, навіть при набряку плода показники червоної крові можуть бути успішно кореговані. Однак при проведенні переливання тільки ЕМЗЛТ донора, незважаючи на повну нормалізацію показників крові у плода, набряк зникає після першого переливання лише у однієї третини плодів. Тому був розроблений метод поєднаного переливання плода ЕМЗЛТ 0(I) групи крові резус-негативного донора і 20% розчину альбуміну у співвідношенні 5:1. Така терапія призводить до зникнення вираженого набряку у всіх плодів. При цьому відбувається нормалізація як показників червоної крові, так і вмісту сироваткового альбуміну. Незважаючи на те, що плоди досить толерантні до анемії, з прогресуванням анемії розвивається метаболічний ацидоз і збільшується вміст лактату. Точний механізм розвитку набряку плода залишається до кінця не ясним. Серцева недостатність, що розвивається у 90% плодів, пов'язана з гіпоксичним ураженням міокарда, вносить свій внесок у розвиток набряку, про що свідчить швидке зменшення набряку після трансфузії і нормалізації венозного тиску в пуповині. Нітратна кров має рН 6,98-7,01. Закономірне зниження рН крові після трансфузії виявляється значущим для плода. Встановлено, що всі втрати плодів з набряком були пов'язані саме з ацідемією у плода. Введення гідрокарбонату натрію (2 мл 4%-го розчину) дозволяє утримати рН більше 7,3 і збільшити виживання плодів з водянкою більш ніж в 90% випадків.
Інформування пацієнтки Кожна жінка повинна знати свою групу крові і резус-фактор, а також групу крові і резус-фактор партнера до настання вагітності. Усі жінки з резус-негативною кров'ю мають бути проінформовані про необхідність профілактичного використання в перші 72 години антирезус- імуноглобуліну після пологів, абортів, викиднів, позаматкової вагітності від резус-позитивного партнера. Незважаючи на позитивний ефект профілактики антирезус-імуноглобуліном, небажаним являється штучне переривання вагітності (аборт) зважаючи на ризик імунізації у жінки з резус-негативною кров'ю від партнера з резус-позитивною кров'ю, особливо в термінах більше 7 тижнів вагітності. ДОДАТОК 1 ВЕДЕННЯ Rh-НЕГАТИВНИХ НЕІМУНІЗОВАНИХ ВАГІТНИХ ЖІНОК
ДОДАТОК 2 АЛГОРИТМ ОБСТЕЖЕННЯ ТА ЛІКУВАННЯ Rh-ІЗОІМУНІЗАЦІЇ ТА ГЕМОЛІТИЧНОЇ ХВОРОБИ ПЛОДА І НОВОНАРОДЖЕНОГО
Скорочення: ПСШ - пікова систолічна швидкість; КТГ - кардіотокографія (з 28 тижнів); ГВ - гестаційний вік; СМА - сердня мозкова артерія; ЕМЗЛТ - еритроцитарна маса збіднена на лейкоцити і тромбоцити ДОДАТОК 2 КЛІНІЧНИЙ ПРОТОКОЛ (затверджений наказом МОЗ України від 31.12.2004 року №676) Дата добавления: 2016-06-05 | Просмотры: 640 | Нарушение авторских прав |