|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ИСКУССТВЕННЫЕ ОРГАНЫВВЕДЕНИЕ В КЛИНИЧЕСКУЮ ТРАНСПЛАНТОЛОГИЮ Начиная краткий обзор трансплантологических методов лечения больных, приведем сообщение, датированное 1993 г (Нью-Йорк): "В одной из клиник США проведена уникальная хирургическая операция - пятилетней английской девочке Лоре Дейвис пересадили печень, желудок, почки, поджелудочную железу и часть кишечника. Необходимость в столь сложной операции возникла в связи с тем, что девочка родилась с врожденным пороком органов пищеварения. В июне прошлого года ей пересадили часть кишечника и печень. Однако летом этого года началась реакция отторжения организмом пересаженных органов....". Указанное сообщение показывает, что в настоящее время клиническая трансплантология, опережая самые смелые фантастические мысли, прочно вошла в практику лечения ранее обреченных пациентов. Понятие о трансплантологии как о науке. Трансплантология - это наука о пересадках органов и тканей. Успехи трансплантологии, опирающиеся на достижения современной научно-технической революции, получили признание общественности и практических врачей. Наиболее фко об этом свидетельствует накопленный к настоящему времени опыт пересадок почки, сердца, печени и применения искусственных устройств для поддержания функции жизненно важных органов. При этом аутотрансплантацией считают пересадку собственной ткани (или органа) в другую позицию (например - аутотрансплантация пальцев или кожи). Изотрансплантация предполагает пересадку между двумя генетически идентичными организмами (однояйцевыми близенецами). Подобные операции очень редки. Гомотрансплантация (аллотрансплантация) - это трансплантация органа или ткани от одного человека другому. Гетеротрансплантация (ксенотрансплантация) означает пересадку от животных человеку с применением ксеногенного органа или ткани. Донор - это человек, у которого забирают орган (или ткань) для последующей операции трансплантации. Рецепиент - человек, которому имплантируют донорский орган (или ткань). Донорский орган при трансплантации может быть инплантирован как в ортотопическую (прежнюю) или гетеротопическую (на другое место) позицию. Трансплантология выкристаллизовалась из хирургии и в современном понятии основной деятельностью трансплантологов является хирургическая, но с многими специфическими особенностями, включающими иммунологический подбор рецепиентов и доноров; решение вопросов иммуносупрессии и вторичной инфекции; забора, транспортировки и временной консервации органов и тканей, а также ряд дру. гих важных проблем, в том числе и временного поддержания функции больных до операции (и в последствии трансплантированных после операции) органов при помощи искусственных систем. Создание искусственных органов находится в числе основных направлений современной науки и решается на стыке биологических, медицинских и точных наук. Под искусственными органами принято понимать «устройства, предназначенные для постоянной или временной активной замены функции природного прототипа (В.И.Шумаков, 1990). Необходимость разработки искусственных органов обусловлена возможностью временного замещения утраченной функции природного прототипа, тем более, что хирургическая служба пересадки органов от доноров не может полностью обеспечить каждого больного из-за дефицита самих донорских органов. Последние 20 лет отмечены бурным развитием трансплантолс гии, при этом советские ученые и медики внесли существенный вклад в развитие данной науки. Прежде всего этому способствовало решение технологических задач для создания биологически инертных материалов, способных не изменять своих свойств со временем, не вызывать тромбов и воспалительных реакций. Особое значение в решении указанной задачи сыграла разработка экспресс-методов оценки гемосовместимости, токсичности и других качественных характеристик полимеров. Значительное значение в развитии науки об искусственных органах имели разработки в области вспомогательного кровообращения, создания различных моделей искусственного сердца; совершенствовании биологических и полимерно-металлических конструкций клапанов сердца; новых моделей дозаторов лекарственных веществ и электростимуляторов; разработку и серийный выпуск фракционаторов крови, гибридных перфузионных систем и совершенствование устройств для детоксикации и модификации крови (гемосорбции, обменного гравитационного и фильтрационного плазмафереза, ультрафильтрации и гемодиализа). Все это позволило оценить данное направление медицинской науки как приорететное и требующее дальнейших изысканий. История трансплантологии и роль отечественных ученых. История трансплантологии насчитывает многовековой период. Еще в Аюрведе (древнем индийском трактате о способах лечения) имеется упоминание в факте пересадки нижней конечности от негра белому человеку. Данное сообщение свидетельствует о необычайной смелости врачей-хирургов и о том, что уже в древние времена мысли о возможной замене больного органа на здоровый занимали умы медиков. История научной трансплантологии началась в XIX веке. Многие десятилетия эта наука плодотворно развивалась в рамках хирургии. Наибольший вклад в развитие трансплантологии внесли хирурги, особенно из тех, кто занимался восстановительной и пластической хирургией. К числу таких исследователей и клиницистов относят Эриха Лексера. В частности, данный хирург занимался вопросами свободной пересадки костей от трупа больным пациентам и разрабатывал методы аллотрансплантации суставов. В 1907 году в Кенигсберге Лексер выполнил первую в мире успешную клиническую аллотрансплантацию сустава. Лексер занимался также трансплантациями сосудов, а именно вен; а также сухожилий; фасций и жировой ткани. В периоде 1914-1924 он издал 2-томное руководство "Свободные трансплантации". Это издание долгие годы было на вооружении трансплантологов и хирургов. Русский ученый профессор С.В. Шамов не без оснований называл переливание крови пересадкой крови. Ведь действительно, в данном случае ткань одного человека (кровь) вводится другому, то есть имеет место гомологическая трансплантация. Основные положения теории трансплантационного иммунитета разработал наш соотечественник И.И.Мечников. В 1929 году видный русский ученый С.С.Брюхоненко на съезде патофизиологов впервые в мире демонстрировал аппарат («автожектор»), предназначенный для оксигенации и нагнетания крови. При этом изолированная от туловища голова собаки, перфузируемая согретой и оксигенированной кровью сохраняла рефлексы, лакала воду и пыталась лаять. Для того времени это был гигантский скачок вперед, позволивший создать в скором времени аппараты для искусственного кровообращения и по сути дела открыть этап операций на "сухом" сердце. Нельзя не вспомнить о великом исследователе и экспериментаторе, нашем современнике В.П. Демихове, работы которого по пересадке сердца, комплекса "сердце-легкие", создании банка органов, аортокоронарном шунтировании, а также гемикорпорэктомии с последующей трансплантацией туловища являются классикой в трансплантологии. Полученные отечественным ученым результаты послужили путеводной вехой клинической пересадки указанных органов. В.П. Демиховым еще в 1960 г показана принципиальная возможность поддержания кровообращения в организме животного с помощью механического устройства, имплантированного на место удаленного собственного сердца. После такой операции собака жила в течение 2,5 часов. Хирург Барнард (ЮАР), впервые выполнивший клиническую пересадку сердца, и другие видные исследователи считали В.П. Демихова своим учителем. Первую в мире клиническую пересадку почки выполнил в Киеве в апреле 1933 года отечественный хирург Ю.Ю.Вороной. Почку от трупа в 1965 году первым в Союзе пересадил академик Б.В.Петровский. Все изложенное выше свидетельствует о большом пути, пройденном экспериментальной и клинической трансплантологией, о вкладе многих и многих исследователей и о существенной роли отечественных ученых в развитие науки о методах пересадки органов и тканей. К настоящему времени уже сделано большое число самых разных трансплантаций, позволивших спасти жизнь и улучшить ее качество многим тысячам больных. В таблицах 1 и 2 приведена сводная статистика о числе и результатах данных операций.
Таблица2 Рекорды международной выживаемости трансплантатов (1992 г)
Приведенные в таблицах 1 и 2 данные убедительно свидетельствуют о возрастающем интересе хирургов к трансплантологиии о существенном позитивном вкладе данной науки в сохранении жизни и здоровья населения планеты. Забор органов, проблема "смерти мозга", иммуносупрессия. В числе ведущих медико-биологических "нехирургических" проблем в трансплантологии находятся проблемы, связанные со смертью мозга, сроками и способами забора органов и тканей, иммунологическим подбором пары "донор-рецепиент" и последующей иммунологической супрессией. Необходимо отметить, что имеются определенные ограничения забора органов со стороны доноров. При отсутствии таковых донорами могут быть люди, в возрасте от 5 до 50 лет. К ним относятся: • Изолированная черепно-мозговая травма. • Разрыв аневризмы сосудов головного мозга. • Некоторые заболевания головного мозга. • Суицидные попытки. • Отравление барбитуратами. При этом доноры не должны страдать хроническими органическими заболеваниями жизненно важных органов или инфекционной патологией. Не вдаваясь глубоко в данные проблемы, отметим, что термин "смерть мозга" является не только медицинским, но и общефилософским понятием. Вплоть до недавнего времени (до 1993 г) советские трансплантологи не имели юридической базы для изъятия органов у больных при гибели коры головного мозга и работающем сердце. Это создавало целый ряд серьезных препятствий для пересадки сердца, легкого, почки и печени. В самом деле, ранее считали, что если бьется сердце, то человек жив и изымать его органы - это преступление. В настоящее время в большинстве развитых стран мира принято, что в тех ситуациях, когда зафиксирована гибель коры головного мозга и неблагоприятный прогноз становится ясным, возможно использовать функционирующие органы больного для спасения жизни других людей. В настоящее время критериями смерти мозга считают прямую линию на энцефалограмме; отрицательные атропиновый тест и тест с насыщением крови кислородом; отсутствие нистагма при раздражении слухового канала водой. Данные положения совпадают с международными требованиями и защищены соответствующим законодательством. В России органное донорство регулируется двумя законами - Законом «О трансплантации органов и (или) тканей человека», принятом 22 декабря 1992 г.. и Законом «О погребении и похоронном деле», принятом 8 декабря 1995 г. В совокупности они допускают изъятие органов у трупов при согласии родственников или их законных представителей или при их отсутствии, как это бывает при гибели неизвестных лиц. В специализированных учреждениях имеются функциональные подразделения, ответственные за выявление, типирование и забор органов - так называемые центры забора. Центры являются координационной структурой, определяющей и реализующей тактику получения донорских трансплантатов с их иммунологической селекцией и распределением на основе "листа ожидания". Такие центры обладают опытом обмена донорскими органами подобными структурами в США, Израиле, Германии, Англии и других странах. Вся работа в них ведется в режиме круглосуточного дежурства, а сами трансплантологические операции носят характер экстренных, ввиду ограниченных временных сроков хранения донорских органов. Современная схема забора органов предусматривает следующее: оповещение о больном со смертью мозга; экспресс обследование на месте бригадой трансплантологов и изъятие на месте (почка) или транспортировку донора в трансплантологический центр (сердце, легкие и др). Как правило, стараются применить схему полиорганного забора (рис.1) с последующим типированием иммунологических показателей и оповещением нескольких подходящих рецепиентов, находящихся в листе ожидания.
При отсутствии таких больных в известность ставят другие трансплантологические центры у нас в стране и за рубежом. При этом очень важен фактор времени, так как результаты пересадок существенно зависят от сроков ишемии и консервации донорских органов. В настоящее время подбор донора осуществляется по двум основным системам антигенов: АВО (антигены эритроцитов) и HLA (антигены лейкоцитов или антигены гистосовместимости). Иммуносупрессивная терапия после трансплантации - это основа консервативного лечения. При подавлении трансплантологического иммунитета длительное время использовали гормоны - преднизолон и стероидные препараты. Разработки последних 20 лет позволили внедрить новые фармакологические средства, супрессивное действие которых существенно выше, а побочные эффекты (цитотоксичность, гормональные язвы, артериальная гипертензия, сепсис) ниже. Таким препаратом, например, является циклоспорин "А", созданный фирмой "Сандос" (Швейцария). По структуре - это метаболит некоторых низших грибов, обладающий иммунодепрессивным действием без миелотоксичных реакций. Циклоспорин "А" предотвращает распознавание антигена лимфоцитами, которые не превращаются в цитотоксичные киллеры. Введение в 80-х годах в клиническую практику данного препарата имело революционный характер и почти повсеместно увеличило выживаемость трансплантатов на 15-20%. Однако к настоящему времени выявлены и отрицательные побочные действия циклоспорина "А" - гепато- и нефротоксичность, а также увеличение частоты вирусных инфекций у рецепиентов. Следует отметить, что применение циклоспорина "А " мало повлияло на лечение кризов отторжения - самых опасных иммунологических состояний, обусловленных несовместимостью антигенных структур пары "донор-рецепиент". В данном случае применяют моноклональные антитела, стероидные гормоны, антимоноцитарный глобулин и обменный плазмаферез. К другим фармакологическим препаратам, подавляющим трансплантационный иммунитет являются азатиоприн, ортоклон и антилимфоцитарные сыворотки. Изложенное свидетельствует о значительной специфике лечения трансплантологических больных, что требует специальных многопрофильных знаний. Помимо чисто хирургических причин неблагоприятных исходов (кровотечения; несостоятельность соустий, интраоперационная эмболия, сердечная слабость, травматический шок и другие) в трансплантологии, наиболее частыми осложнениями являются острое отторжение органа; нежизнеспособность трансплантата; сепсис; сердечно-сосудистая недостаточность и синдром взаимного отягощения с нарушением функции нескольких жизненноважных органов.
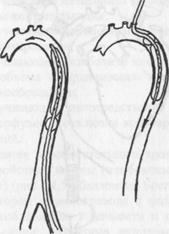
Частная трансплантология С е р д ц е. В эксперименте первую пересадку сердца, как указывалось ранее, осуществил отечественный ученый, хирург-трансплантолог В.П.Демихов в 50-х годах. Пересадка сердца у больного впервые выполнена К.Барнардом из ЮАР (1967 г). Пациент после операции прожил 16 суток. С этой поры открыта новая важная веха лечения больных с необратимыми и несовместимыми с жизнью нарушениями структуры и функции сердца. В СССР первая трансплантация сердца сделана А.В.Вишневским (больной после операции прожил 33 часа). Успешная пересадка сердца осуществлена академиком РАН профессором В.И.Шумаковым в 1986 году. Всего за период с 1986 по 2001 год только в НИИ трансплантологии и искусственных органов РАМН выполнено 99 пересадок этого органа. Данные операции проведены также в ВНЦХ РАМН, а также в Вильнюсе. Таким образом, можно уже говорить о завершении этапа отработок и о запуске их "на поток". Показаниями к ортотопической трансплантации сердца считают тяжелую хроническую недостаточность кровообращения, резистентную к медикаментозной терапии (дилатационная кардиомиопатия; ИБС и др.). Противопоказаниями к данной операции считают легочную гипертензию выше 50 мм рт.ст.; хронические заболевания почек; печени; желудочно-кишечные заболевания; болезни периферических сосудов и крови, а также злокачественные опухоли. Забор сердца может быть дистанционный (в лечебном учреждении, где находится донор) или в учреждении, где планируется операция пересадки. В ряде ситуаций перед пересадкой сердца используют разные варианты подключения вспомогательного кровообращения или искусственного имплантируемого сердца в целях продления жизни рецепиенту и для поиска необходимого донорского сердца. Основными осложнениями после пересадки сердца являются острая (чаще правожелудочковая) сердечная недостаточность и острые кризы отторжения. Частота инфекционных осложнений достигает 12-16%. Пересадка сердца осуществляется в ортотопическую позицию. В нашей стране к настоящему времени успешных пересадок комплекса "сердце-легкие" в настоящее время нет. Показаниями к данной операции служат грубые, несовместимые с жизнью сочетанные поражения сердца и легких. Почка. Пересадку почки на заре развития метода начинали осуществлять от живых родственников. В последующем (и по настоящее время) применять стали пересадку трупной почки с давностью тепловой ишемии не более суток. Из истории вопроса о пересадке почки известно, что первую пересадку этого органа в эксперименте выполнена Каррелем и Ульманом (1902). В 1934 году отечественным хирургом Вороным сделана первая попытка трансплантации почки больной при острой почечной недостаточности. В 1953 г Хьюм сделал первую в мире успешную клиническую трансплантацию почки от родственного донора. В настоящее время в России ежегодно почку пересаживают около 700 пациентов (в странах Европы - около 10000). К настоящему времени наиболее перспективна пересадка почки, которую забрали в процессе мультиорганного забора при смерти мозга. Пересадка почки - наиболее разработанный аспект проблемы клинической трансплантологии. Как свидетельствует табл. 1 и табл.2 сейчас имеются тысячи больных с пересаженными почками, у которых сроки выживания трансплантатов вполне удовлетворительны. В техническом отношении современное решение места пересадки почки - это пересадка к внутренним подвздошным сосудам с анастомозом мочеточника и мочевого пузыря. По числу реимплантаций к настоящему времени есть пациенты с 3-5 пересадками почек. Следует помнить, что до 40-50% почечных трансплантатов гибнет в течение 1-го года после операции. Показаниями к пересадке почки в настоящее время считают терминальную стадию хронической почечной недостаточности (ХПН) разной причины (хронический гломерулонефрит, хронический пиелонефрит, поликистоз почек, мочекаменную болезнь с исходом в гидронефроз и др.). Следует отметить, что трансплантацию почки осуществляют в гетеротопическую позицию на подвздошные сосуды. Печень. Первая ортотопическая пересадка печени осуществлена профессором Старлзом в 1963 году. В СССР первую ортотопическую трансплантацию печени выполнили в 1990 году больной с гепатоцеллюлярным раком печени. Из показаний к пересадке данного органа наибольшую группу составляют пациенты с циррозом и раком печени. Операция по срокам составляет 12-16 часов. Объем гемотрансфузий за время операции и после нее может достигать 12-15 литров крови при общем объеме трансфузий - до 30 литров. В периоде операции, наряду с чисто хирургическими задачами, решаются проблемы вено-венозного перфузионного обхода печени (рис.2), трансфузиологии и анестезиологического пособия.
ß Рис.2. Схема перфузионного обхода печение при ее пересадке. Показаниями к пересадке печени являются цирроз, первичный рак печени, склерозирующии холангит, атрезия желчевыводящих путей и другие заболевания. Абсолютным противопоказанием к пересадке печени считают сепсис вне билиарной системы; метастатические поражения вне печени; активный алкоголизм; выраженную гипоксию; несогласие больного или родственников на операцию; прогрессирующие сердечно-легочные заболевания; СПИД. При этом основную группу рецепиентов составляют больные с циррозом и с раком печени. Поджелудочная железа. Если хирургические аспекты пересадки сердца, комплекса сердце-легкие; почки и печени уже решены, то нельзя сказать то же самое о пересадке поджелудочной железы. Первую пересадку этого органы выполнили в 1966 году Келли и Лиллехай. К настоящему времени в мире осуществлено свыше 10000 трансплантаций. При этом возможны как ортотопическая (с сохранением экзокринной функции), так и гетеротопическая (с прекращением экзокринной функции) железы. В ряде случаев используют пломбировку протоков полимеризующимися смесями. Наиболее перспективна пересадка железы с анастомозом площадки 12-перстной кишки с большим дуоденальным сосочком - с одной стороны, и кишечником или мочевым пузырем - с другой. Нерешенными до конца следует считать проблемы трансплантации желудка, кишечника, легких, эндокринных органов, а также нескольких жизненноважных органов. Достаточно перспективным считают трансплантации клеточных структур и тканей (костного мозга, островкового аппарата поджелудочной железы, печени, надпочечников, селезенки и др.). ИСКУССТВЕННЫЕ ОРГАНЫ Полимеры медицинского назначения. В конце 70-х годов, в связи с широким внедрением в практику здравоохранения аппаратов для искусственного кровообращения и гемодиализа, а также имплантируемых устройств, резко возросло число публикаций, посвященных разработке и исследованию гемосовместимых полимеров и заданным комплексом физико-химических и медико-биологических свойств. Необходимость в полимерных материалах медицинского назначения подтверждается данными долгосрочного прогнозирования использования искусственных органов в мире в 1990 г, по сравнению с 1980 г, сделанном департаментом науки и техники Японии. Так, потребность в биоматериалах возрасла для изготовления костей и суставов - в 1,3 раза; кровеносных сосудов - в 3,2; аппаратов "сердце-легкие" - в 2,3; клапанов сердца - в 3,0; водителей ритма сердца - в 1,5; искусственных почек - в 2,2; аппаратов вспомогательного кровообращения (искусственный желудочек сердца) - в 3,3 раза. В среднем предполагаемый ежегодный прирост производства изделий для сердечно-сосудистой хирургии до 1990 года составит 10-15%. Таким образом, важность данного аспекта и его перспектива в трансплантологии сомнению не подлежит. Искусственное сердце. Концепция замещения функции сердца механическим аналогом не нова. Еще в 1812 году la Gallois заметил, что если удастся заместить сердце каким-либо насосом крови, то можно успешно сохранить живой любую часть тела. Первые успешные экспериментальные исследования по имплантируемому сердцу выпонены W.Kolff (1980). Полученные результаты позволили считать, что метод замены собственного сердца искусственным, как временная мера, может быть применен в клинике. К настоящему времени в мире проведено свыше 50 операций в клинике, где имплантация искусственного сердца явилась временной мерой для сохранения жизни пациенту. В 1/3 клинических наблюдений имплантация искусственного сердца была первым этапом операции с последующей заменой насоса трансплантатом. Вспомогательное кровообращение. В лечении острой сердечной недостаточности различного генеза, которая резистента к применению фармакологических препаратов большое значение придают методам вспомогательного кровообращения. Поскольку основным воздействием вспомогательного кровообращения является влияние его на метаболизм сердечной мышцы, этот показатель и положен в основу классификации методов вспомогательного кровообращения: 1- методы, улучшающие метаболизм миокарда за счет снижения постнагрузки - методы контрпульсации; 2- методы, улучшающие метаболизм за счет уменьшения преднагрузки - методы шунтирования; 3- методы, улучшающие метаболизм за счет уменьшения конечно-диастолического объема - кардиомассаж и внутрижелудочковое вспомогательное кровообращение; 4 - методы, улучшающие непосредственно коронарную перфузию - ретроградная перфузия и окклюзия коронарного синуса, перфузия коронарных артерий.
Рис.4. Возможные локализации подключения искусственных желудочков сердца для вспомогательного кровообращения.
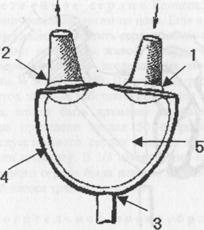
ß Рис.5. Разрез искусственного желудочка сердца:1-клапан входа крови; 2-клапан выхода крови; 3-пневмопривод; 4-камера крови; 5-воздушная камера.
Рис.6. Места введения баллончика Брегмана для вспомогательного кровообращения. Для вспомогательного кровообращения могут использоваться также имплантируемые системы как полностью автономные, так и частично автономные. Применение искусственной оксигенации крови при гипоксиях, в частности при критических состояниях различного генеза, является чрезвычайно важной проблемой медицины. Лечение острой гипоксии чаще всего связывают с различными режимами искусственной вентиляции (ИВЛ) легких (собственно говоря их протезированием), реже - с применением гипербарической оксигенации. Однако, в ряде клинических ситуаций использование указанных методов явно недостаточно. В случае острой дыхательной недостаточности применяют внелегочные пути и устройства для экстракорпоральной оксигенации крови - чаще речь идет о м е м б р энной оксигенации. Принцип действия данных приборов заключается в использовании полунепроницаемых мембран, с одной стороны которых протекает кровь, с другой - подается газ под давлением. При этом кислород диффундирует в кровь, а из крови элиминируется углекислая кислота. Оксигенация не менее 1/3 минутного выброса сердца с помощью этого экстракорпорального устройства, подключенного к периферическим сосудам, позволяет заместить на время до 3-х суток оксигенирующую функцию легких. В этом периоде возможно провести ряд мер интенсивного лечения больных и добиться успеха. Мембранные оксигенаторы могут быть применены также при операциях на открытом сердце в сочетании с искусственным кровообращением. В данном случае они более предпочтительтны (особенно при длительных перфузиях) перед другими конструкциями оксигенаторов - пузырьковыми; пено-пленочными и др. Важным направлением клинического применения мембранных оксиненаторов служат гибридные перфузионные системы и изолированные перфузии цельных органов, например селезенки. В случае поражения функции печени и почек применяют искусственные перфузионные системы, временно замещающие функцию жизненноважных органов типа гибридных систем (с применением живых изолированных гепатоцитов) (Рис.7,8); гемосорбции и обменного плазмафереза; гемодиализа. Принцип действия этих устройств различен, тем не менее из организма при помощи указанных устройств удается вывести токсичные и балластные субстанции и тем самым обеспечить условия жизни пациенту. При наличии у больного некорригируемого инсулином сахарного диабета могут быть использованы: подсадка клеток инсулярного аппарата, выделенных или полученных при культивации; аппарат типа "Биостатор" с обратной связью для коррекции в реальном режиме времени уровня сахара в крови; паракорпоральные и имплантируемые дозаторы инсулина. Таким образом, приведенные данные о результатах многих медикотехнических и клинических проблем науки о трансплантологии и искусственных органах убедительно свидетельствуют о успехах лечения самых тяжелых больных различного профиля, а также о множестве имеющихся нерешенных проблем. Все это диктует необходимость поиска решений и развития данной науки. Дата добавления: 2015-02-06 | Просмотры: 2683 | Нарушение авторских прав |
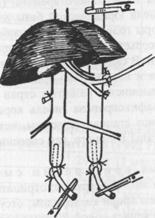 ßРис. 1. Схема мультиорганного забора органов.
ßРис. 1. Схема мультиорганного забора органов.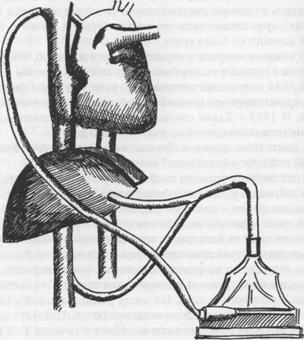
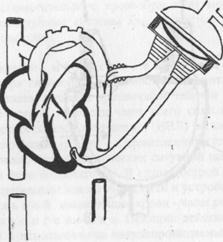
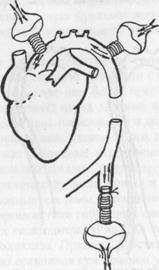 Для использования вспомогательного кровообращения применяют различные устройства - насосы (мембранные, роликовые, желудочковые; турбинные) (рис.3.4,5); баллончик Брегмана (рис.6.) с датаскопом - синхронизатором пневмопривода с фазами работы сердца; пластиковые приспособления на конечности и грудную клетку при наружней контрпульсации; различные катетеры с окклюзионными манжетками и устройством для оксигенации крови и т.д.
Для использования вспомогательного кровообращения применяют различные устройства - насосы (мембранные, роликовые, желудочковые; турбинные) (рис.3.4,5); баллончик Брегмана (рис.6.) с датаскопом - синхронизатором пневмопривода с фазами работы сердца; пластиковые приспособления на конечности и грудную клетку при наружней контрпульсации; различные катетеры с окклюзионными манжетками и устройством для оксигенации крови и т.д.
 ßРис.3. Вспомогательное кровообращение с применением искусственного желудочка сердца.
ßРис.3. Вспомогательное кровообращение с применением искусственного желудочка сердца.