|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Государственное санитарно-эпидемиологическое нормированиеК болезням экспансии относятся наследственные заболевания, обусловленные динамическими мутациями. В основе динамических мутаций лежит нестабильность микро- и минисателлитных повторов ДНК, локализованных в значимых областях генов. При болезнях экспансии наблюдается превышение (экспансия) определенного порогового уровня числа повторяющихся элементов в месте локализации динамической мутации. Подобные экспансии сопровождаются нарушениями работы гена, причем конкретные механизмы этих нарушении различны для разных типов динамических мутаций. Различия определяются, главным образом, двумя факторами: функциональной значимостью того участка гена, где расположен нестабильный повтор, а также характером и функциями самого повтора. В настоящее время насчитывается более 20 болезней экспансии, подавляющее большинство из них связаны с экспансией тринуклеотидных повторов. Это синдром Мартина-Белл (синдром фрагильной или ломкой Х-хромосомы), миотоническая дистрофия, атаксия Фридрейха, целая серия спиноцеребеллярных атаксий, хорея Гентингтона и ряд других. Болезни экспансии могут быть аутосомными или Х-сцепленными в зависимости от локализации мутантного гена. Механизмы патогенетического действия динамических мутаций зависят от расположения и специфики экспансированного повтора, а тяжесть течения заболевания определяется длиной экспансии (числом повторов). При тяжелых формах заболевания идентифицируются более длинные повторы. Практически для всех заболеваний, обусловленных динамическими мутациями, характерно поражение головного мозга и особенно подкорковых структур. Поэтому болезни экспансии представляют особую значимость для неврологии. Однако клиническая картина при различных болезнях экспансии достаточно разнообразна. Болезни экспансии имеют много общих особенностей, касающихся не только клинической картины поражения, но механизмов возникновения динамических мутаций, а также молекулярных и биохимических основ патогенеза этих заболеваний. Для многих болезней экспансии характерны следующие особенности наследования (1) доминантный или полудоминантный характер, (2) антиципация - нарастание тяжести течения заболевания в ряду поколений и (3) геномный импринтинг. Дифференциальный характер поражения при разных болезнях экспансии, в первую очередь, определяется функциями белков, являющихся первичными биохимическими дефектами, а также различиями в тканеспецифической экспрессии соответствующих генов. Остановимся более подробно на некоторых из этих заболеваний. Синдром Мартина-Белл Впервые динамические мутации были идентифицированы в гене FRAXA, мутантном при синдроме Мартина-Белл или синдроме ломкой (фрагильной) Х-хромосомы. В клинической картине этого сцепленного с полом заболевания ведущим симптомом является интеллектуальный дефект различной степени выраженности (IQ 13-75) в сочетании с поведенческими, лицевыми и соматическими аномалиями. У большинства больных встречаются психопатические и речевые нарушения в виде двигательной расторможенности, признаков аутизма, персевераций, эхола-лии. В 10-15% случаев наблюдается судорожный синдром. В соматическом статусе пациентов с синдромом Мартина-Белл нередко отмечаются долихоцефалия, макроцефалия, выступающий лоб, удлиненное лицо, крупные, выступающие («оттопыренные») ушные раковины, эпикант, светлые радужки, нос с клювовидным кончиком, массивный подбородок, крупные кисти и стопы, гипермобильность суставов, макроорхизм. Последний признак, особенно четко выявляемый в постпубертатном периоде, является высокоинформативным симптомом и наряду с умственной отсталостью входит в «фенотипическое ядро» синдрома. Синдром описан в 1943 году J. Martin и J. Bell. Наиболее существенным в изучении этиологии этого заболевания явилось цитогенетическое исследование. При культивировании лимфоцитов больных мужчин в среде, лишенной фолата, в них обнаруживаются цитогенетические изменения в виде перетяжек района 27-28 длинного плеча Х-хромосомы. Данный цитогенетический феномен получил название фрагильности (ломкости) Х-хромосомы, и он служит цитогенетическим маркером заболевания - marXq28. Распространенность синдрома Мартина-Белл в общей популяции составляет 1:2000 среди лиц мужского пола, то есть это вторая по встречаемости форма умственной отсталости после синдрома Дауна. Для синдрома Мартина-Белл характерны варьирующая экспрессивность, неполная пенетрантность и полудоминантный характер наследования. В ряде семей прослежена передача мутантного аллеля через мужчин, так называемых нормальных трансмиттеров, не имеющих выраженных клинических признаков болезни или имеющих очень стертые формы неспецифической умственной отсталости. Они составляют 20% среди мужчин, несущих мутантный аллель в гене FRAXA (иногда его обозначают как FMR1).
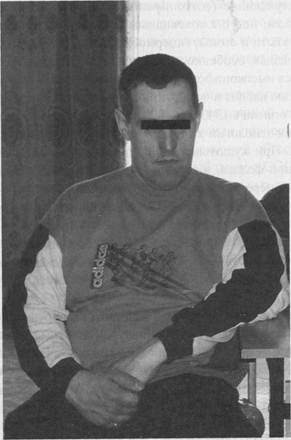
Рисунок 5. Больной синдромом Мартина-Белл. У 85% матерей больных детей IQ не превышает 85, причем уровень снижения интеллекта коррелирует с экспрессией цитогенетического маркера заболевания (marXq28). У 40% облигатных гетерозигот наблюдаются типичные лицевые особенности, более выраженные у взрослых, чем у детей, а также неровные зубы и гипермобильность суставов пальцев. При этом гетерозиготные женщины, получившие мутантный аллель от фенотипически нормального отца-трансмиттера, всегда интеллектуально сохранны. В первичных культурах лимфоцитов таких женщин отсутствуют клетки с фрагильными сайтами или имеется очень небольшой их процент. В отличие от этого, у больных мальчиков следующего поколения интеллект значительно снижен, и количество лимфоцитов с перетяжками в области Xq27-28, в среднем, составляет 29%. Третья особенность наследования синдрома Мартина-Белл заключается в геномном импринтинге, следствием которого является антиципация заболевания при прохождении мутантного аллеля через женский гаметогенез. Эти особенности наследования заболевания получили название парадокса Шермана. Открытие в начале 90-х годов гена, ответственного за синдром Мартина-Белл (FRAX), и расшифровка молекулярной природы идентифицированных у больных мутаций позволили полностью объяснить парадокс Шермана. Оказалось, что в промоторной области гена FRAX расположен нестабильный тринуклеотидный повтор CGG. В норме количество CGG-триплетов не превышает 40. У больных это число может увеличиваться до 1000, причем, как правило, увеличение происходит в два этапа. Сначала появляется аллель с числом повторов в диапазоне от 40 до 50 - премутация, который чаще всего и присутствует у нормальных трансмиттеров. При прохождении этого нестабильного повтора через оогенез может происходить дальнейшее достаточно резкое нарастание числа CGG-копий с образованием мутации. При экспансии CGG-повтора наблюдается различная степень метилирования промотора гена FRAX, что и приводит к снижению уровня его транскрипции. У пациентов с мягкими формами заболевания наблюдается мозаицизм по метилированию промоторной области гена. Мутантный аллель, по-видимому, неметилирован у нормальных мужчин-трансмиттеров, метилирован только в неактивной Х-хромосоме у их дочерей и полностью метилирован у большинства больных сыновей этих дочерей. У некоторых из них наблюдается мозаичная картина по характеру метилирования. Миотоническая дистрофия Вскоре вслед за тем, как была расшифрована природа молекулярного дефекта при синдроме Мартина-Белл, было показано, что в основе развития миотонической дистрофии лежит другая динамическая мутация - экспансия CTG-повтора, локализованного в З'-нетранслируемой области гена DM. Клиническая картина миотонической дистрофии представляет собой сочетание миотонии, миопатии, сердечно-сосудистых нарушений и эндокринно-вегетативных расстройств. Болезнь дебютирует иногда в детском возрасте, но чаще во втором-третьем десятилетии жизни признаками миотонического спазма и затруднений в разгибании пальцев рук при резких движениях. Течение болезни неуклонно прогрессирующее. На фоне усиливающегося миотонического синдрома развивается мышечная слабость и атрофические проявления, сходные с миопатиями. Первыми слабеют мышцы лица, особенно круговая мышца глаз, века, жевательные мышцы. А также сгибатели шеи и некоторые мышцы конечностей. Слабость и атрофии мышц возникают одновременно. Глубокие рефлексы постепенно снижаются и в дальнейшем угасают. Типичны катаракты и различная степень интеллектуальной недостаточности. В разных популяциях заболевание встречается с частотой 1 на 8-40 тысяч, наследуется по аутосомно-доминантному типу. Во многих семьях наблюдается антиципация как по дебюту, так и по тяжести течения. Мужчины болеют в 3 раза чаще, чем женщины. Ген DM расположен в области 19ql3.2-3. CTG-повтор в 3?-нетранслируемой области гена DM отличается крайней нестабильностью. В норме число триплетов варьирует в пределах от 5 до 30-37. У больных миотонической дистрофией количество CTG-триплетов значительно больше и составляет не менее 50 при наиболее мягких формах болезни, от 100 до 1000 у пациентов с классическим течением и дебютом во взрослом возрасте, в то время как при врожденных формах заболевания оно может достигать 3000. Начальным шагом, предрасполагающим к мутационному событию, является увеличение числа CTG-повторов от 5 до 19-30. Частота этого гетерогенного класса повторов в популяции достигает 10%, и, по-видимому, эти аллели составляют резерв для повторного мутирования. Аллели, связанные с относительно небольшими экспансиями обладают высокой мейотической нестабильностью, что и объясняет наблюдаемую антиципацию. Наиболее вероятным патогенетическим механизмом миотонической дистрофии является локальное нарушение структуры хроматина в области локализации удлиненного CTG-повтора, которое может приводить к инактивации не только гена DM, но и, возможно нескольких других соседних генов. Не исключено, что именно с этим связан высокий плейотропизм заболевания - одновременное вовлечение в патологический процесс нескольких систем. Государственное санитарно-эпидемиологическое нормирование Дата добавления: 2014-11-24 | Просмотры: 919 | Нарушение авторских прав |