|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ФИЗИОЛОГИЯ РАСТИТЕЛЬНОЙ КЛЕТКИ
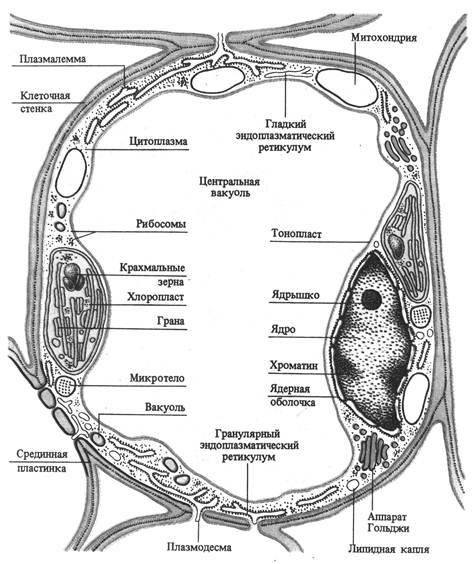
Все клетки обладают такими свойствами живого как способность к самовоспроизведению, метаболизм (обмен веществ), раздражимость, рост, изменчивость и адаптация к внешней среде. Однако надо учитывать, что каждая клетка многоклеточного организма находится в тесном взаимодействии с другими клетками и что организм - это единое целое, а не сумма клеток. Клетка обладает сложной структурной организацией и представляет собой систему, дифференцированную на отдельные органеллы. Растительная клетка имеет клеточную стенку и протопласт. Протопласт состоит из ядра с ядрышком, цитоплазмы и включенных в нее мембранных (вакуоль, пластиды, митохондрии, аппарат Гольджи, лизосомы, эндоплазматический ретикулум) и немембранных (микротрубочки, рибосомы) органелл. Все органеллы погружены в матрикс цитоплазмы - гиалоплазму или основную плазму (рис. 2.1).
Рис. 2.1. Схема строения клетки мезофилла листа (по В. В. Полевому). Все окруженные полупроницаемой мембраной компоненты клетки представляют собой замкнутые образования, в которых происходят разнообразные биохимические реакции. Цитоплазматический матрикс также разделен на отсеки эндоплазматической сетью. Тем самым достигается дополнительное пространственное разделение (компартментализация). Основные физиологические функции структурных компонентов клетки: клеточная стенка - обеспечение прочности, защита, опорная функция; плазмалемма - транспорт веществ из и внутрь клетки, защита, рецепция; ядро - хранение и передача генетической информации; ядрышко - синтез РНК; вакуоль - осморегуляция, запасание веществ, переваривание; основная плазма - гликолиз; митохондрии - дыхание; хлоропласты – фотосинтез; аппарат Гольджи - секреция, образование компонентов клеточной стенки; эндоплазматическая ретикулум - транспорт веществ в клетке; лизосомы - внутриклеточное пищеварение; сферосомы - накопление и хранение жира; микротела (пероксисомы, глиоксисомы) - фотодыхание, глиоксалатный цикл; микротрубочки - ориентация микрофибрилл целлюлозы; рибосомы - синтез белка.
2.1. Раздражимость
Это способность клетки реагировать на действие внешних и внутренних факторов – раздражителей и передавать возбуждение в другие клетки. Восприятие раздражения обозначают термином перцепция или рецепция. У растений нет органов чувств, но есть рецепторные белки и клетки, воспринимающие разные воздействия. Различают фото-, хемо- и механорецепторы. Возбуждение представляет собой измененное состояние клетки. В отсутствие раздражения растительная клетка имеет отрицательный потенциал покоя от -50 до -200 мВ, то есть протоплазма заряжена отрицательно по отношению к наружной поверхности. Это связано с тем. что внутри клетки находится больше ионов хлора и калия, но меньше ионов кальция, чем снаружи. В ответ на раздражение возникает потенциал противоположного знака - потенциал действия, который может распространяться и на время сравняться или превысить потенциал покоя. Потенциал действия образуется в результате выхода ионов хлора из клетки и поступления ионов кальция в клетку. Раздражение воспринимается клеткой, если его сила превышает пороговую величину. Следующие друг за другом подпороговые раздражения могут суммироваться, если интервалы между ними незначительны. Минимальное время, необходимое для рецепции, называют временем презентации. Установлены следующие законы раздражимости: 1. Закон силы раздражения: чем больше раздражение, тем сильнее ответная реакция. 2. Закон длительности раздражения: чем длительнее раздражение, тем сильнее ответная реакция. 3. Закон количества раздражения: чем больше сила раздражения, тем меньше время презентации. 4. Закон градиента раздражения: чем выше скорость нарастания силы раздражителя, тем больше ответная реакция. При действии чрезмерно сильных и (или) длительных воздействий чувствительность клеток к раздражителю снижается и клетки могут погибнуть. Реституция - это восстановление исходного состояния после раздражения. Она идет с затратой энергии и тормозится под действием наркотиков, ингибиторов дыхания, при недостатке кислорода и снижении температуры. Во время реституции клетки находятся в рефрактерном периоде, когда новое раздражение не вызывает возбуждения.
2.2. Репликация, транскрипция и трансляция
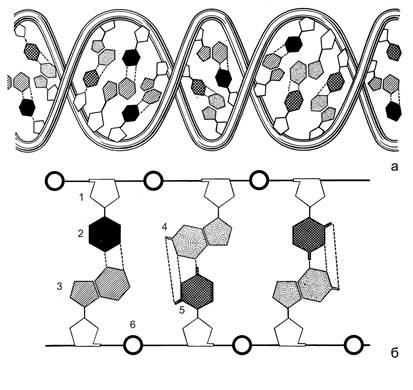
Хранение наследственной информации осуществляется дезоксирибонуклеиновой кислотой (ДНК). ДНК - это полимер, мономерами которого являются дезоксирибонуклеотиды. В их состав входят углевод 2-дезокси-b-D-рибоза, остаток фосфорной кислоты и азотистые основания четырех типов: два пуриновых - аденин и гуанин, и два пиримидиновых - тимин и цитозин. Молекула ДНК состоит из двух полинуклеотидных цепочек, скрепленных между собой водородными связями между азотистыми основаниями. Полинуклеотидная цепочка образована чередующимися остатками 2-дезокси-b-D-рибозы и фосфорной кислоты, которая присоединена к 5 атому углерода кольца углевода с одной стороны и к 3 атому с другой стороны. Азотистые основания ответвляются от цепочки, присоединяясь к 1 атому углерода кольца углевода. Азотистые основания, противостоящие друг другу в полинуклеотидных цепочках, комплементарны друг другу: пуриновому основанию соответствует пиримидиновое (аденину – тимин, гуанину – цитозин). У каждой цепочки молекулы ДНК один конец заканчивается пятым (фосфатным), а другой - третьим (гидроксильным) углеродным атомом углевода. Они обозначаются как 5’ и 3’- концы. Цепочки в молекуле ДНК антипараллельны. В одной цепочке нуклеотиды связаны в направлении 5’ ® 3’, а в другой - 3’ ® 5’. Полинуклеотидные цепочки образуют двойную спираль. Каждый виток спирали содержит 10 пар азотистых оснований (рис. 2.2).
Рис. 2.2. Схема строения молекулы ДНК в виде двойной спирали (а) и прямой лесенки (б) (по В. Олфри и А. Мирскому). 1 – остаток 2-дезокси-β-D-рибозы, 2, 3, 4, 5 – азотистые основания (тимин, аденин, гуанин, цитозин, соответственно), 6 – остатки фосфорной кислоты.
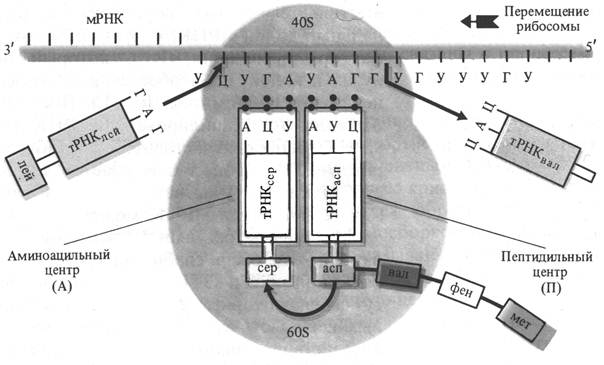
Во время репликации (синтеза) ДНК каждая из цепей родительской ДНК служит матрицей для образования комплементарной дочерней цепи из предшественников – дезоксирибонуклеозидтрифосфатов: дезоксиаденозин-, дезоксицитидин-, дезоксигуанозин- и дезокситимидинтрифосфата. При их полимеризации происходит освобождение молекул пирофосфата, которые расщепляются пирофосфатазой. Репликация ДНК осуществляется по полуконсервативному механизму: одна из цепей дочерней молекулы ДНК является частью родительской молекулы, а другая – вновь синтезированной. ДНК-полимераза способна синтезировать ДНК только в направлении от 5¢-конца к 3¢-концу. Поэтому на одной цепи ДНК образование дочерней цепи, называемой ведущей, происходит непрерывно, синтез другой цепи происходит прерывисто в виде коротких фрагментов Оказаки, получивших свое название в честь ученого, впервые их обнаружившего. Эта вторая дочерняя цепь получила название отстающей. Фрагменты Оказаки также синтезируются в направлении 5¢ ® 3¢, но перемещение ДНК-полимеразы вдоль матричной цепи ДНК при образовании каждого фрагмента противоположно направлению движения при синтезе ведущей цепи. Ведущая и отстающая цепи ДНК синтезируются координировано, что обеспечивается димеризацией ДНК-полимеразных комплексов у бактерий и наличием разных ДНК-полимераз у эукариотов. Для соединения двух фрагментов Оказаки ДНК-лигазой сначала удаляется РНК-затравка с помощью экзонуклеазы и РНКазы Н – нуклеазы, специфически расщепляющей РНК в ДНК-РНК-гибридах. Процесс репликации ДНК разделяют на три этапа: инициацию, элонгацию и терминацию. Для начала репликации необходим праймер (затравка) – короткий олигодезокси- или олигорибонуклеотид, комплементарный соответствующему участку ДНК-матрицы. В ходе репликации ДНК ее цепи расходятся из точки репликации, образуя Y-подобную структуру, которая называется репликативной вилкой. Именно в этом месте локализован репликативный комплекс, состоящий из нескольких белков. ДНК-хеликаза перемещается в репликативной вилке впереди ДНК-синтезирующего комплекса, расплетает цепи родительской ДНК и стимулирует образование затравок праймазой. ДНК-синтезирующий комплекс содержит ДНК-полимеразу, подвижный связывающий белок RPA и ДНК-зависимую АТФазу, которая узнает и связывается с единственным праймером ведущей цепи ДНК и с каждым праймером фрагментов Оказаки отстающей цепи, что делает возможным присоединение к праймерам ДНК-полимеразы и белка RPA. RPA связывается с образующимися одноцепочечными участками, облегчая процесс расплетения. RPA охватывает молекулу ДНК позади ДНК-зависимой АТФазы, стимулирует АТФазную активность и оставляет 3¢-конец праймера доступным для ДНК-полимеразы. ДНК-полимераза начинает элонгацию цепей ДНК, присоединяя первый дезоксирибонуклеозидмонофосфат к 3¢-концевому нуклеотиду РНК-затравки. Передача информации от ДНК осуществляется посредством информационной или матричной рибонуклеиновой кислоты (мРНК). Синтез мРНК называется транскрипцией. Молекула мРНК, комплементарная одной из цепей матричной ДНК, образуется в ходе сополимеризации четырех рибонуклеозидтрифосфатов (аденин-, гуанозин-, цитозин- и урацилтрифосфата) с образованием 3¢-5¢-фосфодиэфирных связей и освобождением неорганического пирофосфата. Транскрипцию осуществляет фермент ДНК-зависимая РНК-полимераза. Синтез мРНК молекулами РНК-полимеразы начинается в определенных местах ДНК, называемых промоторами, и завершается на особых нуклеотидных последовательностях – терминаторах. Совокупность нуклеотидов ДНК, заключенных между промотором и терминатором, называют транскрипционной единицей или транскриптоном. Процесс транскрипции подразделяют на 4 стадии: связывание РНК-полимеразы с ДНК и распознавание промотора, инициация, элонгация и терминация. Предполагается, что после первоначального непрочного связывания с ДНК в случайном месте молекула РНК-полимеразы перемещается вдоль двойной спирали ДНК до тех пор, пока не обнаружит последовательность нуклеотидов промотора. В этом месте связывание молекулы фермента с ДНК становится более прочным. Инициация транскрипции начинается с образования на промоторе предъиниционного комплекса, состоящего из РНК-полимеразы и матричной ДНК. После сборки предъинициационный комплекс претерпевает температурно-зависимые конформационные изменения, которые сопровождаются локальным плавлением, то есть расплетением двойной спирали ДНК, и комплекс становится способным к транскрипции. При наличии рибонуклеозидтрифосфатов происходит образование первых фосфодиэфирных связей в молекуле синтезируемой мРНК, после чего начинается стадия элонгации, то есть последовательное удлинение синтезируемой молекулы мРНК. В 1992 г. М. Чэмберлен с сотрудниками разработали общую модель элонгации мРНК, согласно которой перемещение РНК-полимеразы вдоль ДНК и присоединение нуклеотидов к растущей цепи мРНК в активном центре фермента разделены во времени. Это разделение возможно потому, что у РНК-полимеразы имеется два сайта (участка), удерживающих растущую цепь мРНК, и два участка связывания ДНК-матрицы. Молекула РНК-полимеразы перемещается вдоль ДНК подобно гусенице: когда один сайт связывания ДНК фиксирован, другой перемещается вперед. ДНК-зависимые РНК-полимеразы фагов, состоящие из одной субъединицы, синтезируют РНК в условиях in vitro со скоростью 200-400 нуклеотидов в секунду. При перемещении фермента вдоль матрицы цепи ДНК подвергаются плавлению и повторному отжигу, в результате которого восстанавливается исходная структура ДНК. Стадия элонгации заканчивается после достижения РНК-полимеразой терминатора транскрипции. Затем синтезированная РНК и РНК-полимераза освобождаются из транскрипционного комплекса. Только минус-цепь ДНК служит матрицей для синтеза мРНК. Участки ДНК, несущие информацию о строении белка - экзоны, разделены неинформативными интронами. В процессе транскрипции считывается информация как с экзонов, так и с интронов. Образуется предшественник мРНК - про-мРНК. Молекулы про-мРНК претерпевают созревание - процессинг. В ядре из про-мРНК происходит вырезание интронов и объединение экзонов - сплайсинг. К образовавшейся мРНК прикрепляется особая группировка поли-А и к одному из концов мРНК присоединяется защитная химическая группировка КЭП. После этого мРНК соединяется с белком, образуя инфорсому. Она выходит через поры в ядерной оболочке в цитоплазму. мРНК высвобождается из инфорсомы и одноцепочечная неспирализованная молекула мРНК присоединяется к участку малой субъединицы рибосомы, который примыкает к большой субъединице. К рибосоме прикрепляется небольшой участок цепи мРНК, содержащий один кодон, состоящий из трех азотистых оснований. Один кодон соответствует одной аминокислоте. Однако некоторые аминокислоты кодируются несколькими разными кодонами. Таким образом, первый этап синтеза белка - трансляции заключается в образовании комплекса между мРНК и рибосомой. Перенос аминокислот в цитоплазме к рибосомам осуществляется транспортными РНК (тРНК или 4S-РНК) из 70-80 нуклеотидов с молекулярной массой 25-30 кД. Они составляют почти 10 % от всей клеточной РНК и растворены в гиалоплазме. Поэтому тРНК еще называют растворимой РНК. В состав белков входят 20 аминокислот и каждой аминокислоте соответствует своя тРНК. Благодаря определенному расположению комплементарных нуклеотидов полинуклеотидная цепочка тРНК образует вторичную структуру, получившей название “клеверного листа”. Рентгеноструктурный анализ позволил установить третичную структуру тРНК. Она оказалась составленной из двух стеблей наподобие латинской буквы L. Каждая тРНК имеет триплет оснований - антикодон, ответственный за прикрепление к комплементарному кодону мРНК. Для того, чтобы аминокислота присоединилась к тРНК необходима ее активация или обогащение энергией. Активация аминокислоты происходит за счет ее реакции с аденозинтрифосфорной кислотой (АТФ) - вещества с макроэргическими связями (~). Реакция идет при участии фермента аминоацилсинтетазы (кодазы). Образовавшийся аминоациладенилат остается связанным с ферментом и вступает в реакцию с тРНК с образованием аминоацил-тРНК. Аминоацил-тРНК антикодоном присоединяется к кодону мРНК на малой субъединице рибосомы. После того как первая аминокислота со своей тРНК вошла в малую субъединицу рибосомы, происходит смыкание малой и большой субъединиц рибосомы. После смыкания субъединиц тРНК вместе с аминокислотой переносится на большую субъединицу. Одновременно мРНК перемещается на один кодон. В результате в малую субъединицу входит следующий кодон, кодирующий другую аминокислоту. К этому кодону с помощью антикодона присоединяется вторая тРНК со своей аминокислотой. В рибосоме оказываются две аминокислоты, ориентированные друг около друга таким образом, что карбоксильная группа первой аминокислоты оказывается рядом с аминогруппой второй аминокислоты. В результате сближения этих групп и с участием фермента большой субъединицы рибосомы пептидилтрансферазы аминокислоты соединяются пептидной связью. Образовавшийся дипептид присоединен ко второй тРНК, а первая тРНК освобождается и уходит в цитоплазму. В результате дипептид со второй тРНК оказывается связанным с большой субъединицей рибосомы, а мРНК перемещается еще на один кодон (рис. 2.3). Присоединение аминокислотных остатков - элонгация повторяется многократно, пока не образуется полипептидная цепочка белка. Окончание образования полипептидной цепочки - терминация связано с тем, что в малую субъединицу вступает терминальный кодон мРНК. Образовавшаяся полипептидная цепочка покидает рибосому. Большое значение имеет объединение рибосом в цепочки - полисомы. В этом случае одна молекула мРНК может последовательно присоединяться к ним и служить матрицей для синтеза нескольких одинаковых молекул белка. Когда синтез белка закончен, мРНК распадается. Синтез белковой молекулы идет с большой скоростью и поэтому время жизни мРНК невелико (от нескольких секунд до 1-2 минут). Однако, на определенных фазах развития растений (например, в набухающих и прорастающих семенах) синтезируются так называемые долгоживущие молекулы мРНК.
Рис. 2.3. Схема синтеза полипептидной цепи в рибосоме (по В. В. Полевому).
В заключение можно сказать, что из поколения в поколение передаются молекулы ДНК, которые несут в себе информацию о составе белковых молекул. План построения белка записан в ДНК с помощью триплетного кода, представленного чередованием азотистых оснований. Под влиянием внешних условий или спонтанно ДНК может изменяться. Эти изменения могут быть полезными, бесполезными и вредными. Полезные изменения, дающие организмам преимущество в борьбе за существование, могут закрепляться по наследству в ходе естественного или искусственного отбора. Возникающие в процессе трансляции белки являются полимерами, мономерами которых служат аминокислоты. Белки представляют собой цепочки остатков аминокислот, соединенных между собой пептидными связями. Молекулярная масса белков зависит от количества мономеров и колеблется от нескольких тысяч до миллионов. Разнообразие белков определяется различной последовательностью аминокислотных остатков. Белки, также как и аминокислоты - амфотерные соединения, то есть имеют положительный и отрицательные заряды. У каждого белка своя изоэлектрическая точка - значение рН, при которой молекула белка не имеет заряда. Молекула белка имеет первичную, вторичную, третичную и четвертичную структуру. Первичная структура определяется последовательностью аминокислотных остатков в белковой молекуле. Между аминокислотами, входящими в полипептидную цепочку, возможны водородные и другие связи. В результате этого полипептидная цепочка приобретает особенное расположение в пространстве, чаще всего в виде спирали. Это вторичная структура. По конформации полипептидной цепи различают фибриллярные и глобулярные белки. Фибриллярные белки сохраняют вытянутую форму спирали. У глобулярных белков спираль сворачивается в шарообразную глобулу, которая представляет собой третичную структуру белка. Она поддерживается кроме водородных связей гидрофобными взаимодействиями и дисульфидными связями, возникающими между двумя сульфгидрильными (SH) группами. Белки могут состоять из нескольких полипептидных цепочек и их взаимное расположение в пространстве и вокруг друг друга представляет собой четвертичную структуру.
2.3. Регуляции ферментативной активности в клетке
Химические процессы в клетке протекают с большой скоростью благодаря действию биологических катализаторов - ферментов или энзимов. Белковую часть фермента называют апоферментом. Небелковый компонент, прочно связанный, называют простетической группой, слабо связанный, обслуживающий несколько ферментов - коферментом. В состав простетических групп и коферментов входят металлы (железо, медь, цинк), витамины и их производные. Эндоферменты функционируют в клетке, а экзоферменты выделяются из клетки или локализуются в плазмалемме и действуют снаружи от нее. Ферменты обладают специфичностью как к субстратам (субстратная специфичность), так и к определенным химическим реакциям (специфичность действия). Названия ферментов обычно заканчиваются суффиксом “аза”, за исключением некоторых общепринятых названий, например, пепсин, трипсин и другие. Название, как правило, отражает природу субстрата (хитиназа расщепляет хитин), или функцию фермента (аминотрансфераза переносит аминогруппы), или же то и другое вместе (алкогольдегидрогеназа). Ферменты разделяют на 6 классов: 1) оксиредуктазы - катализируют окислительно-восстановительные реакции, 2) трансферазы - перенос целых атомных группировок от одного соединения к другому, 3) гидролазы - распад органических соединений с участием воды, 4) лиазы - присоединение какой-либо атомной группировки к органическим соединениям или отщепление от субстратов определенной группы без участия воды, 5) изомеразы - превращение одних изомеров в другие, 6) лигазы или синтетазы - синтез органических соединений, происходящий при участии АТФ с использованием энергии этой кислоты. Ферменты, катализирующие одну и ту же реакцию и встречающиеся у одного организма, но различающиеся по своим физико-химическим свойствам (например, по электрофоретической подвижности, следовательно, по молекулярной массе и заряду) называют изоферментами или изозимами. Наличие изоферментов позволяет организмам лучше приспосабливаться к меняющимся условиям внешней среды. Катализ осуществляется в результате образования фермент-субстратного комплекса, что приводит к сближению реагирующих молекул или созданию напряженных химических связей путем их растягивания. Субстрат должен соответствовать активному центру не только пространственно, но и по распределению зарядов, расположению групп атомов и так далее. Окончательная подгонка происходит лишь в процессе взаимодействия субстрата с ферментом, претерпевающим при этой реакции конформационные изменения. Продукты реакции отделяются от фермента и молекулы фермента регенерируются. Благодаря своей способности регенерироваться, то есть возвращаться к первоначальному состоянию, одна и та же молекула фермента может катализировать большой объем превращений. Скорость и направленность ферментативных реакций в клетке зависит от количества фермента, температуры и рН. Как всякая химическая реакция, ферментативные реакции зависят от температуры, что принято оценивать величиной температурного коэффициента (Q10), который показывает во сколько раз данный процесс ускоряется при повышении температуры на 10 Со. Поскольку ферменты являются белками, то повышение температуры свыше 35-40 Со вызывает их частичную инактивацию, а дальнейшее повышение температуры приводит уже к необратимой денатурации. У каждого фермента имеется свой оптимум рН, при котором лучше всего проявляется его активность. Это связано с тем, что рН влияет на заряд функциональных групп фермента, составляющих его активный центр, а от заряда зависит возможность образования фермент-субстратного комплекса. Известны следующие механизмы внутриклеточной регуляции функционирования ферментов: 1. Метаболитная регуляция. Она происходит в результате изменения концентрации метаболитов и не затрагивает активность или число ферментных молекул. Различают регуляцию в местах разветвления путей обмена веществ и регуляцию по принципу обратной связи. В первом случае ферменты конкурируют за один и тот же субстрат и выбор пути определяется концентрацией общего для конкурирующих ферментов субстрата и степенью сродства фермента к субстрату. Под обратной связью понимается влияние более позднего члена цепи взаимосвязанных реакций на более ранний. 2. Ферментная регуляция. При этом типе регуляции изменяется активность ферментов. Изменение ферментативной активности может осуществляться несколькими путями: а) Обратимое или необратимое превращение неактивных предшественников ферментов - зимогенов в активные ферменты. Например, b-амилаза инактивирована в запасающих клетках эндосперма семян злаков из-за соединения с запасными белками посредством дисульфидных связей (-S-S-). К началу прорастания семян из живых клеток алейронового слоя в эндосперм поступают вещества, разрушающие дисульфидные связи. Активированная b-амилаза принимает участие в гидролизе запасного крахмала; б) Изменение активности фермента под влиянием эффекторов. Связываясь с ферментом, эффекторы могут повышать его активность - это положительные эффекторы - активаторы или уменьшать ее - это отрицательные эффекторы - ингибиторы. Эффектор может влиять на активность фермента, взаимодействуя с активным центром (изостерический эффект) или изменяя конформацию ферментной молекулы в результате связывания с ее аллостерическим центром (аллостерический эффект). Изостерический эффект происходит в том случае, когда эффектор и субстрат похожи по своему строению и конкурируют друг с другом за активный центр фермента. Такой тип ингибирования называют конкурентным ингибированием. 3. Генная регуляция. В этом случае изменяется количество ферментных молекул в клетке из-за включения или выключения синтеза ферментов. Регулирующие факторы действуют на ДНК, РНК или рибосомы. 4. Мембранная регуляция. Различают контактную и дистанционную мембранную регуляцию активности ферментов. Контактная регуляция – связывание ферментов с мембранами или их освобождение меняет их активность. Дистанционная мембранная регуляция активности ферментов осуществляется косвенным путем в результате транспорта через мембраны субстратов и коферментов, удаления продуктов реакции, ионных и рН сдвигов в компартментах клетки.
2.4. Поступление воды в клетку
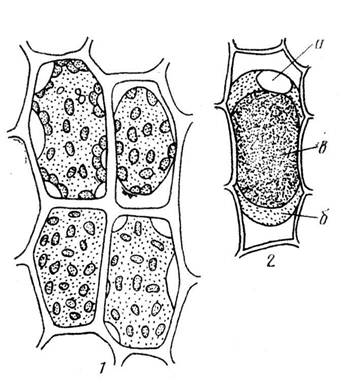
При температуре выше абсолютного нуля все молекулы находятся в постоянном движении. Диффузия - это процесс, ведущий к равномерному распределению молекул газов или растворенного вещества и растворителя благодаря их постоянному движению. Диффузия всегда направлена от большей концентрации вещества к меньшей. Количество вещества J, диффундирующего в единицу времени через воображаемое поперечное сечение, зависит от величины градиента dc/dx (градиент – мера изменения какого-либо параметра с расстоянием или временем) и от природы диффундирующего вещества, влияющего на коэффициент диффузии D. Это 1-й закон диффузии Фика, который описывается следующим уравнением: J = - D · dc/dx, так как суммарный поток направлен в сторону области меньшей концентрации, в уравнении стоит знак минус. Скорость диффузии уменьшается с увеличением ее продолжительности. Проходимое путем диффузии расстояние пропорционально не времени, как при равномерном движении, а ее квадратному корню. Это 2-й закон диффузии Фика: dc/dt = D · dc2/dx2, где dc/dt – изменение концентрации вещества во времени. Диффузия воды через полупроницаемую мембрану называется осмосом. Полупроницаемая мембрана - это мембрана хорошо проницаемая для воды и непроницаемая или плохо проницаемая для растворенных в воде веществ. Осмотическая ячейка - это пространство, окруженное полупроницаемой мембраной и заполненное каким-либо водным раствором. Все клеточные мембраны, в том числе плазмалемма и тонопласт, являются полупроницаемыми мембранами. Вода проходит в клетку через водные поры в плазмалемме, образованные специальными белками аквапоринами. Внутри осмотической ячейки раствор развивает осмотическое давление p: p = i · c · R · T, где с – концентрация раствора в молях, Т - абсолютная температура, R - газовая постоянная 0,082 л · атм/град · моль, i – изотонический коэффициент, равный 1 + a(n-1), где a - степень электролитической диссоциации, n – число ионов, на которые распадается молекула электролита. Благодаря осмотическому притоку воды в клетку там возникает гидростатическое давление, называемое тургорным. Это давление прижимает цитоплазму к клеточной стенке и растягивает ее. Клеточная стенка имеет ограниченную эластичность и оказывает равное противодавление. Эластическое растяжение ткани благодаря тургорному давлению ее клеток придает твердость не одревесневшим частям растений. Завядающие побеги становятся дряблыми, так как при потере воды тургорное давление падает. Тургорное давление противодействует притоку воды в клетку. Давление, с которым вода осмотически притекает в клетку, равно таким образом, разности между осмотическим давлением p и тургорным давлением P. Эту величину называют сосущей силой S: S = p - P. Вода поступает в клетку из внешнего раствора, если его потенциальное осмотическое давление меньше сосущей силы клетки и, наоборот, вода выходит из клетки в раствор с более высоким потенциальным осмотическим давлением. При термодинамической трактовке сосущая сила заменяется водным потенциалом yw. Водный потенциал можно определить как работу, необходимую для того, чтобы поднять потенциал связанной воды до потенциала чистой, то есть свободной воды. Термин водный потенциал не совсем точен. Правильнее, но менее употребителен термин разность потенциалов воды, поскольку он определяется разностью между химическими потенциалами воды в системе mw (например, вакуоле) и чистой воды mow при атмосферном давлении. Абсолютные значения mw и mow неизвестны, но их разность можно определить. Она всегда отрицательна. Потенциал воды в растворе, растении, почве и атмосфере меньше 0. Потенциал чистой воды равен 0. Можно также заменить p и P на потенциалы, а именно на осмотический потенциал yp (отрицательный) и потенциал давления yр (как правило, положительный). В таком случае осмотическое уравнение превращается в уравнение потенциала воды: - yw = - yp - yр (размерность бар = эрг · см-3 ·106) Величину осмотического потенциала можно определить плазмолитическим методом. Плазмолиз - это процесс, обусловленный потерей воды клеткой. Он проявляется в отходе протопласта от клеточной стенки. В отдельных местах цитоплазма может в течение более или менее продолжительного времени сохранять связь с клеточной стенкой, образуя так называемые нити Гехта. Наблюдаются различные формы плазмолиза: выпуклый плазмолиз при небольшой вязкости цитоплазмы и вогнутый плазмолиз при высокой вязкости цитоплазмы (рис. 2.4). При переносе плазмолизированных тканей в гипотонический раствор или чистую воду вода поступает в клетку и происходит деплазмолиз. Количество воды в клетке увеличивается, объем вакуоли возрастает и она прижимает цитоплазму к клеточной стенке. Плазмолитический метод основан на подборе изоосмотического (изотонического) раствора, то есть имеющего осмотический потенциал равный осмотическому потенциалу клетки. Раствор, при котором начался плазмолиз, имеет осмотический потенциал примерно равный осмотическому потенциалу клетки. Зная концентрацию наружного раствора в молях, можно вычислить осмотический потенциал клетки.
Рис. 2.4. Формы плазмолиза. 1 – последовательные этапы плазмолиза в клетках листа мха, 2 – выпуклая форма плазмолиза (колпачковый плазмолиз) в клетке эпидермиса чешуи лука с окрашенной антоцианом вакуолью: а – ядро, б – цитоплазма, в – вакуоль (по Д. А. Сабинину – цит. по С. И. Лебедеву).
Иногда при сильном завядании протопласт не отстает от клеточной стенки как при плазмолизе, а сжимается и тянет ее за собой. При этом клеточная стенка прогибается. Это явление называют циторризом. Развивается натяжение или отрицательное давление стенки и потенциал тургорного давления приобретает отрицательное значение. В этом случае величина водного потенциала определяется уже не разностью, а суммой осмотического потенциала и потенциала давления: -yw = -yp + yp. Величина осмотического потенциала позволяет судить о способности растения поглощать воду из почвы и удерживать ее, несмотря на иссушающее действие атмосферы. Осмотический потенциал колеблется у разных растений в пределах от -5 до -200 бар. У водных растений осмотический потенциал около -1 бара. У большинства растений средней полосы осмотический потенциал колеблется от -5 до -30 бар, растения степей и пустынь имеют более отрицательный осмотический потенциал. Осмотический потенциал различен и у разных жизненных форм. У деревьев он более отрицателен, чем у кустарников и травянистых растений, соответственно. У светолюбивых растений осмотический потенциал более отрицателен, чем у теневыносливых растений. Поступление воды в клетку обусловлено не только осмотическим давлением, но и силой набухания. Набуханием называют поглощение жидкости или пара высокомолекулярным веществом (набухающим телом), сопровождаемое увеличением объема. Явление набухания обусловлено коллоидальными и капиллярными эффектами. В протоплазме преобладает набухание на коллоидальной основе (гидратация коллоидов), а в клеточной стенке наблюдаются оба эффекта: капиллярный - накопление воды между микрофибриллами и в межмицеллярных пространствах и коллоидальный - гидратация полисахаридов, особенно гемицеллюлоз. У некоторых частей растений поглощение воды происходит исключительно путем набухания, например, у семян. Вода диффундирует в набухающее тело. Благодаря большому сродству набухающего тела к воде при набухании может возникать давление набухания в несколько сотен атмосфер. Силу набухания обозначают термином матричный потенциал yt. Таким образом, для клетки характерны следующие уравнения водного потенциала: вакуоль: -yw = -yp - yp протоплазма: -yw = -yp - yp - yt клеточная стенка: -yw = - yt Вода в клетку может поступать также в процессе пиноцитоза, когда часть плазмалеммы под влиянием различных причин, чаще всего в результате адсорбции на плазмалемме крупных молекул и вирусных частиц, прогибается внутрь клетки, внешние края такой инвагинации смыкаются и виде пузырька - везикулы с адсорбированной частицей и внешним раствором проходит внутрь цитоплазмы.
2.5. Поступление ионов в клетку
Все неорганические питательные вещества поглощаются в форме ионов, содержащихся в водных растворах. Поглощение ионов клеткой начинается с их взаимодействия с клеточной стенкой. Ионы могут частично локализоваться в межмицеллярных и межфибриллярных промежутках клеточной стенки, частично связываться и фиксироваться в клеточной стенке электрическими зарядами. Поступившие ионы легко вымываются. Объем клетки, доступный для свободной диффузии ионов, получил название свободного пространства. Свободное пространство включает межклетники, клеточные стенки и промежутки, которые могут возникать между клеточной стенкой и плазмалеммой. Иногда его называют кажущееся свободное пространство (КСП). Термин “кажущееся” означает, что его объем зависит от объекта и природы растворенного вещества. КСП занимает в растительных тканях 5-10 % объема. Свободное пространство всего растения получило название апопласт, в отличие от симпласта - совокупности протопластов всех клеток. Поглощение и выделение веществ в КСП - физико-химический пассивный процесс, не зависимый от температуры и ингибиторов энергетического и белкового обменов. Клеточная стенка обладает свойствами ионообменника, так как в ней адсорбированы ионы Н+ и НCO-3, обменивающиеся в эквивалентных количествах на ионы внешнего раствора. В клеточную стенку входят амфотерные белковые соединения, заряд которых меняется при изменение рН. Поэтому адсорбция ионов зависит от величины рН. Из-за преобладания отрицательных фиксированных зарядов в клеточной стенке происходит первичное концентрирование катионов (особенно двух- и трехвалентных). Для того, чтобы проникнуть в цитоплазму и включиться в обмен веществ, ионы должны пройти через плазмалемму. Транспорт ионов через мембрану может быть пассивным и активным. Пассивное поглощение не требует затрат энергии и осуществляется путем диффузии по градиенту концентрации вещества, для которого плазмалемма проницаема. Пассивное передвижение ионов определяется не только химическим потенциалом m, как это имеет место при диффузии незаряженных частиц, но и электрическим потенциалом e. Оба потенциала объединяют в виде электрохимического потенциала `m: `m = m + nFe, где m - химический, e - электрический, `m - электрохимический потенциалы, n - валентность иона, F - константа Фарадея. Любая разность электрических потенциалов, которая возникает на мембранах, вызывает соответствующее перемещение ионов. Электрический потенциал на мембране - трансмембранный потенциал может возникнуть по следующим причинам: 1) если поступление ионов идет по градиенту концентрации, но благодаря разной проницаемости мембраны с большей скоростью поступают катионы, чем анионы. В силу этого на мембране возникает разность электрических потенциалов, что приводит к диффузии противоположно заряженного иона; 2) при наличии на внутренней стороне мембраны белков, фиксирующих определенные ионы. За счет фиксированных зарядов создается дополнительная возможность поступления ионов противоположного заряда; 3) в результате активного транспорта либо катиона, либо аниона, в этом случае противоположно заряженный ион может передвигаться пассивно по градиенту электрического потенциала. Активный транспорт - это транспорт, идущий против электрохимического градиента с затратой энергии, выделяющейся в процессе метаболизма. В определенных пределах с повышением температуры скорость активного поглощения веществ возрастает. В отсутствие кислорода, в атмосфере азота поступление ионов резко тормозится. Под влиянием дыхательных ядов, таких как цианистый калий, окись углерода, и ингибиторов дыхания, таких как 2,4-динитрофенол, азид натрия, транспорт ионов ингибируется. С другой стороны, увеличение содержания АТФ усиливает процесс поглощения. Опыты, проведенные на искусственных липидных мембранах, показали, что перенос ионов может происходить под влиянием некоторых антибиотиков - ионофоров, вырабатываемых бактериями и грибами. В одних случаях катион входит во внутреннюю полость молекулы ионофора. Образованный комплекс диффундирует через мембрану во много раз быстрее по сравнению со свободным ионом. Ионофоры другого типа взаимодействуют с мембранами, образуя в них поры. Активный транспорт ионов через мембрану осуществляется с помощью переносчиков. Ион реагирует со своим переносчиком на поверхности плазмалеммы. Комплекс переносчика с ионом подвижен в самой мембране и передвигается к ее внутренней стороне. Здесь комплекс распадается и ион освобождается во внутреннюю среду, а переносчик передвигается к внешней стороне мембраны. Подтверждением наличия переносчиков служит тот факт, что при увеличении концентрации солей в окружающем растворе скорость поступления солей сначала возрастает, а затем остается постоянной. Это объясняется ограниченным числом переносчиков. Переносчики специфичны, то есть участвуют в переносе только определенных ионов и, тем самым, обеспечивают избирательность поступления. Транспорт с участием переносчиков может идти по градиенту электрохимического потенциала. Это пассивный транспорт, но благодаря переносчикам он идет с большей скоростью, чем обычная диффузия и этот процесс носит название облегченной диффузии. Активный транспорт ионов идет с потреблением энергии, аккумулированной в АТФ. Для использования энергии АТФ должна быть гидролизована: АТФ + НОН ® АДФ + Фн. Этот процесс катализируется ферментом аденозинтрифосфатазой (АТФазой). АТФаза обнаружена в мембранах различных клеток. Транспортные АТФазы являются высокомолекулярными липопротеидами с мол. массой 200 - 700 кД. Для растений большое значение имеет Н+-АТФаза (водородный насос или водородная помпа), которая осуществляет перенос протонов через мембраны, используя энергию гидролиза АТФ. Н+-АТФаза - это одиночный полипептид с массой несколько большей 100 кД. Его содержание в плазмалемме растительных клеток достигает 15 % от общего количества белка. Перенос ионов водорода сопровождается переносом катионов в обратном направлении. Такой процесс называется антипорт. Вместе с протоном могут двигаться анионы - симпорт. Освобождаемая при распаде АТФ энергия используется для изменения конфигурации самой АТФазы, благодаря чему участок фермента, связывающий определенный ион, поворачивается и оказывается по другую сторону мембраны. Также выделены низкомолекулярные транспортные белки пермеазы (10 - 45 кД), лишенные ферментативной активности. Пройдя через плазмалемму, ионы поступают в цитоплазму, где включаются в метаболизм клетки. Внутриклеточный транспорт ионов осуществляется благодаря движению цитоплазмы и по каналам эндоплазматического ретикулума. Ионы попадают в вакуоль, если цитоплазма и органеллы уже насыщены ими. Для того, чтобы попасть в вакуоль, ионы должны преодолеть еще один барьер - тонопласт. Транспорт ионов через тонопласт совершается также с помощью переносчиков и требует затраты энергии. Переносчики, расположенные в тонопласте, имеют меньшее сродство к ионам и действуют при более высоких концентрациях ионов по сравнению с переносчиками плазмалеммы. В тонопласте была идентифицирована особая Н+-АТФаза. Она не тормозится диэтилстильбестролом – ингибитором Н+-АТФазы плазмплеммы. Дата добавления: 2015-02-02 | Просмотры: 1316 | Нарушение авторских прав |