|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
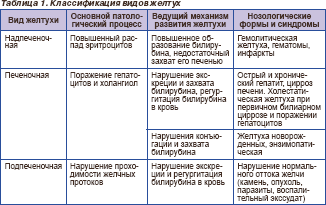
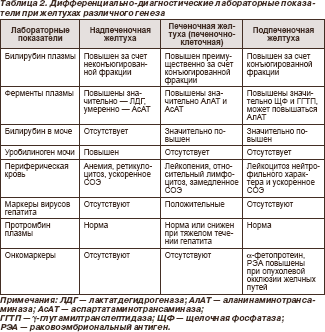
Версия для печатиСИНДРОМ ЖЕЛТУХИ В КЛИНИЧЕСКОЙ ПРАКТИКЕ Авторы: Н.С. КАБАНЕЦ, Н.Б. ГУБЕРГРИЦ, Донецкий национальный медицинский университет им. М. Горького Версия для печати Желтуха — это полиэтиологический синдром, характеризующийся желтушным окрашиванием кожи и слизистых оболочек вследствие накопления в тканях избыточного количества билирубина. Уровень билирубина в крови при этом повышен. Желтуха является клиническим синдромом, характерным для ряда заболеваний внутренних органов. Практическому врачу чрезвычайно важно знать основные причины возникновения желтухи, особенности клинического течения и диагностики различного вида желтух. В зависимости от причины повышения уровня билирубина в крови выделяют два основных вида желтухи: желтуха истинная и желтуха ложная (псевдожелтуха). Желтуха (истинная) — симптомокомплекс, характеризующийся желтушным окрашиванием кожи и слизистых оболочек, обусловленный накоплением в тканях и крови билирубина. В зависимости от причин гипербилирубинемии различают гемолитическую (надпеченочную), паренхиматозную (печеночную) и механическую (подпеченочную) желтухи (табл. 1).
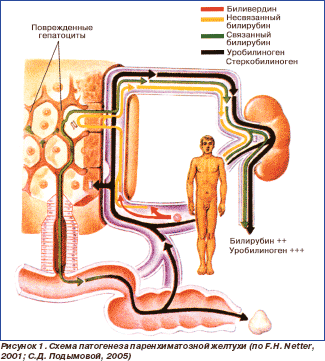
Желтуха ложная (псевдожелтуха) — желтушное окрашивание кожи (но не слизистых оболочек!) вследствие накопления в ней каротинов при длительном и обильном употреблении в пищу моркови, апельсинов, тыквы, а также возникающая при приеме внутрь акрихина, пикриновой кислоты и некоторых других препаратов. Желтуха паренхиматозная (печеночная) — истинная желтуха, возникающая при различных поражениях паренхимы печени. Развивается в результате инфекционного или токсического поражения гепатоцитов и нарушения или полного прекращения их функционирования. Обусловлена нарушениями метаболизма, транспорта и захвата билирубина в гепатоцитах и желчных протоках (цитолитический синдром). Паренхиматозная желтуха возникает также при задержке желчи в мельчайших внутрипеченочных протоках (внутрипеченочный холестаз), когда развивается клиническая картина механической желтухи, но препятствия вне печени нет. Такое состояние наблюдается при некоторых видах гепатита, билиарном циррозе печени, а также при интоксикации лекарственными средствами. Желчные пигменты проникают в лимфатические сосуды и кровеносные капилляры между пораженными и частично погибающими гепатоцитами, их содержание в крови повышается. Большая часть такого билирубина дает прямую реакцию и выделяется с мочой, окрашивая ее в темный цвет. В кишечник попадает меньшее, чем обычно, количество желчных пигментов, поэтому в большинстве случаев кал светлый. Уробилиноген, синтезируемый в кишечнике, всасывается, но пораженные гепатоциты не способны расщеплять его на желчные пигменты. Поэтому количество уробилиногена в крови и моче повышается (рис. 1).
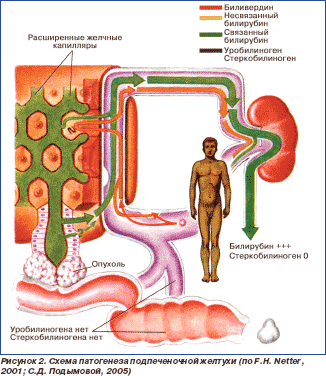
При остром вирусном гепатите, воздействии алкоголя, лекарственных препаратов, химических веществ, отравлении грибами, сепсисе, мононуклеозе, лептоспирозе, гемохроматозе наблюдается продолжительная полная обтурация желчных протоков. На воздействие вирусов, ядов, лекарственных средств печень реагирует цитолитическим или холестатическим синдромом. Внутрипеченочный холестаз развивается при гепатитах различной этиологии: вирусном (вирусы А, С, G, цитомегаловирус, вирус Эпштейна — Барр), алкогольном, лекарственном, аутоиммунном. При острых вирусных гепатитах продромальный период продолжается 2–3 недели и проявляется постепенным нарастанием желтухи (с красноватым оттенком) на фоне слабости, утомляемости, снижения аппетита, тошноты, рвоты, боли в животе. Печень поражают различные лекарственные препараты: психотропные (хлорпромазин, диазепам), антибактериальные (эритромицин, нитрофураны, сульфаниламидные), антидепрессанты (карбамазепин), гипогликемические (хлорпропамид, толбутамид), антиаритмические (аймалин), иммуносупрессанты (циклоспорин А), антигельминтные (тиабендазол). При прекращении приема препарата выздоровление может быть длительным — до нескольких месяцев и даже лет; в ряде случаев поражение печени прогрессирует с развитием цирроза (нитрофураны). Внутрипеченочный холестаз наблюдается при амилоидозе, тромбозе печеночных вен, застойной и шоковой печени. Вследствие поражения гепатоцитов снижается их функция по улавливанию свободного (непрямого) билирубина из крови, связыванию его с глюкуроновой кислотой с образованием нетоксичного водорастворимого билирубина-глюкуронида (прямого) и выделению последнего в желчные капилляры. В результате в сыворотке крови повышается содержание билирубина (до 50–200 мкмоль/л, реже — больше). Однако в крови повышается не только содержание свободного, но и связанного билирубина (билирубина-глюкуронида) — за счет его обратной диффузии из желчных капилляров в кровеносные при дистрофии и некробиозе печеночных клеток. Возникает желтушное окрашивание кожи, слизистых оболочек. Клиника паренхиматозной желтухи во многом определяется ее этиологией. Для паренхиматозной желтухи характерен шафраново-желтый, красноватый цвет кожи («красная желтуха»). Вначале желтушная окраска проявляется на склерах и мягком небе, затем окрашивается кожа. Паренхиматозная желтуха сопровождается зудом кожи, однако менее выраженным, чем механическая, так как пораженная печень меньше продуцирует желчных кислот, накопление которых в крови и тканях и вызывает этот симптом. При длительном течении паренхиматозной желтухи кожа может приобретать, как и при механической, зеленоватый оттенок (за счет превращения откладывающегося в коже билирубина в биливердин, имеющий зеленый цвет). Обычно в крови повышается активность альдолазы, аминотрансфераз, особенно аланинаминотрансферазы, изменены другие печеночные пробы. Моча приобретает темную окраску (цвета пива) за счет появления в ней связанного билирубина и уробилина. Кал светлеет или обесцвечивается за счет уменьшения содержания в нем стеркобилина. Соотношение количества выделяемого стеркобилина с калом и уробилиновых тел с мочой (важный лабораторный критерий дифференциации видов желтух), составляющее в норме 10: 1–20: 1, при печеночноклеточных желтухах значительно снижается, достигая при тяжелых поражениях 1: 1. Патологические процессы в печени часто сопровождаются уменьшением поступления в двенадцатиперстную кишку желчи вследствие нарушения ее образования, экскреции и/или выведения. Печень увеличенная, болезненная при пальпации. Нередко наблюдается геморрагический синдром и синдром мезенхимального воспаления. Наличие последнего свидетельствует о сенсибилизации иммунокомпетентных клеток и активности ретикулогистиолимфоцитарной системы. Он проявляется гипертермией, полиартралгией, спленомегалией, лимфаденопатией и узловатой эритемой. Течение зависит от характера поражения печени и длительности действия повреждающего начала; в тяжелых случаях может возникнуть печеночная недостаточность. Окончательный диагноз вирусного гепатита ставят на основании серологических и иммунологических исследований. Механическая (подпеченочная, обтурационная) желтуха развивается в результате частичной или полной непроходимости желчевыводящих путей с нарушением пассажа желчи в кишечник. Причиной обструкции могут быть конкременты общего желчного протока; рак, киста, абсцесс в головке поджелудочной железы; стеноз, опухоль большого сосочка или желчных протоков (метастазы), их посттравматические стриктуры (после операций, колики с отхождением камней) и инфекция (паразиты). Препятствие в желчевыводящих путях уменьшает ток желчи по канальцам, печеночную экскрецию воды и/или органических анионов. Давление проксимально от места обструкции повышается, компоненты желчи из межклеточных пространств попадают непосредственно в кровь. Желчь накапливается в гепатоцитах и желчевыводящих путях, а желчные кислоты, липиды, билирубин — в крови. В плазме крови повышается содержание билирубина, дающего прямую реакцию. Он выделяется с мочой и окрашивает ее в темно-коричневый цвет (цвет пива). В кишечнике желчи нет, кал обесцвечен. Образование уробилиногена в кишечнике не происходит, поэтому он отсутствует и в моче (рис. 2). В кровь могут попадать и желчные кислоты, в плазме повышается содержание холестерина, щелочной фосфатазы. Длительный холестаз (в течение месяцев и лет) приводит к развитию билиарного цирроза печени.
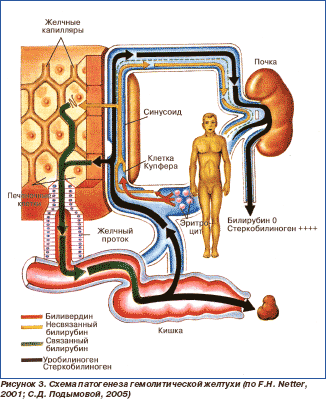
В образовании желчи участвует ряд энергозависимых транспортных процессов: захват желчных кислот, органических и неорганических ионов, перенос их через синусоидальную мембрану внутрь гепатоцита и через мембрану канальцев в желчный капилляр. Транспорт компонентов желчи зависит от нормального функционирования белков-переносчиков, встроенных в обе мембраны (в том числе Na+-К+-АТФазы, переносчиков для желчных кислот, органических анионов). На клеточном уровне чаще всего наблюдаются нарушение синтеза Na+-К+-АТФазы и транспортных белков или их функции под влиянием желчных кислот, медиаторов воспаления (цитокинов — фактора некроза опухоли, интерлейкина-1b и др.), эндотоксинов, лекарственных веществ, изменения липидного состава, проницаемости мембран, структур клетки и канальцев. Механическая обструкция магистральных протоков повышает давление в желчных протоках, а гипертензия подавляет секрецию желчи. Накопление желчных кислот с выраженными поверхностно-активными свойствами вызывает повреждение гепатоцитов и усиление холестаза. Токсичность желчных кислот зависит от степени их липофильности и гидрофобности. К гепатотоксичным относят хенодезоксихолевую (первичную желчную кислоту, синтезирующуюся в печени из холестерина), а также литохолевую и дезоксихолевую (вторичные кислоты, образующиеся в кишечнике из первичных под действием бактерий). Основным звеном в развитии некрозов гепатоцитов считают повреждение под влиянием желчных кислот мембран митохондрий, уменьшение синтеза АТФ в клетке, повышение внутриклеточной концентрации Са2+, стимуляцию кальций-зависимых гидролаз. Желчные кислоты вызывают апоптоз гепатоцитов — программируемую смерть клетки. Механическая желтуха может быть частичной. Клиническая картина определяется длительностью внепеченочного холестаза. Проявляется желтухой, ахоличным калом, зудом кожи, нарушением всасывания жиров, стеатореей, похудением, гиповитаминозами А, D, Е, К, ксантомами, гиперпигментацией кожи, холелитиазом, формированием билиарного цирроза печени (портальная гипертензия, печеночная недостаточность). Зуд кожи, желтуха наблюдаются при значительном нарушении экскреторной функции гепатоцитов (более 80 %) и не всегда являются ранними признаками холестаза. Зуд значительно ухудшает качество жизни больных. Природа его окончательно не ясна. Вероятно, соединения, вызывающие зуд, синтезируются в печени (в пользу этого свидетельствует исчезновение зуда в терминальной стадии печеночной недостаточности). Традиционно зуд кожи связывают с задержкой желчных кислот в коже и раздражением нервных окончаний дермы, эпидермиса. Прямой связи между выраженностью зуда и уровнем желчных кислот в сыворотке нет. Дефицит желчных кислот в кишечнике приводит к нарушению всасывания жиров, способствует стеаторее, похудению, дефициту жирорастворимых витаминов (A, D, К, Е). Выраженность стеатореи соответствует уровню желтухи. Цвет кала – надежный индикатор степени обструкции желчевыводящих путей (полной, интермиттирующей, разрешающейся). Дефицит витамина D является одним из звеньев остеопороза и остеомаляции (при хроническом холестазе), проявляющихся тяжелым болевым синдромом в грудном или поясничном отделе позвоночника, спонтанными переломами, особенно ребер, при минимальных травмах, компрессионными переломами тел позвонков. Патология костной ткани усугубляется нарушением всасывания Са2+ в кишечнике. Дефицит витамина К (необходимого для синтеза в печени факторов свертывания) проявляется геморрагическим синдромом и гипопротромбинемией, быстро купирующимися при парентеральном введении витамина К. Клинические проявления дефицита витамина Е (мозжечковая атаксия, периферическая полиневропатия, дегенерация сетчатки) наблюдаются преимущественно у детей. У взрослых больных содержание витамина Е всегда снижено, однако специфических неврологических симптомов нет. При истощении печеночных запасов витамина А могут развиться нарушения темновой адаптации (куриная слепота). Длительный холестаз способствует образованию конкрементов в желчных путях. При наличии камней или после операций на желчных протоках, особенно у больных с печеночно-кишечными анастомозами, часто присоединяется бактериальный холангит (классическая триада Шарко: боль в правом подреберье, лихорадка с ознобом, желтуха). В плазме крови повышается уровень всех компонентов желчи, прежде всего желчных кислот. Концентрация билирубина (конъюгированного) растет в течение первых 3 нед., а затем колеблется, сохраняя тенденцию к увеличению. При разрешении холестаза она снижается постепенно, что связано с образованием билиальбумина (билирубина, связанного с альбумином). В периферической крови возможно появление мишеневидных эритроцитов (вследствие накопления холестерина в мембранах и увеличения площади клеточной поверхности). В терминальной стадии поражения печени содержание холестерина в крови снижается. Повышение активности трансаминаз, как правило, не столь значительно, как маркеров холестаза (щелочной фосфатазы, 5-нуклеотидазы, γ-глутамилтранспептидазы). В то же время при острой обструкции магистральных протоков активность АсАТ, АлАТ может в 10 раз превышать норму (как при остром гепатите). Иногда активность щелочной фосфотазы может быть нормальной или пониженной из-за отсутствия кофакторов данного фермента (цинка, магния, В12). Результаты клинических и биохимических исследований при внутри- и внепеченочном холестазе могут быть сходными. Иногда внепеченочную обструкцию ошибочно принимают за внутрипеченочный холестаз и наоборот. В пользу механической обструкции с развитием желчной гипертензии свидетельствуют боль в животе (при конкрементах в протоках, опухолях), пальпируемый желчный пузырь. Лихорадка и ознобы — симптомы холангита у больных с конкрементами в желчных протоках или стриктурами желчевыводящих путей. Плотность и бугристость печени при пальпации отражают далеко зашедшие изменения или опухолевое поражение печени (первичное или метастатическое). Если при ультразвуковом исследовании выявляется характерный признак механической блокады желчных путей — надстенотическое расширение желчных протоков (билиарная гипертензия) — показана холангиография. Методом выбора является эндоскопическая ретроградная холангиопанкреатография. Если она невозможна, применяют чрескожную чреспеченочную холангиографию. Оба метода позволяют одновременно дренировать желчевыводящие пути при их обструкции, однако при эндоскопическом подходе наблюдается меньшая частота осложнений. При эндоскопической ретроградной холангиопанкреатографии возможно выполнение сфинктеротомии (для удаления конкрементов). Диагноз внутрипеченочного холестаза может подтвердить биопсия печени, которую проводят только после исключения обструктивного внепеченочного холестаза (во избежание развития желчного перитонита). Гемолитическая (надпеченочная) желтуха возникает в результате интенсивного распада эритроцитов и чрезмерной выработки непрямого билирубина. Эти явления возникают при гиперфункции клеток ретикулоэндотелиальной системы (прежде всего селезенки), при первичном и вторичном гиперспленизме. Типичным примером гемолитической желтухи могут служить различные гемолитические анемии, в том числе врожденные (микросфероцитоз и др.). При этом образование непрямого билирубина настолько велико, что печень не успевает превратить его в связанный (прямой) билирубин. Причинами гемолитической желтухи могут быть также различные другие факторы, ведущие к гемолизу: гемолитические яды, всасывание в кровь продуктов распада обширных гематом и т.д. На практике поставить диагноз гемолитической желтухи легче других. При гемолитической желтухе кожные покровы приобретают лимонно-желтую окраску, желтуха выражена умеренно, кожного зуда нет. При выраженной анемии определяется бледность кожных покровов и слизистых оболочек на фоне имеющейся желтухи. Печень нормальных размеров или несколько увеличена. Селезенка умеренно увеличена. При некоторых видах вторичного гиперспленизма может быть выявлена выраженная спленомегалия. Моча имеет темный цвет за счет повышенной концентрации уробилиногена и стеркобилиногена. Реакция мочи на билирубин отрицательная. Кал интенсивно темно-бурого цвета, концентрация стеркобилина в нем резко повышена. В анализах крови — повышение уровня непрямого билирубина, концентрация прямого билибурина не повышена (рис. 3). Анемия, как правило, умеренно выражена, ретикулоцитоз. СОЭ несколько увеличена. Печеночные пробы, холестерин крови в пределах нормы. Уровень сывороточного железа крови повышен.
Иммунные гемолитические анемии развиваются под воздействием антител на эритроциты. Основные формы иммунных гемолитических анемий: 1) аутоиммунные, обусловленные появлением в организме антител против собственных эритроцитов; 2) гаптеновые, вызванные фиксацией на эритроцитах чуждых для организма антигенов — гаптенов (лекарства, вирусы и т.п.) с антителами, образованными в ответ на соединение гаптена с белком организма; 3) изоиммунные, связанные с попаданием в организм новорожденного антител матери, направленных против эритроцитов ребенка (при несовместимости ребенка и матери по Rh-фактору и гораздо реже по антигенам системы АВ0). Аутоиммунные гемолитические анемии. В основе патологического процесса лежит срыв иммунологической толерантности к собственным эритроцитам. Клиническая картина болезни складывается из признаков анемического синдрома; тяжесть состояния больных определяется выраженностью и остротой развития анемии. При хроническом, медленно развивающемся процессе первым признаком болезни может быть небольшая желтуха (за счет непрямого билирубина); одновременно выявляется и анемия. В других случаях начало болезни характеризуется бурным гемолизом с быстро нарастающими анемией и желтухой. Нередко повышается температура тела. Часто увеличивается селезенка. Возможно увеличение печени за счет холелитиаза, жировой дистрофии. Обычно выслушивается функциональный систолический шум на верхушке и на основании сердца, нередко определяется раздвоение II тона. Картина крови характеризуется нормохромной анемией (при остром гемолизе уровень гемоглобина может падать до катастрофических цифр, больной может впадать в анемическую кому). Морфология эритроцитов существенно не меняется, но иногда отмечается их микросфероцитоз, что требует дифференцирования от наследственного микросфероцитоза. При остром гемолизе в крови могут определяться единичные эритрокариоциты. Уровень ретикулоцитов высок. Белая кровь существенно не меняется, но гемолитический криз может сопровождаться непродолжительным нейтрофильным лейкоцитозом (назначение стероидных гормонов при гемолизе может сопровождаться очень высоким нейтрофильным лейкозом со сдвигом до промиелоцитов). Число тромбоцитов обычно нормальное. Костный мозг при аутоиммунной гемолитической анемии характеризуется раздражением красного ростка. Биохимические исследования обнаруживают, помимо гипербилирубинемии, увеличение содержания гамма-глобулинов. При тяжелом гемолизе возможны тромбозы в системе мезентериальных сосудов с появлением сильной приступообразной боли и вздутием живота за счет пареза кишечника. Как правило, тромбируются мелкие сосуды и гангрена кишечника не развивается, в оперативном вмешательстве потребность не возникает. Иногда может отмечаться внутрисосудистый гемолиз в ответ на охлаждение (холодовая гемоглобинурия). Эта форма гемолитической анемии связана с действием гемолизинов сыворотки крови на эритроциты больного. Диагноз аутоиммунной гемолитической анемии устанавливают на основании общих признаков гемолиза (повышение уровня билирубина в крови или появление гемосидерина в моче, повышение процента ретикулоцитов в крови и обнаружение аутоантител на поверхности эритроцитов с помощью пробы Кумбса, которая бывает положительной почти в 60 % случаев аутоиммунного гемолиза). Критерии дифференциальной диагностики основных видов желтух представлены в табл. 2.
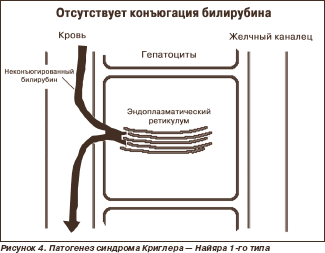
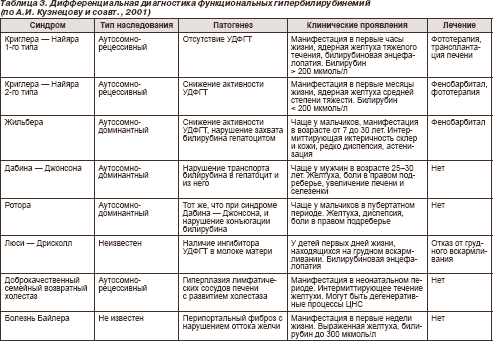
Доброкачественные (функциональные) гипербилирубинемии (пигментные гепатозы) — заболевания, связанные с наследственными нарушениями обмена билирубина (энзимопатиями), проявляющиеся хронической или перемежающейся желтухой без выраженного первичного изменения структуры и функции печени и без явных признаков гемолиза и холестаза Синдром Криглера — Найяра описан в 1952 г. американскими педиатрами J.F. Crigler и V.A. Najjar. Тип наследования — аутосомно-рецессивный. На молекулярном уровне дефект локализуется в одном из 5 экзонов (1А–5) гена уридиндифосфатглюкуронилтрансферазы (УДФГТ) 1*1. С равной частотой встречается у мальчиков и девочек. Патогенез — отсутствие (1-й тип — рис. 4) или снижение (2-й тип) активности УДФГТ.
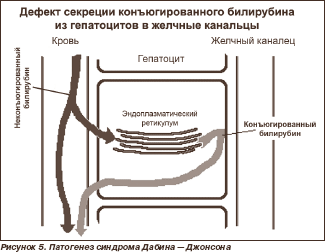
При синдроме Криглера — Найяра 1-го типа неконъюгированный билирубин в крови выше 200 мкмоль/л. Происходит накопление билирубина в ядрах серого вещества головного мозга, в результате чего развиваются судороги, опистотонус, нистагм, атетоз и т.д. Манифестация наступает в первые часы жизни, причем больные чаще погибают в течение первого года жизни от ядерной желтухи. Изменений печени (биохимических, гистологических) не обнаруживают. Проба с фенобарбиталом не дает результата (фенобарбитал индуцирует активность УДФГТ, но в связи с отсутствием этого фермента препарат не имеет точки приложения). При синдроме Криглера — Найяра 2-го типа манифестация наступает несколько позже — в первые месяцы жизни. Проявления сходны с синдромом 1-го типа, но менее тяжелые, так как УДФГТ присутствует в гепатоцитах, хотя активность ее значительно снижена. Уровень неконъюгированного билирубина в крови не достигает 200 мкмоль/л. Синдром Дабина — Джонсона описан в 1954 г. T.N. Dubin и G.D. Johnson. Тип наследования — аутосомно-доминантный. Частота — 0,2–1,0 %. Клинические проявления обычно развиваются у мужчин 20–30 лет. Патогенез заключается в несостоятельности АТФ-зависимой транспортной системы гепатоцитов (канальцев), в результате чего ухудшается транспорт билирубина в желчь и даже развивается его рефлюкс из гепатоцитов в кровь (рис. 5).
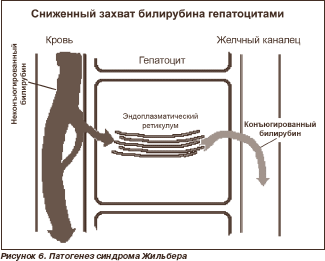
Клиника синдрома Дабина — Джонсона представлена постоянной желтухой без зуда или (редко) с небольшим зудом, болями в правом подреберье с периодическим усилением по типу желчных колик, выраженными диспептическими явлениями, утомляемостью, плохим аппетитом, субфебрилитетом, гепатомегалией. Возможна также спленомегалия. Диагностика синдрома Дабина — Джонсона основана на выявлении в крови конъюгированной и неконъюгиро-ванной (за счет деконъюгации и рефлюкса билирубина в кровь) гипербилирубинемии до 100 мкмоль/л, в моче — билирубинурии. Показатели щелочной фосфатазы обычно не изменены. Характерен подъем уровня бромсульфалеина в крови через 2 часа после введения. При холецистографии тень желчного пузыря отсутствует. Ухудшение, как правило, наступает на фоне беременности или приема пероральных контрацептивов. Макроскопически в ткани печени определяются темные пятна («шоколадная печень»), появление которых связывают с нарушением секреции метаболитов тирозина, триптофана, фенилаланина. Микроскопически выявляют грубые зерна пигмента липофусцина, которые накапливаются преимущественно в центре долек. Синдром Ротора описан в 1948 г. A.B. Rotor, L. Manahan, A. Forentin. Тип наследования — аутосомно-доминантный. Патогенез связан не только с нарушением экскреции билирубина (как при синдроме Дабина — Джонсона), но и с нарушением его захвата синусоидальным полюсом гепатоцитов. Чаще развивается у мальчиков в пубертатном периоде. Клиника сходна с синдромом Дабина — Джонсона. В крови определяется гипербилирубинемия до 100 мкмоль/л (в равной мере повышены показатели прямого и непрямого билирубина). Имеют место билирубинурия; нарушение поглощения бромсульфалеина печенью, но второй пик концентрации в крови, как при синдроме Дабина — Джонсона, отсутствует; при холецистографии желчный пузырь контрастируется. При биопсии печени накопление пигмента обнаруживают редко, более характерна мелкокапельная жировая дистрофия преимущественно по ходу желчных капилляров. Прогноз благоприятный. Синдром Люси — Дрисколл — редкий вариант наследственной гипербилирубинемии. Заболевание манифестирует у детей в первые дни жизни, но лишь у тех, которые находятся на грудном вскармливании. Развивается выраженная гипербилирубинемия, возможна билирубиновая энцефалопатия. Нарушение конъюгации билирубина обусловлено наличием в молоке матери ингибитора УДФГТ, поэтому прекращение грудного вскармливания приводит к выздоровлению. Синдром Аагенеса (норвежский холестаз) проявляется нарушением функций печени вследствие гипоплазии ее лимфатических сосудов с развитием холестаза. Манифестация обычно наступает в неонатальном периоде с возможными рецидивами у взрослых. Возможно интермиттирующее течение желтухи, сопровождающееся дефицитом витамина Е, вследствие которого возникают дегенеративные изменения ЦНС. Синдром Байлера (злокачественный семейный холестаз) — крайне редкий вариант генетически обусловленной гипербилирубинемии. Развивается на первой неделе жизни ребенка. В патогенезе имеют значение формирование перипортального фиброза и пролиферация желчных протоков, из-за которых развивается холестаз. Заболевание протекает с тяжелой желтухой (билирубин в крови достигает 300 мкмоль/л за счет прямого), гепато- и спленомегалией. Прогноз неблагоприятный. Первичная гипербилирубинемия — очень редкое заболевание, связанное с избыточным образованием рано меченного билирубина в костном мозге. Причиной считают преждевременное разрушение в костном мозге незрелых предшественников эритроцитов, т.е. неэффективный эритропоэз. В периферической крови разрушение эритроцитов происходит с обычной скоростью. Клинически заболевание проявляется компенсированным гемолизом. Синдром Жильбера описан в 1901 г. французскими терапевтами A. Gilbert и P. Lereboullet.
При синдроме Жильбера нарушены захват, транспорт и конъюгация билирубина. Имеют место (рис. 6): — недостаточность билитранслоказы, отвечающей за захват билирубина из крови и его транспорт в гепатоцит; — дефицит Y- и Z-протеинов-лигандов (фермента глутатион-S-трансферазы), отвечающих за перенос билирубина к микросомам; — дефицит УДФГТ, обеспечивающий перенос глюкуроновой кислоты к билирубину. Генетический дефект состоит в наличии на промоторном участке А(ТА)6ТАА гена, кодирующего УДФГТ, дополнительного динуклеотида ТА, т.е. образуется участок А(ТА)7ТАА. Тип наследования — аутосомно-доминантный. Различают врожденный вариант синдрома Жильбера, когда клинические проявления развиваются в возрасте 12–30 лет без предшествующего острого вирусного гепатита, и синдром Жильбера, клинические проявления которого манифестируют после перенесенного острого вирусного гепатита. В этом случае имеет место так называемая постгепатитная гипербилирубинемия. Причем она может быть связана не только с инициацией клинических проявлений генетического дефекта (с истинным синдромом Жильбера), но и с развитием хронического вирусного гепатита. То есть больные с постгепатитной гипербилирубинемией требуют тщательного наблюдения и проведения дифференциальной диагностики между синдромом Жильбера и хроническим вирусным гепатитом. При синдроме Жильбера соотношение мужчин и женщин составляет 3–4: 1. А. Жильбер описывал характерную триаду клинических проявлений: «печеночная маска» (желтуха), ксантелазмы век, периодичность симптомов. Типично усиление желтухи после инфекций, эмоциональной и физической нагрузки, приема анаболических стероидов, глюкокортикоидов, андрогенов, рифампицина, циметидина, левомицетина, стрептомицина, салицилата натрия, ампициллина, кофеина, этинилэстрадиола, парацетамола, т.е. после приема тех препаратов, в метаболизме которых участвует УДФГТ. Кроме того, желтуха может усиливаться после голодания, рвоты. Больные чувствительны к холоду, у них легко возникает «гусиная кожа». Редко обнаруживают пигментацию лица, пигментные пятна на коже. Обычными являются тяжесть в правом подреберье, диспептические явления, астеновегетативные расстройства. Так, А.И. Шатихин и соавт. (1997) при обследовании 7 больных обнаружили, что у всех пациентов выявлялись повышенная реактивная и личностная тревожность, плохое самочувствие и снижение активности. Обнаружены увеличение процентной представленности D сна; вегетативные показатели ночного сна и бодрствования не различались. Такие изменения психологической сферы и организации ночного сна, по мнению авторов, возникали первично в ответ на повышение содержания неконъюгированного билирубина вследствие его воздействия на гипоталамус. Повышение уровня неконъюгированного билирубина приводило также к биоритмологическим сдвигам, перестройке мотивационной сферы, сопровождавшейся повышенным уровнем тревожности, что способствовало развитию астенического синдрома. В 20 % случаев при синдроме Жильбера обнаруживают умеренное увеличение печени; в 30 % случаев — холецистит, в том числе калькулезный, холангит; в 42 % случаев — дисфункцию желчного пузыря и сфинктера Одди; в 12,5 % случаев — хронический гепатит аклогольной, вирусной этиологии, а также реактивный; в 7,4 % случаев — жировую дистрофию печени; в 0,7 % случаев — гемангиомы печени. По данным М.А. Коноваловой и соавт. (1999), при ультразвуковой холецистографии нормальная функция желчного пузыря отмечается в 29,3 %, дискинезия по гипермоторному типу — в 20,7 %, по гипомоторному типу — в 50 % случаев. При многомоментном дуоденальном зондировании те же авторы констатировали наличие у больных дискинезии желчевыводящих путей в 88 % случаев (с преобладанием гипомоторной дискинезии желчного пузыря — в 51,7 % случаев); нарушения функции сфинктера Одди — в 72,4 % случаев (гипотонус сфинктера — 39,7 % наблюдений, гипертонус — у 34,5 % обследованных). У 96 % больных выявлены изменения биохимического состава желчи, изменения показателей, характеризующих литогенность желчи: снижение холево-холестеринового коэффициента и холато-холестеринового индекса, повышение индекса литогенности. Авторы считают, что пациентов с синдромом Жильбера следует отнести в группу риска развития холелитиаза. При синдроме Жильбера в 30 % случаев повышен гемоглобин более 160 г/л, у 15 % пациентов выявляется легкий ретикулоцитоз, у 12 % — снижение осмотической стойкости эритроцитов. Увеличение содержания гемоглобина в крови связывают с его избыточным синтезом при повышенном уровне билирубина в крови и тканях. Вопрос о наличии скрытого гемолиза при синдроме Жильбера (ретикулоцитоз, снижение осмотической стойкости эритроцитов) является темой многолетнего обсуждения. Гипербилирубинемия не превышает 80–100 мкмоль/л со значительным преобладанием непрямой фракции. Возможно небольшое нарушение выведения бромсульфалеина, увеличение содержания в крови кишечной фракции щелочной фосфатазы. В ряде случаев синдром Жильбера сочетается с синдромами Марфана, Элерса — Данло. Разработаны и специальные тесты для диагностики синдрома Жильбера. Так, ограничение калорийности пищи до 400 ккал/сут или голодание в течение двух суток приводит к увеличению показателя свободного билирубина в крови. Внутривенное введение 40 мг никотиновой кислоты способствует снижению осмотической стойкости эритроцитов и увеличению уровня билирубина в крови. Прием фенобарбитала 3 мг/кг/сут в течение 5 дней при синдроме Жильбера инициирует снижение уровня билирубина в крови, так как препарат индуцирует активность УДФГТ. Применяют также рифампициновый тест: после введения 900 мг рифампицина у пациентов с синдромом Жильбера уровень билирубина в крови значительно повышается. Морфологически характерно накопление пылевидного золотисто-коричневого фермента липофусцина преимущественно в центре долек. Усиленное образование липофусцина считают приспособительным механизмом, так как этот пигмент является результатом реакции аутооксидации металлофлавопротеидов и является одним из источников энергии в гепатоците. Кроме того, при гистологическом исследовании у 20–24 % больных обнаруживают сопутствующую патологию печени различной тяжести. Синдром Мейленграхта до недавнего времени считали почти синонимом синдрома Жильбера, который нередко даже называли «синдром Жильбера — Мейленграхта». Однако позже было доказано, что это разные синдромы со сходной клинической картиной. Общим для двух синдромов являются снижение уровня билирубина при назначении активаторов микросомальных ферментов печени, возраст манифестации, интермиттирующий характер желтухи, уровень билирубина в крови не более 80–100 мкмоль/л за счет неконъюгированной фракции, клинические проявления в виде иктеричности кожи и слизистых, диспепсии, астении. Но при синдроме Мейленграхта имеет место только изолированное снижение активности УДФГТ, а мембрана гепатоцита, в отличие от синдрома Жильбера, активно участвует в захвате билирубина. Лечение сходно с лечением синдрома Жильбера, эффективен фенобарбитал. Чрезвычайно важна дифференциальная диагностика синдрома Жильбера с другими заболеваниями, сопровождающимися неконъюгированной гипербилирубинемией. Круг этих заболеваний достаточно широк, а тяжесть клинического течения и прогноза далеки от доброкачественности синдрома Жильбера. Так, А.И. Шатихин (1997) при обследовании больных с неконъюгированной гипербилирубинемией доказал, что в 46 % случаев она связана с вирусным гепатитом; в 30 % случаев — с алкогольным поражением печени; в 20 % случаев — с постгепатитной гипербилирубинемией, которая постепенно исчезала при длительном наблюдении за больными; в 2 % случаев — с гемолитической анемией и только у 2 % пациентов — с синдромом Жильбера. Дифференциально-диагностические критерии различных функциональных гипербилирубинемий представлены в табл. 3.
Так как желтуха это синдром, сопровождающий различные заболевания, ее следует лечить симптоматически, уделяя основное внимание лечению основного заболевания. Дата добавления: 2015-02-05 | Просмотры: 645 | Нарушение авторских прав |