|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Вирусы гепатитовЛекция № 8 Тема: «Вирусы. Морфология и физиология вирусов. РНК- и ДНК-содержащие вирусы. ВИЧ и СПИД». Вопросы: Морфология вирусов. Особенности репродукции вирусов. Профилактика вирусных заболеваний, особенности терапии. Основные методы диагностики вирусных инфекций. РНК-содержащие вирусы. Вирусы гриппа. Эпидемиология и патогенез гриппа. Иммунитет. Специфическая профилактика. ДНК-содержащие вирусы. Вирусы гепатитов. Эпидемиология и патогенез. Иммунитет. Специфическая профилактика. ВИЧ. СПИД. Актуальность вопроса. Эпидемиология и патогенез заболевания. Профилактика.
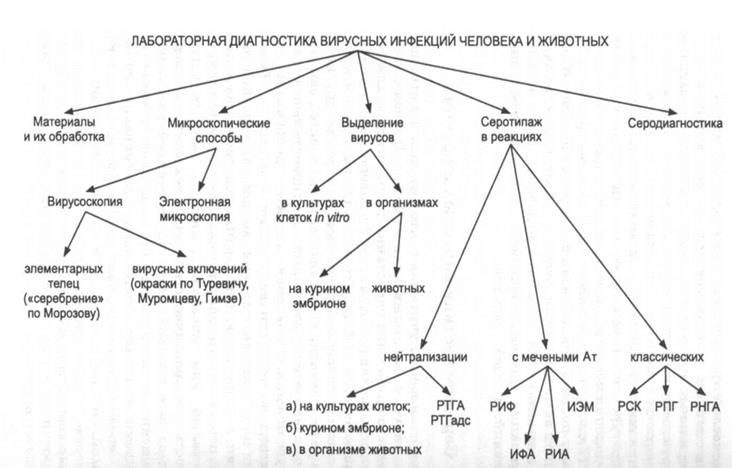
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ВИРУСНЫХ ИНФЕКЦИЙ ЧЕЛОВЕКА И ЖИВОТНЫХ Лабораторная диагностика вирусных инфекций человека и животных основана: 1) на прямых микроскопических методах обнаружения вирионов в патологических материалах; 2) серотипаже (идентификации) чистых культур вирусов, выделенных из них; 3) серодиагностике, т. е. косвенном способе определения вирусспецифичес-ких антител в сыворотке крови. При этом: материалы исследуются в иммерсионном, люминесцентном и электронном микроскопах; культуры вирусов получают, инфицируя материалами чувствительные к ним линии клеток, куриные эмбрионы и животных; идентификацию вирусов и определение вирусспецифических антител осуществляют в серологических реакциях. Патологические материалы и их обработка. Материалами, в которых содержатся вирусы, могут являться: кал, моча, мокрота, носоглоточные смывы, содержимое высыпаний на коже и слизистых оболочках и прочие экскреты; кровь, спинномозговая жидкость, пунктаты плевральной и брюшной полости, суставов, увеличенных лимфатических узлов и другие секреты. От умерших людей и погибших животных берут пораженные вирусами органы и ткани. Здесь нужно отметить, что взятые для исследования материалы при необходимости подвергаются специальной обработке для приготовления мазков и гистологических препаратов, а при инфицировании культур клеток, эмбрионов и животных - измельчаются, отстаиваются, фильтруются, осветляются, концентрируются и обрабатываются антибиотиками, которые уничтожают постороннюю (банальную) микрофлору, в большом количестве находящуюся в экскретах.
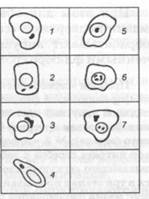
Рис. 10 9. Схематическое изображение вирусных включений: 1 - тельца Гуарниери в клетке, зараженной вирусом оспы; 2 - включения в цилиндрическом эпителии, зараженном вирусом гриппа; 3 — включения в эпителии, зараженном реовирусом; 4 — тельца Бабеша — Негри в нейроцитах; 5,6- внутриядерные включения в эпителии, зараженном герпес-и аденовирусом; 7 - внутриядерные и цитоплазматические включения в эпителии, зараженном вирусом кори
Используются два микроскопических способа выявления вирусов в материалах - вирусоскопия в иммерсионном и люминесцентном микроскопах и электронная микроскопия. Вирусоскопия. В иммерсионном световом микроскопе обнаруживаются самые крупные элементарные тельца. Так, при натуральной оспе в жидкости кожных пузырьков находят внеклеточные вирионы Пашена, а в таких же везикулах при ветряной оспе - вирионы Арагао. Легче при вирусных инфекциях обнаружить внутриклеточные включения. В большинстве своем они представлены скоплениями вирусов вперемежку с реактивными клеточными продуктами и в зависимости от места репликации вирионов находятся в цитоплазме или ядре клеток-хозяев. В частности, цитоплазматическими включениями являются тельца Гуарниери в эпителиальных клетках, скопления реовирусов и вирусов гриппа в них, тельца Бабеша - Негри - в нейроцитах, а ядерными включениями -адено-, папова- и герпесвирусные, правда, состоящие из клеточного материала. Изредка в одной и той же клетке вирусы, например коревой, формируют цитоплазматические и ядерные включения (рис. 109). По форме, размерам, структуре, отношению к красителям все эти и другие вирусные включения строго специфичны. Например, тельца Гуарниери имеют округлую, серповидную или амебоидную форму с диаметром 1-10 мкм, тельца Бабеша - Негри - овальные или эллипсоидные, достигающие 20 мкм, включения реовирусов - серповидные, наполовину охватывающие клеточное ядро, коревые включения - в виде почкующихся мелких дрожжей.
При этом для обнаружения телец Пашена и Арагао мазки подвергают «серебрению» по методу Морозова или обрабатывают вируснейтрализующими антителами, меченными флюорохромами. Проводя «серебрение», заранее готовят три раствора: № 1 - уксус-но-формалиновый фиксатор (100 мл дистиллированной воды + 1 мл ледяной уксусной кислоты + 2 мл 40 % -ного формалина); № 2 - танин-феноловая протрава (10 мл той же воды + 5 г танина + 1 мл жидкого фенола); № 3 - адсорбент (свежеприготовленный 5 % -ный раствор нитрата серебра с добавлением нескольких капель аммиака, вызывающего легкую опалесценцию). «Серебрение» мазков выполняется в три этапа с промыванием после каждого из них водопроводной водой: мазки фиксируются раствором № 1 в течение 1 мин; протравливаются раствором № 2 с подогревом до отхождения паров; «серебрятся» раствором № 3 с подогревом до появления темно-коричневого цвета. В высушенных мазках под иммерсионным микроскопом обнаруживают грозди кокковидных вирионов коричнево-черного цвета. В препаратах, обработанных мечеными антителами (см. «Реакцию иммунофлюоресценции»), при люминесцентной микроскопии обнаруживают вне- и внутриклеточно расположенные вирионы в виде светящихся точек и конгломератов. Внутриклеточные вирусные включения окрашивают по Туревичу, Муромцеву и Романовскому — Гимзе. Способ окраски телец Бабеша - Негри и Гуарниери по Туревичу. Препараты из срезов гиппокампа при бешенстве или роговицы зараженного кролика при оспе в течение 2 мин окрашивают вначале железным гематоксилином, вслед за чем промывают водой. Докрашивают 1 % -ным водным раствором кислого фуксина 1 мин и снова промывают водой. На последнем этапе препараты обрабатывают смесью из равных частей насыщенного водного раствора пикриновой кислоты и 95 % -ного спирта, быстро промывают, высушивают и на несколько секунд погружают в абсолютный спирт, вновь высушивают и микроскопируют. Способ окраски телец Бабеша - Негри по Муромцеву. Из растертых в ступке кусочков гиппокампа делают обычные мазки. Фиксируют их метиловым спиртом или ацетоном в течение 1-2 ч, промывают водой; затем 5-10 мин окрашивают разведенным 1: 50 красителем Мансона (2 г метиленового синего, 5 г буры и 100 мл дистиллированной воды), после чего переносят в 10 %-ный раствор танина до получения бледно-голубой окраски, промывают водой, высушивают; несколько секунд обрабатывают абсолютным спиртом, высушивают и микроскопируют. Окраска мазков по Романовскому - Гимзе осуществляется смесью азур-эозин-метиленового синего после их фиксации в метиловом (5 мин), этиловом (10-15 мин) спиртах или в смеси Никифорова (10-15 мин). Окрашивание длится от 20-30 мин до 1 ч. Тельца Бабеша - Негри по Туревичу окрашиваются в вишнево-красный цвет с черными зернами внутри, а цитоплазма нервных клеток, в которых они находятся - в светло-желтый; по Муромцеву - в бледно-фиолетовый, а цитоплазма клеток - в синий. Тельца Гуарниери, окрашенные по Туревичу, приобретают темно-синий цвет и тоже хорошо контрастируют в более светлой цитоплазме эпителия. По Романовскому - Гимзе ядра клеток окрашиваются в пурпурно-красный цвет, цитоплазма - в синий, а вирусные включения - в разные цвета и оттенки: тельца Бабеша - Негри, в частности, - в красный, включения вируса гриппа - в сине-фиолетовый, тельца Гуарниери - в пурпурно-красный, а реовирусов - в фиолетовый. Электронная микроскопия. В электронном микроскопе вирусы идентифицируют по тонким деталям их ультраструктуры. С этой целью получают микрофотографии. Для этого материал, содержащий вирусы, наносят на электронно-микроскопические сеточки, покрытые перлодиевой пленкой, и вирионы контрастируют 1 %-ным уранилацетатом или фосфорно-вольфрамовым натрием. Покрывая вирусы, эти вещества создают вокруг них темный фон, а проникая вглубь между компонентами вирионов, способствуют выявлению деталей их структуры. Наконец, конфигурация вирионов отчетливо отпечатывается на матрицах-репликах высохших пленок пластмассы, раствором которых они заливаются. Симметрию и распределение белковых субъединиц в блоке-ансамбле вирусных кристаллов изучают с помощью рентгеноструктурного анализа.
Выделение вирусов из биологических материалов Чаще всего вирусы выделяют из патологических материалов в культурах клеток и куриных эмбрионах, реже их культивируют в организме экспериментальных животных. Выделение вирусов в культурах клеток. В большинстве случаев вирусы человека и животных выделяют на Рис. 110 Культура клеток:
первичных культурах почек эмбрионов человека и обезьян или же на перевиваемых культурах клеток HeLa, Нер-2, KB, Vero, FL. При этом исследуемым материалом заражают лишь те из них, в которых под малым увеличением микроскопа наблюдается хороший рост клеток. Отсосав питательную среду, в каждую пробирку или флакон вносят по 0,1-0,2 мл материала, предварительно обработанного антибиотиками. После 30-60-минутного контакта материала с клетками его удаляют, покрывают свежей питательной средой и помещают в ультратермостат. О размножении вирусов в монослое судят по цитопатическому действию (рис. 110), выражающемуся в округлении и сморщивании клеток (пикорнавирусы), нарастающей деструкции пласта (герпесвирусы), нередко с первоначальной пролиферацией клеток (поксвирусы). Пикорнавирусы, герпесвирусы, многие тогавирусы, буньявиру-сы, разрушая монослой, образуют под агаровым покрытием бляшки («стерильные пятна»), каждая из которых представляет собой обособленную колонию вируса. При размножении некоторых вирусов образуются многоядерные клетки (парамиксовирусы, герпесвирусы). Целый ряд вирусов в цитоплазме и ядре формируют внутриклеточные включения округлой формы. Онкогенные вирусы вызывают трансформацию нормальных клеток в злокачественные, чему нередко предшествуют хромосомные изменения в ядрах монослоя. Пораженные инфекционными вирусами клетки обычно содержат огромное количество незрелых вирионов и их антигенов, которые выявляют с помощью флюоресцирующих антител. Если вирусы имеют большие размеры и, размножившись, отпочковываются от клеток, то в содержимом клеточного пласта под иммерсионным микроскопом, как уже отмечалось, удается обнаружить зрелые вирусные частицы. Размножение вирусов, не обладающих цитопатическим действием (ЦПД), можно установить с помощью реакции гемадсорбции, проявляющейся скучиванием добавленных эритроцитов на инфицированных клетках (рис. 111) вследствие наличия у многих вирусов гемагглютининов (миксовирусы, тогавирусы). Гемагглютинацию можно увидеть и невооруженным глазом на предметном стекле, прибавив к капле культуральной жидкости соответствующие эритроциты (рис. 112). Например, миксовирусы гемагглюти-нируют эритроциты 0 группы человека, а 60 % тогавирусов - эритроциты гусей. Ряд вирусов можно выявить по феномену интерференции, т. е. способности подавлять ЦПД другого вируса (вирусы лейкоза птиц интерферируют с вирусом саркомы Рауса). При этом, правда, надо исключить явление аутоинтерференции. Выделение вирусов в курином эмбрионе. Для выделения вирусов из материалов используются, главным образом, 7-11-дневные эмбрионы белых кур. Заражение производят на хорионаллантоисную оболочку (ХАО), в аллантоисную и амниотическую полости, желточный мешок и тело Перед заражением яйцо помещают в овоскоп и, установив жизнеспособность эмбриона и границы воздушного мешка, спиртом и йодом обрабатывают над ним скорлупу. Наиболее распространен путь введения материала на ХАО. Для этого сбоку от воздушного мешка ножницами снимают скорлупу и слегка надрывают скорлупную оболочку. Вследствие давления воздуха ХАО западает, и на нее шприцем наносят 0,1-0,2 мл исследуемого материала. Прокалывая ХАО и погружая иглу на 1-2 мм, тем же количеством материала заражают аллантоисную полость. Для введения материала в амниотическую полость сложенными бран-шами пинцета осторожно прокалывают хорионаллантоис, захватывают амниотическую оболочку, приподнимают и после введения в ее полость 0,05-0,10 мл материала, опускают. Отверстие в скорлупе закрывают стерильным покровным стеклом или стеклянным колпачком и заливают парафином. С меньшей долей вероятности в амниотическую полость удается ввести вирусный материал через прокол в центре тупого конца яйца, ориентируясь на местоположение эмбриона по его тени на скорлупе. Таким путем относительно легко удается заразить эмбрион в желточный мешок, поместив яйцо на подставку тупым конусом вправо и погружая иглу шприца на 3-4 см вглубь. Попав в желточный мешок, в него вводят 0,2-1,0 мл материала. Отверстие в скорлупе заливают каплей парафина. Зараженные эмбрионы помещают в термостат, в котором поддерживается определенная влажность. Время инкубации эмбрионов и температурный режим зависят от свойств исследуемого вируса. Так, ортомиксовирусы необходимо культивировать при температуре 33 °С, возбудитель натуральной оспы — не выше 38,5 °С и, как исключение, вирус вакцины - при 40 °С. Размножаясь в курином эмбрионе, вирусы на ХАО вызывают появление белесоватых куполообразных бляшек (поксвирусы), задержку развития и его гибель (тогавирусы), накопление в эмбриональных жидкостях гемагглютининов и других антигенов (орто- и некоторые парамиксовирусы). При вскрытии эмбрионов материал забирают в следующем порядке: 1) отсасывают аллантоисную, затем амниотическую жидкость; 2) разрезают ХАО и содержимое всего яйца выливают в чашку Петри; 3) отделяют амниотическую оболочку, эмбрион и желточный мешок, захватив его за пупочный канатик; 4) последней извлекают ХАО. При этом пытаются обнаружить макроскопические изменения на хорионаллантоисной и амниотической оболочках. Выделение вирусов в организме животных. В организме животных культивируют те вирусы, которые плохо или совсем не размножаются в культурах клеток и курином эмбрионе. При этом, выделяя коксаки-, тога- и арена-вирусы, материалом предпочтительнее заражать мышей-сосунков, а в случаях, требующих выделения онкогенных вирусов, - сосунков белых крыс и сирийских хомяков. Количественный выход (титр накопления) вирусов в организме животных во многом зависит от их тропизма и, следовательно, от путей инфицирования, определяющих возникновение и развитие вирусной инфекции. Поэтому, выделяя нейротропные вирусы (рабдо-, тога-, буньявиру-сы), патологический материал надо вводить под твердую мозговую оболочку или в вещество головного и спинного мозга. Респираторные вирусы выделяют путем интрана-зального заражения наркотизированных белых мышей (ортомиксовирусы), инокуляцией содержимого носоглотки в слизистую оболочку защечных мешков сирийских хомяков (аденовирусы), введением содержимого везикул в скарифицированную кожу и конъюнктиву глаза кроликов и морских свинок (покс- и герпесвирусы). Отдельные вирусы вызывают у животных развитие характерных параличей (лисса- и тогавирусы); специфические патогистологические изменения в тканях, например в межлопаточном буром жире (пикорна- и тогавирусы); образование папул и везикул на коже и коньюнктиве глаза (поксвирусы) и другие проявления. Изучив патогенные эффекты вирусов в клеточном монослое, курином эмбрионе и организме животного, выделенный вирус на заключительном этапе вирусологического исследования идентифицируют в серологических реакциях.
Серотипаж вирусов В серотипаже вирусов используют многие серологические реакции: РИФ, ИФА, РИА, иммуноферритиновую, РСК, РПГ, РНГП, но чаще всего реакцию нейтрализации (РН) вирусов, реакцию торможения гемагглютинации (РТГА) и реакцию торможения гемадсорбции (РТГадс), являющихся модификациями РН. РН и ее модификации. РН вирусов воспроизводится в трех вариантах: на культурах клеток; куриных эмбрионах; животных (рис. 114). В любом из них при ее постановке взвеси инфицированных вирусом клеток, жидкостей различных полостей куриного эмбриона или суспензий пораженных тканей животных смешивают с различными разведениями диагностической противовирусной сыворотки или, наоборот, разные разведения вируса добавляют к цельной неразведенной иммунной сыворотке. Смеси инкубируют в термостате в течение 1-2 ч при температуре 37 °С или помещают в холодильник на 18 ч при
температуре 4 °С, и вслед за этим заражают монослой клеток, куриные эмбрионы и животных. О нейтрализующей силе противовирусных антител на клеточном пласте судят по его нормальному развитию в течение 10-15 сут, а на куриных эмбрионах и животных - по выживанию и отсутствию изменений на ХАО (2-3 сут) и в тканях животных (5-7 сут). В тех случаях, когда идентифицируются вирусы, вызывающие обширную деструкцию клеточного пласта, РН ставят под агаровым покрытием. Для этого из флакона с монослойной культурой клеток удаляют питательную среду и заражают ее взвесью вируса. Через 30-60 мин после адсорбции вируса на клетках монослой покрывают 3 %-ным расплавленным агаром, содержащим лошадиную сыворотку, солевые добавки и как индикатор - нейтральный красный. Зараженную вирусом культуру клеток помещают в термостат. В контрольных флаконах при нормальном росте клеток в результате выделения ими метаболитов происходит подкисление среды и монослой равномерно окрашивается индикатором в розовый цвет. В опытных флаконах монослой пестрит — розовые участки клеток, не пораженные вирусами, перемежаются с мелкими беловатыми островками-бляшками различной конфигурации, специфичными для того или иного вируса. Идентификация вирусов по их цитопатическому и патогенному действию в РН требует длительного времени, немалых усилий и умения. Гораздо легче видовую принадлежность вирусов установить в РТГА или РТГадс, представляющих собой РН антисыворотками вирусных гемагглютининов. РТГА. Большинство вирусов обладают способностью агглютинировать определенные эритроциты. Так, вирусы гриппа и эпидемического паротита агглютинируют эритроциты кур, морских свинок, человека; вирус клещевого энцефалита - эритроциты барана; вирусы японского энцефалита - эритроциты однодневных цыплят и гусей; аденовирусы - эритроциты крыс, мышей, обезьян. В связи с этим для их обнаружения в материале больных или культурах клеток, эмбрионов и животных ставят реакцию гемагглютинации (РГА). Для этого в лунках плексигласовых планшет готовят двукратно возрастающие разведения вируссодержащих жидкостей в объеме 0,5 мл, добавляя к ним по 0,25 мл 2 %-ной взвеси эритроцитов, трижды отмытых изотоническим раствором натрия хлорида. Для контроля спонтанной агглютинации 0,5 мл эритроцитов смешивают с равным объемом изотонического раствора натрия хлорида. Смеси инкубируют в термостате при температуре 37 °С или в холодильнике при 4 °С, но можно оставить при комнатной температуре. Результаты РГА учитывают по характеру агглютинации эритроцитов через 30-60 мин, когда они полностью осаждаются в центре контрольной лунки, образуя плотный осадок в виде «пуговицы». Положительная реакция обозначается плюсами: «++++» - звездчатой формы осадок с фестончатыми краями в виде «зонтика», покрывающего всю лунку; «+++» -осадок с просветами; «++» - осадок с большими просветами; «+» - хлопьевидный осадок, окруженный зоной ском-кованных эритроцитов; «—» - такой же резко очерченный осадок эритроцитов, как и в контроле. При помощи РГА определяют также титр вируса или наибольшее его разведение, при котором еще наблюдается агглютинация эритроцитов, что соответствует одной гемагглютинирующей единице. Являясь группоспецифической, РГА не дает возможности определить видовую принадлежность вирусов. Их идентифицируют с помощью РТГА. Для ее постановки используют диагностические противовирусные сыворотки, которые в двукратно снижающихся концентрациях разводят в изотоническом растворе натрия хлорида и разливают по 0,25 мл. К каждому их разведению добавляют равное количество вируссодержащей жидкости, при типировании вируса гриппа, например, в четырехкратном титре (т. е. 4 гемагглютинирующие единицы). Контролем является взвесь вируса в изотоническом растворе натрия хлорида. Планшеты со смесью сывороток и вируса выдерживают в термостате 30 мин или при комнатной температуре 2 ч, затем в каждую из них добавляют по 0,5 мл 1 % -ной взвеси эритроцитов. Спустя 30-45 мин определяют титр вирус-нейтрализующей сыворотки, т. е. максимальное ее разведение, вызвавшее задержку агглютинации эритроцитов. РТГадс. По своей сути РТГадс является аналогом РТГА. Производится она на двух зараженных вирусами монослойных культурах клеток, одна из которых предварительно обрабатывается диагностической сывороткой, нейтрализующей вирусные гемагглютинины. В тот и другой монослой при ее постановке вводят 0,2 мл 0,4 %-ной взвеси отмытых изотоническим раствором натрия хлорида стерильных эритроцитов, чувствительных к гемагглю-тинирующему действию предполагаемого вируса. Пробирки ставят в наклонном положении на 30 мин в термостат при температуре 37 °С (или оставляют при комнатной температуре), затем помещают во вращающийся барабан для удаления неадсорбированных эритроцитов. Учитывают РТГадс, используя малое увеличение микроскопа. Ее считают положительной, если в опытном монослое, обработанном антисывороткой, отсутствует реакция гемадсорб-ции, а на интактном - отмечается диффузная или локальная реакция адсорбции эритроцитов в виде небольших скоплений, гроздей и розеток.
Серодиагностика вирусных инфекций
«Вирусы гепатитов» Вирусы гепатитов Таксономия. Выделено восемь видов (типов) вирусов, вызывающих гепатит, - А, В, С, D, Е, G, F и вирус TTV (transfusion transmited virus), из них идентифицированы и хорошо изучены первые шесть. Вирус гепатита В отнесен к роду Orthohepadnavirus сем. Hepadnaviridae, а пять других — в группу РНК-вирусов, в частности вирус А включен в род Hepatovirus сем. Picornaviridae; Е - в род Hepevirus сем. Caliciviridae, D - в род Deltavirus сем. Togaviridae; С и G - в род Hepacivirus сем. Flaviviridae. F- и TTV-вирусы в систематике вирусов определенного местоположения пока не нашли (более того, имеются сомнения в принадлежности их к гепатовирусам). По структуре генома и механизму передачи вирусы гепатитов подразделяют на две группы. 1. Вирусы с полноценным геномом и собственным механизмом репликации (А, В, С, Е) и дефектные вирусы-сателлиты, к которым относятся дельтавирус, зависимый от ортогепаднавируса В, и G-сателлит - от С-вируса. 2. Вирусы, передающиеся трансфузионным, инъекционным, перинатальным и половым путями (В, С, D, G и TTV) и вирусы с фекально-оральным механизмом передачи (А, Е и, предположительно, F). Клиника и эпидемиология вирусных гепатитов. Вирусные гепатиты - антропонозные инфекции. По этиологии и эпидемиологическим особенностям, среди них различают три клинические формы: 1) вирусный гепатит А (ВГА), который нередко называется инфекционным и эпидемическим; 2) вирусный гепатит В (ВГВ), или сывороточный гепатит; 3) вирусные гепатиты, клинически сходные с ВГА и ВГВ, вызываемые другими видами вирусов. Независимо от клинической формы ВГА и ВГВ протекают как острое или хроническое инфекционное заболевание, но часто проявляются как инаппарантная бессимптомная инфекция. Основными симптомами остротекущих ВГА и ВГВ являются интоксикация, увеличение пораженной печени с пожелтением конъюнктивы глазного яблока и кожных покровов, но в большинстве случаев регистрируются безжелтушные формы гепатитов. Те и другие, как правило, заканчиваются полным выздоровлением. ВГВ, правда, нередко осложняется массивным некрозом паренхимы печени, заканчивающимся смертельным исходом. В более отдаленные сроки другими опасными его исходами являются развитие цирроза печени и раковое перерождение. К таким же последствиям ведет развивающийся всегда хронически вирусный гепатит С, при котором, кроме желтухи, регистрируются артралгии, васкулиты, миокардиты, легочные поражения и др. Вирусы-сателлиты дельта и G вызывают гепатиты только совместно с В- и С-вирусами. При одновременном заражении человека В- и дельта-вирусом течение коинфекции относительно доброкачественное, но выздоровление затягивается, а при заражении дельта-вирусом инфицированных В-вирусом лиц микст-инфекция усугубляет процесс отечно-асцитическим синдромом и опасностью развития рака печени. Вызванный G-сателли-том и С-вирусом гепатит протекает так же, как гепатит С, и с теми же последствиями. Гепатит, вызванный Е-виру-сом, проявляется недомоганием и чаще всего протекает без желтухи. Источником инфекции является больной или вирусоноситель. Характерная особенность вирусных гепатитов — множественность факторов передачи. Так, гепатит А, как и кишечные инфекции, передается через зараженную вирусом воду и пищевые продукты, предметы домашнего обихода и производственной обстановки. Инфицирование возможно также воздушно-капельным путем. Болезнь проявляется после сравнительно непродолжительного инкубационного периода, длящегося 3-6 недель. Эпидемические вспышки ВГА чаще всего наблюдаются в летне-осенний период времени. Вирус гепатита В циркулирует в крови больных или носителей и редко выделяется с экскретами и мочой. В кровь инфицированных он проникает за 1-2 мес. до проявления болезни и в организме выздоровевших от гепатита персистирует многие месяцы и годы. Обнаруживается не только у реконвалесцентов, но и в крови никогда не болевших выраженным гепатитом. Распространение гепатита В обусловлено массовым проведением медицинских манипуляций, требующих инструментального обследования больных и парентерального введения им крови и лечебно-профилактических препаратов. С учетом сказанного понятно, почему этот гепатит называют не только сывороточным или посттрансфузионным, но и шприцевым. Возможны также вертикальная передача вируса от матери к плоду и инфицирование ВГВ половым путем. Возникает ВГВ после 2-6-месячного инкубационного периода. Механизм передачи инфекции при вирусных гепатитах Е и F таков же, как у ВГА, а у С, D, G и TTV - как у ВГВ. Биологические особенности вирусов гепатита. Ультраструктура и антигены. Вирусы гепатитов имеют сферическую форму. У РНК-содержащих вирусов диаметр варьирует от 25-27 нм (вирион А), до 35-38 (Е и D), достигая 50 нм (С). Пикорнавирусы А и калицивирионы Е -простые вирусы, тогавирусы D и флавивирионы С и G -сложные. Геном А, Е и С вирионов представлен линейной нефрагментированной +РНК, а у дельта - кольцевой. Нуклеокапсид их организован по типу кубической симметрии. Основным антигеном вируса гепатита А является HA-Ag. Антигены других РНК-вирусов гепатитов изучены недостаточно. Сложное строение имеют вирионы ортогепаднавируса, или частицы Дейна. Как и другие вирусы гепатитов, они имеют округлую форму с диаметром 42,5 нм. В сердцевине частицы Дейна, окруженной белковой мембраной, содержится геном вируса, представленный циркулярно-замкнутой ДНК с недостроенным на треть длины участ-
Все три антигена частиц Дейна индуцируют в организме больных гепатитом В и вирусоносителей выработку антител, но больше всего их продуцируется по отношению к HBsAg как к самому сильному иммуногену. К тому же он вырабатывается в таком избытке, что часто полностью не аккумулируется вирионами и, проникая в кровь, циркулирует в виде пустотелых сферических (20 нм) и трубчатых (220-400 х 20 нм) микроструктур. Нередко частицы Дейна в крови отсутствуют, a HBsAg находится в высоких титрах. Объясняют это явление тем, что геном вируса гепатита В может интегрироваться с геномом гепатоцитов, и в этих случаях с провируса считывается только частичная информация, т. е. способность продуцировать HBsAg. При этом допускается, что с провируса считывается также информация, изменяющая антигенную структуру гепатоцитов с последующим развитием аутоиммунного патологического процесса, исходом которого может явиться некроз печени, переход острой формы болезни в хроническую, развитие цирроза и рака печени. В связи с этим большой интерес представляет еще и то, что у больных гепатитом В с такими осложнениями и исходами в сыворотке крови зачастую обнаруживаются антитела к четвертому, наименее изученному HBxAg частиц Дейна и дефектному дельта-вирусу, предположительно опосредующим антигенную трансформацию клеток печени, в том числе злокачественное их перерождение. Резистентность вирусов. Вирус гепатита А и другие РНК-вирусы гепатитов, не имеющие внешней оболочки, устойчивы к эфиру и детергентам. Они длительно сохраняются при низких температурах и нагревании до 60 °С, устойчивы к хлору, инактивируются при кипячении, действии сухого жара и дезинфицирующих веществ. Вирус гепатита В тоже высокоустойчив, длительно сохраняется в сыворотке, плазме, донорской крови и с трудом инактивируется при кипячении. Культивирование. К заражению вирусами гепатитов чувствительны шимпанзе и некоторые другие приматы, но в практике биологический эксперимент не используют. Для выделения вируса гепатита А пригодны лишь лейкоцитарные и органные культуры. Вирус гепатита В культивируется в монослое человеческих гепатоцитов, где образуются как вирусные частицы, так и их антигены. Иммунитет. Восприимчивость к вирусным гепатитам абсолютна, однако, новорожденные от переболевших матерей наследуют иммунитет, сохраняющийся до 1 года, что определяется передачей антител через плаценту. Высокая устойчивость к вирусным гепатитам у взрослых людей обусловлена скрытой иммунизацией при повторных контактах с вирусами, а в целом - коллективным иммунитетом. Приобретенный иммунитет после гепатита А сохраняется пожизненно. Стойкая невосприимчивость к повторному заболеванию формируется также после перенесенного гепатита Е. Напротив, у переболевших гепатитом В постинфекционный иммунитет - малонапряженный и сравнительно непродолжительный, но реинфекции относительно редки (около 6,5 %). Перекрестного иммунитета между разными нозологическими формами гепатита не создается, что свидетельствует о резких различиях в антигенной структуре вирусов, которые их вызывают. Лабораторная диагностика. Поскольку выделить вирусы гепатита из патологических материалов больных крайне трудно, их дифференциация основана на использовании серологических способов выявления специфических антигенов, антител и вирусных РНК. В частности, диагностика ВГВ построена на определении в сыворотке крови больных HBsAg и антител к ним. Обнаруживаются HBsAg в острой стадии заболевания, правда, не у всех больных, а только у большинства (55-70 %); исчезают при выздоровлении, но у части переболевших могут сохраняться в крови многие месяцы. Антитела к HBsAg обнаруживаются в крови только через несколько месяцев от начала болезни. HBsAg и специфические антитела к ним определяют в РПГ и реакции встречного иммуноэлектрофореза, ИФА и РНГА. При отрицательных результатах прибегают к выявлению антител к HBcAg, которые удается обнаружить лишь на стадиях завершения инфекционного процесса и выздоровления больных. Диагностика всех других вирусных гепатитов основана на выявлении вирусспецифичес-ких IgM методом ИФА или РИА. Продуцируются они, однако, медленно и в крайне низких титрах. Ранние IgM к вирусам Е и G обнаруживаются с 10-15-х сут после инфицирования, к дельта-вирусу - спустя 10-15 сут после заболевания, а к С-вирусу - через 3 мес. от его начала. Вирусные РНК и ДНК идентифицируются с помощью полимеразной цепной реакции и методом молекулярной гибридизации. Профилактика и лечение. В комплексе мер общей профилактики ВГА предусматриваются соблюдение личной и общественной гигиены, своевременная изоляция больных, текущая и заключительная дезинфекция, направленные на прерывание многочисленных путей фекально-орального механизма передачи инфекции. Проводившаяся ранее пассивная профилактика иммуноглобулином ВГА у детей оказалась безуспешной. В настоящее время с целью его профилактики применяют вакцины Геп-А-ин-Вак (Россия), Вакта (США), Хаврикс (Бельгия), Аваксим (Франция), содержащие разные штаммы вируса гепатита А, инактивирован-ные формалином и адсорбированные на гидроксиде алюминия. При этом российская и американская вакцины выпускаются во флаконах, а бельгийская и французская, кроме того, в шприцах. Все они используются по эпидемическим показаниям и взрослым вводятся внутримышечно в дельтовидную мышцу по 0,5-1 мл, а детям - в переднебоко-вую область бедра по 0,25-0,5 мл, применяя для годовалых вакцину Хаврикс, для двухлетних - Вакта или Аваксим, а для трехлетних детей — Геп-А-ин-Вак. Создание прочного иммунитета достигается повторными прививками. Например, ревакцинация Геп-А-ин-Вак у взрослых проводится спустя 1 и 6 мес, а у детей - через 1 мес. Для специфической профилактики ВГВ широко используются несколько рекомбинантных вакцин, в частности жидкие вакцины для парентерального введения H-B-VAX II и Engerix-A, представляющие собой адсорбированные на гидроксиде алюминия очищенные HBsAg, извлеченные из культуры рекомбинантного штамма Saccharomyces cerevisiae, в геном которого встроен кодирующий его ген гепаднавируса. По защитному эффекту они идентичны вакцинам из плазменного HBsAg, но, в отличие от них, не вызывают аллергических реакций. Обладают высокой иммуногенностью и хорошо переносятся даже новорожденными. Вакцины вводятся внутримышечно, но не в ягодичную область, как обычно, а в дельтовидную мышцу, где они лучше рассасываются. Детей по календарю профилактических прививок иммунизируют в первые сутки с момента рождения, через 1 мес. и в 5-месячном возрасте, каждый раз вводя им по 0,5 мл вакцины, содержащей 2,5 мкг HBsAg (H-B-VAX II) или 10 мкг HBsAg (Engerix-A). Ревакцинацию проводят в 13 лет одной инъекцией вакцины, содержащей вдвое больше HBsAg. Взрослых иммунизируют дозами 10 мкг HBsAg (H-B-VAX II) и 20 мкг HBsAg (Engerix) тоже трижды, с интервалом 1 мес. после первой инъекции, а после второй -2 мес. Общая профилактика обеспечивается использованием одноразовых шприцев и систематическим контролем крови доноров на наличие HBsAg. Специфическая профилактика вирусных гепатитов С, D, Е, G не разработана. Полагают, что вакцина против гепатита В создает иммунитет также против гепатита D. В качестве этиотропных препаратов для лечения вирусных гепатитов используют рекомбинантные интерфероны, в частности реаферон, фоскарнет, рибавирин и ламивудин, ингибирующие ДНК-полимеразу вируса гепатита В. Патогенетическая терапия строится с учетом клинических форм и стадий заболевания. Так, больным легкими формами вирусного гепатита назначают щадящую, полноценную и калорийную диету, рекомендуют витамины и обильное питье. При среднетяжелых формах болезни внутривенно вводят большие количества дезинтоксикационных средств. При тяжелой интоксикации показаны инфузии плазмы, цельной одногруппной резус-совместимой крови, преднизолон и другие гормоны, а в случае гепатодистрофии - антибиотики для подавления гнилостной микрофлоры кишечника и защиты печени от их эндотоксинов.
«ВИЧ» Дата добавления: 2015-11-26 | Просмотры: 1259 | Нарушение авторских прав 12 |
 Микроскопические способы обнаружения вирусов
Микроскопические способы обнаружения вирусов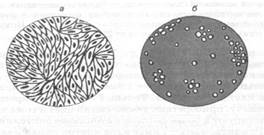 а-нормальный рост; б-ЦПД вируса
а-нормальный рост; б-ЦПД вируса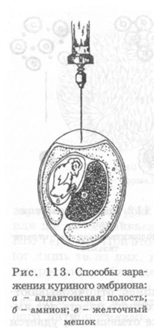 зародыша (рис. 113). При этом выбор пути инфицирования определяется специфическими свойствами вирусов.
зародыша (рис. 113). При этом выбор пути инфицирования определяется специфическими свойствами вирусов.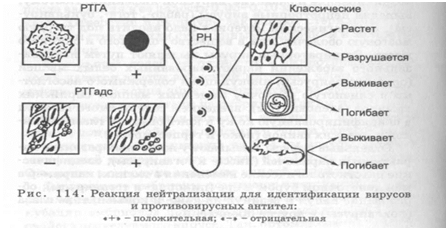
 Прибегая к ней, учитывают, что антитела по отношению к вирусам вырабатываются медленно. В связи с этим исследуется динамика нарастания титра антител, для чего серологические реакции ставят с сыворотками, одна из которых берется от больного в разгаре вирусной инфекции, скажем, спустя 5-7 сут от начала, а другая (другие) -через 2-3-4 недели, когда титр антител у детей закономерно удваивается, а у взрослых - достигает четырехкратного увеличения. Основанная на этой методологии серодиагностика по точности не уступает серотипажу, более проста по технике выполнения, но природа вирусной инфекции с ее помощью устанавливается чаще всего уже после перенесенного заболевания. И тем не менее ретроспективный, или запоздалый, диагноз имеет большую ценность для практического врача в тех случаях, когда вслед за перенесенной вирусной инфекцией возникают осложнения, а для эпидемиолога - при разработке противоэпидемических мер, исключающих рассеивание инфекции. Серодиагностика осуществляется с помощью тех же реакций, которые применяются для серотипажа вирусов; в качестве антигена используются производственные вирусные диагностикумы, взвеси вирусных культур и даже сыворотки выздоравливающих больных, содержащие вирусные антигены.
Прибегая к ней, учитывают, что антитела по отношению к вирусам вырабатываются медленно. В связи с этим исследуется динамика нарастания титра антител, для чего серологические реакции ставят с сыворотками, одна из которых берется от больного в разгаре вирусной инфекции, скажем, спустя 5-7 сут от начала, а другая (другие) -через 2-3-4 недели, когда титр антител у детей закономерно удваивается, а у взрослых - достигает четырехкратного увеличения. Основанная на этой методологии серодиагностика по точности не уступает серотипажу, более проста по технике выполнения, но природа вирусной инфекции с ее помощью устанавливается чаще всего уже после перенесенного заболевания. И тем не менее ретроспективный, или запоздалый, диагноз имеет большую ценность для практического врача в тех случаях, когда вслед за перенесенной вирусной инфекцией возникают осложнения, а для эпидемиолога - при разработке противоэпидемических мер, исключающих рассеивание инфекции. Серодиагностика осуществляется с помощью тех же реакций, которые применяются для серотипажа вирусов; в качестве антигена используются производственные вирусные диагностикумы, взвеси вирусных культур и даже сыворотки выздоравливающих больных, содержащие вирусные антигены. ком в одной ее цепи, вирусспецифическая ДНК-полимераза, достраивающая дефектную нить ДНК-вириона при репродукции в гепатоцитах, и два антигена(Ag): НВс (cor- конъ-югированный), вмонтированный в ее мембрану, и НВе (envelop - свернутый), обособленный от нее. Во внешней оболочке частицы Дейна содержится антиген HBs (superficial - поверхностный), включающий два полипептидных фрагмента: ргеS1-иммуноген и ргеSз-рецептор, с помощью которого вирус адсорбируется на гепатоцитах (рис. 120).
ком в одной ее цепи, вирусспецифическая ДНК-полимераза, достраивающая дефектную нить ДНК-вириона при репродукции в гепатоцитах, и два антигена(Ag): НВс (cor- конъ-югированный), вмонтированный в ее мембрану, и НВе (envelop - свернутый), обособленный от нее. Во внешней оболочке частицы Дейна содержится антиген HBs (superficial - поверхностный), включающий два полипептидных фрагмента: ргеS1-иммуноген и ргеSз-рецептор, с помощью которого вирус адсорбируется на гепатоцитах (рис. 120).