|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Амінокислоти. Білки
Опорний конспект Амінокислоти — це органічні сполуки, що містять карбоксильну -СООН та аміногрупу -NН2.
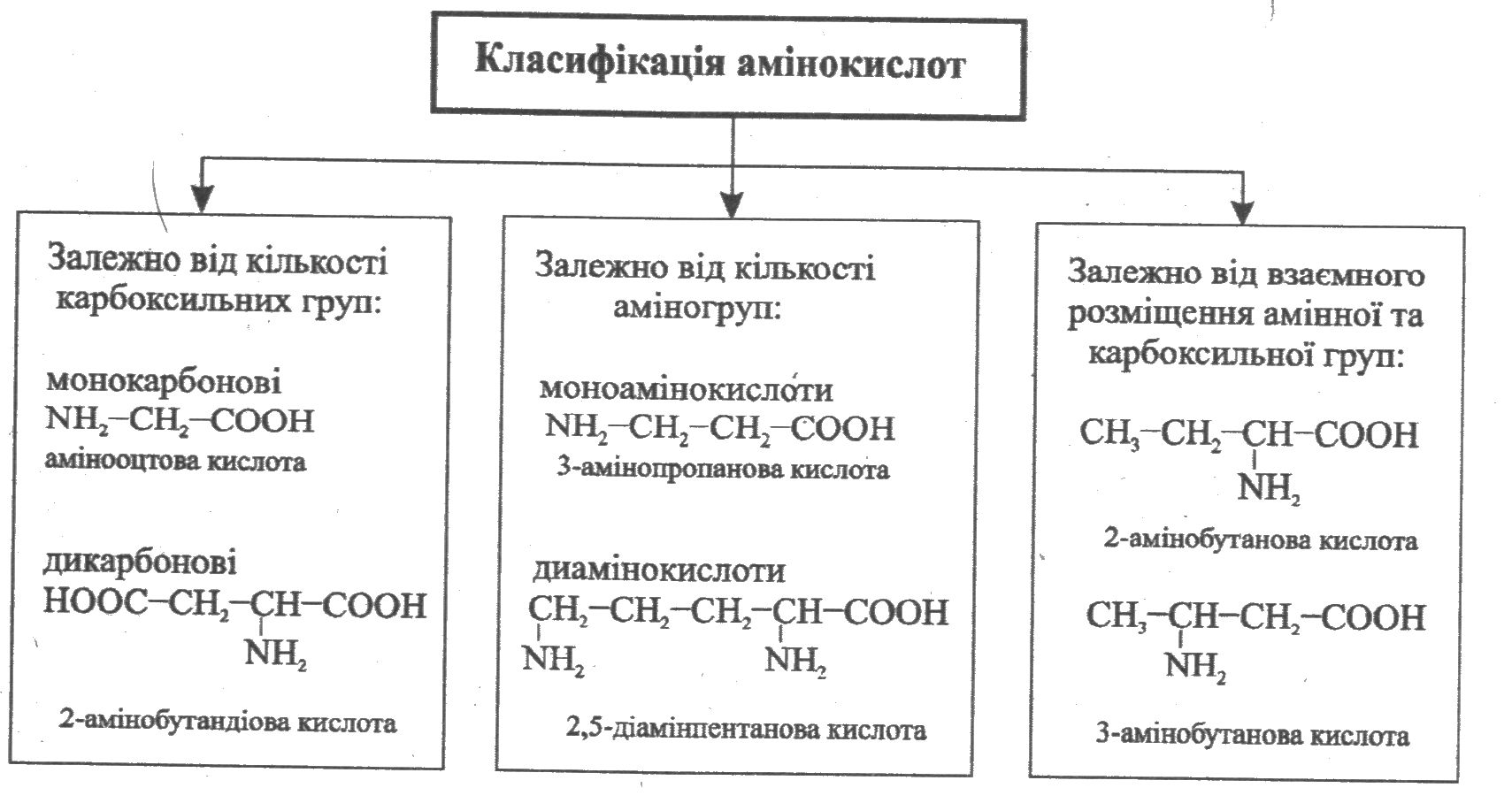
Крім зазначених критеріїв; амінокислоти відрізняються: а) будовою карбонового ланцюга: • розгалужені, нерозгалужені; • насичені, ненасичені; • ациклічні, циклічні, ароматичні; б) наявністю і розміщенням галогенів та інших характеристичних груп (гідроксильної -ОН, сульфанільної -SН, метилсульфанільної –СН3S, дисульфідної -S-S-, амідної (пептидної); в) співвідношенням кількості карбоксильних та аміногруп (які визначають рН речовини): • кислі (кількість карбоксильних більша за кількість аміногруп); • нейтральні (кількість карбоксильних дорівнює кількості аміногруп); • основні (кількість карбоксильних менша за кількість аміногруп); г) полярністю зв'язків бічних ланцюгів (полярні, неполярні); д) замінністю для людського організму (замінні, незамінні) тощо. Номенклатура найпростіших ациклічних амінокислот, які мають по одній карбоксильній та аміногрупі, допускає використання як систематичних, так і традиційних назв з позначенням локантів буквами грецького алфавіту α, β, γ, δ, ε тощо. Слід мати на увазі, що при цьому перелік локантів починають з найближчого до карбоксильної групи атома Карбону:
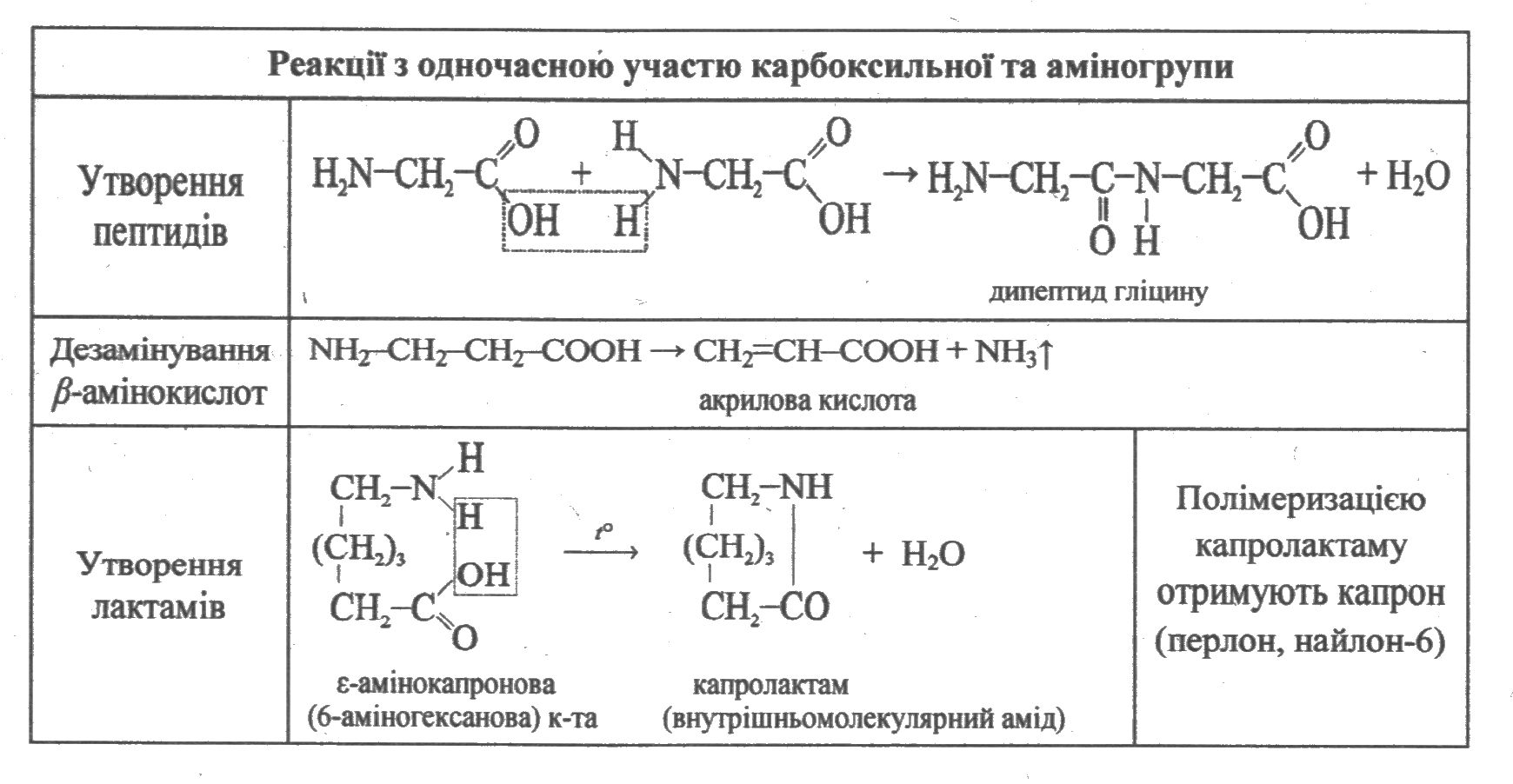
Хімічні властивості амінокислот Амінокислоти — це типові амфотерні сполуки: реагують і з основами, і з кислотами.
Дата добавления: 2015-12-15 | Просмотры: 772 | Нарушение авторских прав |
 Молекули амінокислот існують у вигляді біполярних іонів (цвіттер-іонів). Біполярний іон — це своєрідна внутрішньомолекулярна сіль, яка утворюється внаслідок переходу протона (H+) від карбоксильної до аміногрупи. Ось чому індикатор фіксує нейтральне середовище в розчинах нейтральних амінокислот. Найбільше значення мають α-амінокислоти. їх загальна формула має такий вигляд:
Молекули амінокислот існують у вигляді біполярних іонів (цвіттер-іонів). Біполярний іон — це своєрідна внутрішньомолекулярна сіль, яка утворюється внаслідок переходу протона (H+) від карбоксильної до аміногрупи. Ось чому індикатор фіксує нейтральне середовище в розчинах нейтральних амінокислот. Найбільше значення мають α-амінокислоти. їх загальна формула має такий вигляд: Усі α-амінокислоти (крім найпростішого гліцину) мають асиметричний атом Карбону, тому їм, як і багатьом іншим органічним речовинам, властива оптична ізомерія. Усі амінокислоти, синтезовані живими організмами — це L-амінокислоти. Із часом в організмі відбувається повільна рацемація (вирівнювання концентрацій L- та D- форм у розчині; у даному випадку — перетворення L- форми на D- форму). Для 20 білкових (протеїногенних) α-амінокислот у біохімії широко використовують історичні назви.Десять амінокислот (триптофан, лейцин, ізолейцин, лізин, метіонін, фенілаланін, треонін, валін, аргінін, гістидин) належать до незамінних, їх людина одержує винятково з їжею, вони не синтезуються в організмі людини (для кожного виду тварин існує свій список незамінних амінокислот). Деякі замінні амінокислоти організм виробляє недостатньо, отже їх синтез також повинен доповнюватись надходженням зовні
Усі α-амінокислоти (крім найпростішого гліцину) мають асиметричний атом Карбону, тому їм, як і багатьом іншим органічним речовинам, властива оптична ізомерія. Усі амінокислоти, синтезовані живими організмами — це L-амінокислоти. Із часом в організмі відбувається повільна рацемація (вирівнювання концентрацій L- та D- форм у розчині; у даному випадку — перетворення L- форми на D- форму). Для 20 білкових (протеїногенних) α-амінокислот у біохімії широко використовують історичні назви.Десять амінокислот (триптофан, лейцин, ізолейцин, лізин, метіонін, фенілаланін, треонін, валін, аргінін, гістидин) належать до незамінних, їх людина одержує винятково з їжею, вони не синтезуються в організмі людини (для кожного виду тварин існує свій список незамінних амінокислот). Деякі замінні амінокислоти організм виробляє недостатньо, отже їх синтез також повинен доповнюватись надходженням зовні