|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Кислая фосфатаза
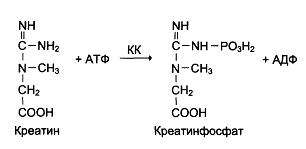
Креатинкиназа Креатинкиназа (КК) катализирует обратимую реакцию образование и распада креатинфосфата – вещества, которое участвует в запасании энергии.
Фермент КК представлен 3 изоферментами, которые различаются по электрофоретической подвижности. КК1 – присутствует в значительных количествах в мозге, желудке легких, щитовидной железе. КК2 – находится в основном в сердечной мышце. КК3 - присутствует в основном в скелетных мышцах. Креатинкиназа-МВ- изофермент креатинкиназы, характерный для ткани сердечной мышцы. Катализирует обратимый перенос фосфорильного остатка с АТФ на креатин и с креатинфосфата на АДФ. Молекула креатинкиназы-МВ состоит из двух различных субъединиц - В и М. Содержится исключительно в миокарде. Определение активности МВ-изофермента креатинкиназы имеет большое значение при диагностике инфаркта миокарда и мониторинге постинфарктного состояния, позволяя оценить объем поражения и характер восстановительных процессов. Креатинкиназа играет основную роль в ранней диагностике инфаркта миокарда (особенно МВ-фракция), а также в диагностике заболеваний скелетных мышц (например, при прогрессирующей мышечной дистрофии, миопатии, дерматомиозите). Биохимический анализ крови КФК позволяет обнаружить увеличение активности креатинкиназы через 4-8 часов после инфаркта миокарда, максимум достигается через 12-24 часа, снижение уровня происходит через 2-4 дня. А-амилаза Альфа-амилаза является ферментом, катализирующим расщепление высокомолекулярных углеводов (крахмала и гликогена) до моно- и дисахаридов (мальтозы и глюкозы). Наибольшее количество a-амилазы находится в слюнных железах и поджелудочной железе. a-Амилаза также высокоактивна в маточных трубах, паренхиматозных органах (печень, почки, легкие), в стенке кишечника, а также в жировой ткани. В норме активность a-амилазы крови на 60% обусловлена a-амилазой слюнных желез и на 40% - a-амилазой поджелудочной железы. Активность данного фермента в медицинской практике определяется в сыворотке крови и в моче, реже - в дуоденальном содержимом. Повышение активности a-амилазы в плазме крови наблюдается: при остром и хроническом панкреатите, заболеваниях почек. Снижена амилаза при панкреонекреозе, инфаркте миакарда. Гамма-глутамилтранспептидаза Микросомальный фермент, который встречается во многих паренхиматозных органах, участвует в обмене аминокислот. Функции. Катализирует перенос гамма-глутамилового остатка с гамма-глутамилового пептида на аминокислоту или другой пептид, или на иную субстратную молекулу Основными органами локализации фермента являются почки (в 7000 раз выше, чем в сыворотке крови), печень (в норме - в 200-500 раз больше, чем в сыворотке) и поджелудочная железа. Незначительная активность ГГТ регистрируется также в кишечнике, мозге, сердце, селезенке, простате и скелетных мышцах. В клетке фермент локализован в мембране, лизосомах и цитоплазме, причем мембранная локализация ГГТ характерна для клеток с высокой секреторной, экскреторной или (ре)абсорбционной способностью. Активность ГГТ сыворотки обычно связана с экскрецией синтезируемого в печени фермента и в норме незначительна. Однако при заболеваниях печени и желчевыводящих путей неизменно определяется повышенная активность фермента в сыворотке. Повышение уровня ГГТ: 1. Внутри- и внепеченочный холестаз (например, механическая желтуха при опухолях печени, при холангите, камнях в желчном пузыре); 2. Острый вирусный гепатит, токсическое, радиационное поражение печени (ГГТ дает возможность ранней диагностики); 3. Хронический гепатит; 4. Острые и хронические панкреатиты; 5. Прием гепатотоксичных препаратов (барбитураты, фенитоин, рифампицин, цефалоспорины, эстрогены, оральные контрацептивы, ацетоаминофен); 6. Алкоголизм; 7. Патология почек (обострения хронических гломеруло - и пиелонефрита); 8. Рак поджелудочной железы, простаты, гепатомы. Фосфатазы В зависимости от природы активной группы фермента фосфатазы делятся на два типа: цистеин-зависимые фосфатазы и металлофосфатазы. Типичным представителем группы фосфатаз является щелочная и кислая фосфатаза, широко используемая в диагностических и лабораторных целях. Фосфатаза щелочная -фермент, участвующий в реакциях обмена фосфорной кислоты, с оптимумом рН 8,6 - 10,1. Функции. Катализирует гидролиз сложных эфиров фосфорной кислоты и органических соединений. Самая высокая концентрация ЩФ обнаруживается в костной ткани (остеобластах), гепатоцитах, клетках почечных канальцев, слизистой кишечника и плаценте. ЩФ участвует в процессах, связанных с ростом костей, поэтому активность ее в сыворотке детей выше, чем у взрослых. Патологическое повышение активности ЩФ в сыворотке связано, в основном, с заболеваниями костей (формированием костной ткани) и печени (обструкцией желчных протоков). У недоношенных, детей в период активного роста, беременных (третий триместр) может наблюдаться повышенная физиологическая активность ЩФ. Повышение уровня ЩФ: 1. Патология костной ткани (с повышением активности остеобластов или распадом костной ткани): болезнь Педжета (деформирующий остеит), остеомаляция, болезнь Гоше с резорбцией костей; 2. Рахит; 3. Остеосаркомы и метастазы злокачественных опухолей в кости; 4. Заболевания печени (цирроз, некроз печеночной ткани, первичная гепатокарцинома, метастатический рак печени, инфекционные, токсические, лекарственные гепатиты, саркоидоз, туберкулез, паразитарные поражения); 5. Внутри- и внепеченочный холестаз (холангиты, камни желчных протоков и желчного пузыря, опухоли желчевыводящих путей); 6. Нарушения питания (недостаток кальция и фосфатов в пище); 7. Инфекционный мононуклеоз; 8. Физиологическое (у недоношенных, детей в период быстрого роста, у женщин в последнем триместре беременности и после менопаузы); 9. Прием гепатотоксичных препаратов (метотрексат, хлорпромазин, антибиотики широкого спектра действия, сульфаниламиды), больших доз витамина С, магнезии.
Понижение уровня ЩФ: Ø Наследственная гипофосфатаземия (рецессивное аутосомальное заболевание, характеризующееся нарушением кальцификации кости. Концентрация кальция и фосфора в сыворотке нормальная, но очень низкая активность ЩФ в сыворотке и костях); Ø Нарушения роста кости (ахондроплазия, кретинизм, дефицит аскорбиновой кислоты); Ø Гипотиреоз; Квашиоркор; Ø Недостаток цинка и магния в пище; Ø Прием эстрогенов, оральных контрацептивов, даназола, азатиоприна, клофибрата. Кислая фосфатаза Кислая фосфатаза содержится почти во всех органах и тканях человека, особенно в клетках крови, предстательной железе, печени, почках, костях. Фермент обнаружен также в женском молоке. Активность кислой фосфатазы в предстательной железе в 100 раз выше, чем в других тканях. У мужчин половину содержащейся в сыворотке кислой фосфатазы вырабатывает предстательная железа, остальную часть — печень и разрушающиеся тромбоциты и эритроциты. У женщин фермент вырабатывается печенью, эритроцитами и тромбоцитами. Кислая фосфатаза не является гомогенным ферментом. Большинство тканей содержит два или более изоферментов, отличающихся по своим свойствам. Определение активности кислой фосфатазы в клинической практике обычно проводится для диагностики рака предстательной железы. Активность кислой фосфатазы повышается при массивном разрушении тромбоцитов (тробоцитопения, тромбоэмболии и др.), гемолитической болезни, прогрессирующей болезни Педжета, метастатическом поражении костей, миеломной болезни (не всегда), болезни Гоше и Нимана—Пика. Дата добавления: 2015-12-15 | Просмотры: 1062 | Нарушение авторских прав |