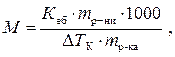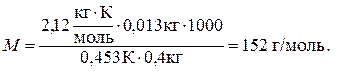|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Правильні відповіді. 1. Величина осмотичного тиску плазми крові обумовлена вмістом електролітів, концентрацією низькомолекулярних неелектролітів і біополімерів1. Величина осмотичного тиску плазми крові обумовлена вмістом електролітів, концентрацією низькомолекулярних неелектролітів і біополімерів. Вирішальну роль відіграють катіони та аніони електролітів. Осмотичний тиск крові людини при 37°С досягає величини 770 ̶ 821 кПа. Внесок колоїдних частинок та біополімерів (онкотичний тиск) значно менший ̶ 3,04 ̶ 4,05 кПа (0,5%). Постійність осмотичного тиску в крові людини регулюється шляхом виділення парів води при диханні, роботою нирок, виділенням поту тощо.
2. Ізотонічний коефіцієнт Вант - Гоффа дозволяє врахувати вплив на колігативні властивості розчинів збільшення кількості частинок у розчинах електролітів, що відбувається внаслідок їх дисоціації. При повній дисоціації (ступінь дисоціації α = 1) з одного моль електроліту утворюється n моль іонів, що поводяться як самостійні частинки в розчині (для розведених розчинів). Ізотонічний коефіцієнт визначається за формулою: i = 1 + α (n ̶ 1).
3. Загальна концентрація розчинених речовин (перш за все солей) в очній тканині є вищою, ніж їх концентрація в прісній воді й нижчою, ніж у морській воді. При контакті з прісною водою очна тканина внаслідок осмосу “розбухає” (відчуття різі в очах), а при контакті з морською водою дещо “всихає” (почервоніння очного яблука).
4. У випадку б). Одномолярний розчин глюкози є гіпертонічним до децимолярного розчину сахарози, тому що він містить більшу кількість молекул і його осмотичний тиск буде більшим. У випадках в) і г) треба врахувати дисоціацію розчинених солей, які є сильними електролітами. У цих випадках перші розчини будуть гіпотонічними по відношенню до других.
5. Над розчином в). Над розчином з концентрацією 0,4 моль/л сечовини тиск насиченої водяної пари буде максимальним, тому що кількість розчинених частинок у ньому буде мінімальною.
6. Згідно з другим законом Рауля (∆ Т К = К еб · С m), підвищення температури кипіння розчину (Δ Т К) пропорційне моляльній концентрації розчиненої речовини (С m). Змінимо рівняння відносно моляльної концентрації й перетворимо його в форму, необхідну для розрахунку молярної маси розчиненої речовини:
де М ̶ молярна маса камфори, г/моль, К еб ̶ ебуліоскопічна константа розчинника,кг . К / моль, m р-ни ̶ маса розчиненої речовини, кг, m р-ка ̶ маса розчинника, кг, 1000 – коефіцієнт перерахунку кг на г.
Для диетилового ефіру: К еб = 2,12 кг . К / моль. Проводимо розрахунки: ∆ Т К = 0,453 К; m р-ни = 0,013 кг; m р-ка = 0,4 кг;
Дата добавления: 2015-12-15 | Просмотры: 654 | Нарушение авторских прав |