|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Способ хлорированияПЕРЕРАБОТКА ЛОПАРИТОВЫХ КОНЦЕНТРАТОВ Лопарит - сложное комплексное сырье. Концентраты содержат,% (по массе): (Nb,Ta)2O5 - 8÷9(при отношении Nb2O5 : Ta2O5 ≈ 15:1), TiO2 - 32÷35, (Ce,La…)2O3 - 26÷28, CaO - 6÷8, Na2O - 7÷8, в подчиненных количествах K2O, SrO, оксиды Fe и Al, а так же ThO2 - 0,2÷0,7. Среди редкоземельных элементов в лопарите представлена цериевая группа, причем преобладает содержание оксидов церия и лантана. Технология должна обеспечивать извлечение всех ценных составляющих: ниобия, тантала, редкоземельных металлов и титана. Разработаны и используются две технологические схемы переработки лопаритовых концентратов - хлорная и сернокислотная.
Способ хлорирования Все ценные составляющие лопарита наиболее просто можно извлечь способом хлорирования. Сущность его состоит в том, что компоненты рудного концентрата взаимодействуют с газообразным хлором при 750 - 850 °С в присутствий угля или кокса. Различия в летучести образующихся хлоридов позволяют разделить основные ценные составляющие концентрата. Таблица 1. Температура плавления и кипения некоторых хлоридов.
Хлориды ниобия, тантала и титана, имеющие сравнительно низкие точки кипения, в процессе хлорирования уносятся с газами и улавливаются в конденсационных устройствах; высококипящие хлориды редкоземельных металлов, натрия и кальция остаются в хлораторе в форме плава хлоридов. Ниже приведены реакции хлорирования основных ценных составляющих лопарита: Nb2O5+3Cl2+1.5C=2NbOCl3+1.5CO2 Nb2O5+5Cl+2.5C=2NbCl5+2.5CO2 Ta2O5+2Cl2+2.5C=2TaCl5+2.5CO2 TiO2+2Cl2+C=TiCl4+CO2 (Ln)2O3+3Cl2+1.5C=2(Ln)Cl3+1.5CO2 Одновременно СО2 реагирует с углеродом с образованием CO CO2+C↔2CO Хлорирование оксидов происходит также с участием оксида углерода, например, по реакциям: Nb2O5+3CO+3Cl2=2NbOCl3+3CO2 TiO2+2CO+2Cl2=TiCl4+2CO2 Другие образующиеся при хлорировании хлориды: СаС12,NaCl, A1C13, FeCl3, SiCl4. Реакция хлорирования протекают со значительной убылью энергии Гиббса и практически необратимы. Роль углерода состоит не только в связывании кислорода в CO2, но также в активировании процесса хлорирования. Соотношение СО/СO2 в газовой фазе зависит от условий хлорирования, которое проводят в хлораторах шахтного типа с брикетированной шихтой или в хлораторах с солевым расплавом. Технология хлорирования брикетированной шихты в шахтной электропечи имеет существенные недостатки: операции приготовления брикетов и их прокаливания связаны со значительными затратами; длительность работы ограничена необходимостью остановки печи для чистки от непрохлорированного остатка. Эти недостатки устраняются при осуществлении хлорирования в солевом расплаве, разработанном в последние годы. При хлорировании в расплаве тонкоизмельченные концентрат и нефтяной кокс подаются в расплав высококипящих хлористых солей, через который барботирует
1 - вибромельница; 2 - сушилка концентрата; 3 - шнековый питатель; 4 - рукавные фильтры над бункерами; 5 - хлоратор; 6 - графитовые пористые фильтры; 7 - копильник расплава хлоридов РЗЭ; 8 - конденсатор твердых хлоридов со скребковым устройством; 9 - рукавный фильтр; 10 - конденсатор четыреххлористого титана; 11 - ловушка; 12 - сборник хлорида тантала с погружным насосом; 13 - смеситель-испаритель конденсата хлоридов; 14 - сборник хлоридов.
Последние имеют существенные преимущества: исключаются трудоёмкие операции приготовления брикетов и их прокаливания; благодаря эффективному массо- и теплообмену в перемешиваемом барбатирующим хлором расплаве обеспечивается высокая скорость процесса и, соответственно, высокая производительность хлоратора. Процесс хлорирования осуществляется непрерывно. При хлорировании лопаритового концентрата расплавленная ванна создается образующимися высококипящими хлоридами натрия, калия, кальция и редкоземельных элементов. Примерный состав такого расплава, % LnCl3 - 55; СаСl2 - 20; NaCl - 15, остальное - хлориды других элементов. Температура затвердевания расплава 520 °С. Тонкоизмельченный концентрат и нефтяной кокс подаются в расплав хлоридов, через который барботируют хлор, поступающий через фурмы в нижнюю часть хлоратора. Хлоратор представляет собой шахту прямоугольного сечения с высотой уровня расплава 3,1–3,2 м. По мере хлорирования избыточный расплав непрерывно сливается через переточный канал и собирается в копильнике. Перед переточным каналом расположены фильтры из пористого графита, предназначенные для очистки сливаемого расплава от взвешенных в расплаве частиц концентрата и кокса. Нагревается расплав с помощью графитовых электродов, вмонтированных в стенки хлоратора. Конденсационная система состоит из пылевой камеры для улавливания твердых хлоридов (ниобия, тантала, алюминия, железа), рукавного фильтра с рукавами из стеклоткани (для отделения частиц твердых хлоридов, уносимых потоком газов из пылевой камеры) и оросительного конденсатора для жидкого четыреххлористого титана. Пылевая камера снабжена скребками и охлаждается воздухом. В рукавном фильтре поддерживается температура 120–130° С. Хлорирование ведут при 850 - 900 °С, среднем содержании концентрата в расплаве 1,5 % и углерода ~5 %. В этих условиях удельная производительность хлоратора по концентрату - 5 - 5,5 т/м2 сечения печи в 1 сут. (против 1,5-2 т/(м2-сут) при хлорировании брикетированных шихт). Особенностью хлорирования в расплаве является преобладание содержания СО2 над CO в газовой фазе (отношение СО2:CO ≈ 16:1). Из этого следует, что реакции хлорирования оксидов в расплаве идут с образованием СО2, а реакция Будуара (СО2 +C↔2СО) протекает лишь частично, так как пузырьки СО2 быстро удаляются из расплава, не успевая вступить в реакцию с взвешенными частицами кокса. Испытывали различные системы конденсации компонентов парогазовой смеси (ПГС). Получила распространение система, в которой последовательно осуществляется первоначально конденсация твердых хлоридов (NbOCl3, NbCl5, ТаСl5 и др.) в пылевых камерах при температурах на выходе из камер 200 - 140 °С, а затем жидких хлоридов (TiCl4, SiCl4) в оросительных конденсаторах с орошением охлажденным тетрахлоридом титана. С целью отделения хлоридов железа и алюминия и исключения их конденсации вместе с хлоридами ниобия и тантала перед пылевыми камерами устанавливают солевой фильтр. Его действие основано на образовании FeCl3 и А1С13 с хлоридами натрия и калия легкоплавких комплексов типа Me FeCl4 и Me АlCl4(где Me – Na, К), термически устойчивых и обладающих низким давлением паров при температурах 500 - 600 °С. Над солевыми расплавами систем NaCl-FeCl3-AlCl3 и KCl-FeCl3-AlCl3 давление паров хлоридов NbOCl3, NbCl5, ТаС15, TiCl4, SiCl4, высокое, поэтому они не поглощаются расплавами солевого фильтра.
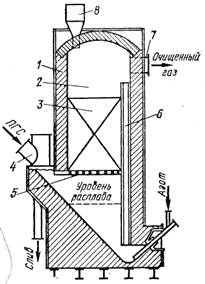
Среди различных аппаратов для солевой очистки наиболее перспективен колонный аппарат с циркуляцией расплава хлоридов щелочных металлов, осуществляемой с помощью аэролифтного устройства (см рис. 2).
1 – корпус фильтра, футерованный шамотным кирпичом; 2 – каплеуловительная камера; 3 – инертная насадка; 4 – газоход; 5 – колосниковая решётка; 6 – аэролифтная труба; 7 - патрубок для вывода ПГС; 8 – загрузочный бункер кусков NaCl. В солевом фильтре, помимо FeCl3 и А1С13, улавливаются твердые частицы (пыль), содержащиеся в ПГС. Недостаток раздельной системы конденсации – неполное улавливание твердых хлоридов (NbOCl3, NbCl5, ТаС15) в пылевых камерах. От 30 до 40 % уносится с газовым потоком и осаждается в оросительном конденсаторе вместе с жидким TiCl4. В фильтр периодически загружают смесь NaCl+KCl или отработанный электролит магниевых электролизеров. По мере накопления из фильтра сливается расплав, насыщенный хлоридами железа и алюминия. В солевом фильтре помимо хлоридов железа и алюминия улавливаются твердые частицы (механический унос из хлоратора). Конденсат твердых хлоридов имеет следующий примерный состав в пересчете на оксиды, % (по массе): (Nb,Ta)2O5 - 51÷54; ТiO2 - 1,0÷1,8; Fe2O3 - 0,40÷1,4; SiO2 - 0,43÷1,4; A12O3 - 0,64÷0,8; ThO2 ~ 0,1; Ln2O3 - 0,9; С - 0,5÷2. Часть тантала и ниобия попадает в конденсат жидкого TiCl4, где они находятся в растворе и частично в виде взвеси. При ректификационной очистке TiCl4 они остаются в кубовом остатке, из которого дополнительно извлекаются. Таким образом, в результате хлорирования лопарита получают три продукта: плав, содержащий хлориды РЗМ, конденсат хлоридов тантала и ниобия и технический тетрахлорид титана. Для получения смеси оксидов тантала и ниобия конденсат хлоридов подвергают гидролитическому разложению: 2NbOCl3+(x+3)H2O=Nb2O5*xH2O+6HCl 2TaCl5+(x+5)H2O=Ta2O5*xH2O+10HCl В кислый раствор переходит большая часть примесей железа, алюминия и частично титана. Полученная смесь гидроксидов, содержащая до 90 % (Nb,Та)2O5 (в прокаленном продукте), поступает на очистку и разделение тантала и ниобия. Другой путь переработки конденсата, содержащего NbOCl3, NbCl5, ТаСl5, хлориды железа, алюминия и др., заключается в получении смеси чистых пентахлоридов NbCl5 и ТаСl5, которые затем можно разделить методом ректификации. Хлорная технология переработки лопарита обеспечивает извлечение 93 ÷ 94 % ниобия и 86 ÷ 88 % тантала в технические оксиды, 96,5 ÷ 97 % титана в технический тетрахлорид, извлечение 95,5 ÷ 96 % редкоземельных металлов в плав хлоридов.
Список литературы: 1) «Металлургия редких металлов», Зеликман, Коршунов. 1991. 2) «Металлургия редких металлов», Зеликман, Меерсон. 1973. 3) «Процессы и аппараты производств радиоактивных и редких металлов», Раков, Хаустов. Дата добавления: 2015-12-16 | Просмотры: 739 | Нарушение авторских прав |