|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Биосинтез коллагенаСоединительная ткань Это самая распространенная ткань, которая окружает большинство клеток организма, образуя межклеточный матрикс. Межклеточный матрикс обеспечивает механическую поддержку, развитие других клеток. Таким образом, соединительная ткань представляет собой межклеточный матрикс, состоящий из белков и гетерополисахаридов, а также клеток, находящихся в матриксе (фибробласты, хондро- и остеобласты, тучные клетки и макрофаги). Основные белки межклеточного матрикса – коллаген, эластин, гликозаминогликаны, протеогликаны и неколлагеновые структурные белки. Коллаген Коллаген - основной белок кожи, костей, сухожилий, хряща, сосудов, зубов. Это фибриллярный белок, он составляет 25- 35% от всех белков - 6% от массы тела. Молекула коллагена состоит из 3-х полипептидных цепей, называемых α-цепями. Обнаружено более 20 α-цепей, каждая из которых состоит из 1000 аминокислотных остатков. В состав 1 молекулы коллагена могут входить три одинаковых или три разных α-цепи. Первичная структура α-цепей коллагена примерно одинакова и содержит на 1/3 часть глицин, на 1/3 часть – пролин (или 4 оксипролин); 11% аланин. Отсутствуют такие аминокислоты: цистеин, триптофан. В первичной структуре есть необычные аминокислоты: оксипролин и оксилизин. Полипептидную α-цепь коллагена можно представить как последовательность триплетов Гли-Х-Y, где X и Y – любые аминокислоты, но чаще х – это пролин, а у – это гидроксилизин, или гидроксипролин. Спирализованные полипептидные цепи (по 3) закручиваются друг около друга, образуя трехцепочечную правозакрученную спираль, которая удерживается водородными связями между NH2-группами и СООН-группами. Эту молекулу называют тропоколлаген. Отсутствие радикалов у образующих его аминокислот позволяет цепям плотно прилегать друг к другу. Молекулы тропоколлагена объединяются друг с другом со сдвигом друг относительно друга на ¼, причем между радикалами аминокислот возникают ионные, водородные и гидрофобные связи. Благодаря оксилизину и оксипролину соседних цепей тропоколлагена образуются водородные связи, которые укрепляют структуру коллагеновых фибрилл. Кроме того, к гидроксильной группе лизина могут присоединяться галактоза и галактозилглюкоза (о-гликозидными связями). Описано 28 типов коллагена, которые кодируются более чем 40 генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации - интенсивности гидроксилирования или гликозилирования. Более 90% всего коллагена приходится на коллагены I, II,III и IV типов. Обозначение: римская цифра в скобках обозначает тип коллагена, а α-цепи обозначаются арабскими цифрами. Например, [α1(II)]3 и [α1(III)]3. Индекс за скобкой обозначает количество идентичных α-цепей. Разновидности α1(I), α1(II), α1(III), α1(IV) и т.д. Коллаген типа 2 [α1(II)]3 Биосинтез коллагена Состоит из 8 этапов: 5 из них клеточные, 3 – внеклеточные. Клеточные этапы: 1. Образуются препро-α-цепи на полирибосомах ЭПР (эндоплазматического ретикулума), более длинные, чем сама α-цепь. На N- и С- концах полипептидной цепи содержатся дополнительные цепи по 100 аминокислот, которые необходимы для ориентирования в ЭПР. Предшественник называется препроколлаген. 2. В момент образования цепи эти пептиды отщепляются и образуется проколлаген, у которого на N-и С-конце серосодержащие аминокислоты: цистеин, образующий S-S-дисульфидные мостики, необходимые для спирализации проколлагена. 3. Во время образования препроколлагена происходит гидроксилирование пролина и лизина (до момента спирализации и отделения от рибосом). В процессе гидроксилирования участвуют ферменты пролил-4-гидроксилаза и лизил-5-гидроксилаза. Например:
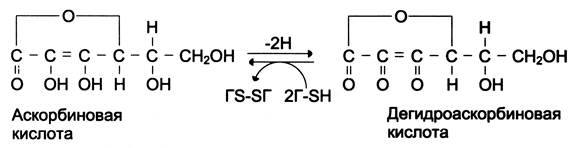
В активном центре пролил- и лизилгидроксилаз находится Fe2+. Для поддержания его в ферроформе нужен восстанавливающий агент. Коферментом гидроксилаз является аскорбиновая кислота (витамин С), которая окисляется в дегидроаскорбиновую кислоту за счет восстановления глутатиона.
В молекуле кислорода О2 два атома кислорода, один из которых используется для образования гидроксильной группы оксипролина, а второй для декарбоксилирования α-кГ (α-кГ → сукцинат+СО2). Аналогично проходит процесс гидроксилирования лизина в положении 5. Эти две реакции необходимы для стабилизации спирали проколлагена и при сборке фибрилл. При цинге, авитаминозе витамина С, не может образоваться зрелый коллаген, так как нарушается гидроксилирование пролина и лизина, что приводит к хрупкости коллагеновых волокон, точечным кровоизлияниям под кожу, кровоточивости, анемии. 4. В аппарате Гольджи к проколлагену присоединяются остатки углеводов (галактоза или дисахарид галактозилглюкоза) О-гликозидной связью с ОН-группой лизина (фермент гликозил-метил-трансфераза). Число углеводных единиц в коллагенах разных тканей различно. Вероятно, это придает механическую прочность коллагеновым волокнам. 5. После гидроксилирования и гликозилирования про α–цепи соединяются по 3 путем S-S (дисульфидных связей) в С-концевых пептидах. Образуется незрелый тропоколлаген (интактный) с N- и С- концевыми пептидами.
Интактный коллаген захватывается секреторными пузырьками аппарата Гольджи и переносится в межклеточное пространство. Внеклеточные этапы 6. Созревание итактного коллагена и образование тропоколлагена: происходит отщепление N- и C- концевых пептидов.
Коллагены IV, VIII, X типа (сетеподобные), у них отщепление N и С – не происходит. 7. Далее – ковалентное “сшивание” молекул тропоколлагена:
с образованием нерастворимого коллагена. В этом принимает участие фермент лизилоксидаза (кофермент ФАD+ и атом Сu2+). После многократного сшивания отдельные фибриллы приобретают высокую прочность.
8. Ассоциация молекул нерастворимого коллагена “бок в бок” на ¼ своей длины
Коллагеновые фибриллы образуются путем ступенчато-параллельно расположенных молекул тропоколлагена, которые сдвинуты друг относительно друга на ¼ своей длины. Промежутки между молекулами являются центрами минерализации, в них находятся кристаллы фосфата кальция.
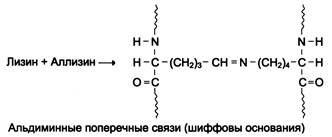
Между миофибриллами могут возникать “перемычки” (неферментным путем) с образованием гетероциклов, обозначаемых как пиридино и пиррольного типа. Благодаря сшивкам между миофибриллами обеспечивается прочность волокна. В детском возрасте число сшивок возрастает и к 10-15 годам достигает уровня, который сохраняется всю жизнь. Биологическая стабильность “сшивок” столь высока, что при деградации самого коллагенового волокна, приридиниевые и пирольные фрагменты не разрушаются, а попадают в кровь и выводятся с мочой (что служит критерием интенсивности распада коллагена в организме). Коллаген относится к белкам, имеющим Т1/2 (период полураспада) месяцы и недели (то есть медленно обменивается). Фермент тканей человека, разрушающий его – это коллагеназа, а также активные формы кислорода. С возрастом, когда поперечных сшивок “лиз-лиз” становится больше, коллагеназа хуже действует. Это Zn-зависимый фермент, с высокой специфичностью. В результате распада коллагена с мочой выделяется оксипролин, который является маркерной аминокислотой.
Дата добавления: 2016-06-06 | Просмотры: 818 | Нарушение авторских прав |