|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Подвижные генетические элементыВ состав бактериального генома, как в бактериальную хромосому, так и в плазмиды, входят подвижные генетические элементы. К подвижным генетическим элементам относятся вставочные последовательности и транспозоны. Вставочные (инсерционные) последовательности IS-элементы — это участки ДНК, способные как целое перемещаться из одного участка репликона в другой, а также между репликонами. Они содержат лишь те гены, которые необходимы для их собственного перемещения — транспозиции: ген, кодирующий фермент транспозазу, обеспечивающую процесс исключения IS-элемента из ДНК и его интеграцию в новый локус, и ген, детерминирующий синтез репрессора, который регулирует весь процесс перемещения. Отличительной особенностью IS-элементов является наличие на концах вставочной последовательности инвертированных повторов. Эти инвертированные повторы узнает фермент транспозаза. Транспозаза осуществляет одноцепочечные разрывы цепей ДНК, расположенных по обе стороны от подвижного элемента. Оригинальная копия IS-элемента остается на прежнем месте, а ее реплицированный дупликат перемещается на новый участок. Перемещение подвижных генетических элементов принято называть репликативной или незаконной рекомбинацией. Однако в отличие от бактериальной хромосомы и плазмид подвижные генетические элементы не являются самостоятельными репликонами, так как их репликация — составной элемент репликации ДНК репликона, в составе которого они находятся. Известно несколько разновидностей IS-элементов, которые различаются по размерам и по типам и количеству инвертированных повторов. Транспозоны — это сегменты ДНК, обладающие теми же свойствами, что и IS-элементы, но имеющие структурные гены, т. е. гены, обеспечивающие синтез молекул, обладающих специфическим биологическим свойством, например токсичностью, или обеспечивающих устойчивость к антибиотикам. Перемещаясь по репликону или между репликонами, подвижные генетические элементы вызывают: 1. Инактивацию генов тех участков ДНК, куда они, переместившись, встраиваются. 2. Образование повреждений генетического материала. 3. Слияние репликонов, т. е. встраивание плазмиды в хромосому. 4. Распространение генов в популяции бактерий, что может приводить к изменению биологических свойств популяции, смене возбудителей инфекционных заболеваний, а также способствует эволюционным процессам среди микробов. Изменения бактериального генома, а следовательно, и свойств бактерий могут происходить в результате мутаций и рекомбинаций.
№ 37 Механизмы передачи генетического материала у бактерий. Конъюгация бактерий состоит в переходе генетического материала (ДНК) из клетки-донора («мужской») в клетку-реципиент («женскую») при контакте клеток между собой. Мужская клетка содержит F-фактор, или половой фактор, который контролирует синтез так называемых половых пилей, или F-пилей. Клетки, не содержащие F-фактора, являются женскими; при получении F-фактора они превращаются в «мужские» и сами становятся донорами. F-фактор располагается в цитоплазме в виде кольцевой двунитчатой молекулы ДНК, т. е. является плазмидой. Молекула F-фактора значительно меньше хромосомы и содержит гены, контролирующие процесс конъюгации, в том числе синтез F-пилей. При конъюгации F-пили соединяют «мужскую» и «женскую» клетки, обеспечивая переход ДНК через конъюгационный мостик или F-пили. Клетки, содержащие F-фактор в цитоплазме, обозначаются F+; они передают F-фактор клеткам, обозначаемым F" («женским»), не утрачивая донорской способности, так как оставляют копии F-фактора. Если F-фактор включается в хромосому, то бактерии приобретают способность передавать фрагменты хромосомной ДНК и называются Hfr-клетками (от англ. high frequency of recombination — высокая частота рекомбинаций), т.е. бактериями с высокой частотой рекомбинаций. При конъюгации клеток Hfr и клеток F" хромосома разрывается и передается с определенного участка (начальной точки) в клетку F", продолжая реплицироваться. Перенос всей хромосомы может длиться до 100 мин. Переносимая ДНК взаимодействует с ДНК реципиента — происходит гомологичная рекомбинация. Прерывая процесс конъюгации бактерий, можно определять последовательность расположения генов в хромосоме. Иногда F-фактор может при выходе из хромосомы захватывать небольшую ее часть, образуя так называемый замещенный фактор — F'. При конъюгации происходит только частичный перенос генетического материала, поэтому ее не следует отождествлять полностью с половым процессом у других организмов. Трансдукция — передача ДНК от бактерии-донора к бактерии-реципиенту при участии бактериофага. Различают неспецифическую (общую) трансдукцию, при которой возможен перенос любого фрагмента ДНК донора, и специфическую — перенос определенного фрагмента ДНК донора только в определенные участки ДНК реципиента. Неспецифическая трансдукция обусловлена включением ДНК донора в головку фага дополнительно к геному фага или вместо генома фага (дефектные фаги). Специфическая трансдукция обусловлена замещением некоторых генов фага генами хромосомы клетки-донора. Фаговая ДНК, несущая фрагменты хромосомы клетки-донора, включается в строго определенные участки хромосомы клетки-реципиента. Таким образом, привносятся новые гены и ДНК фага в виде профага репродуцируется вместе с хромосомой, т.е. этот процесс сопровождается лизоге-нией. Если фрагмент ДНК, переносимый фагом, не вступает в рекомбинацию с хромосомой реципиента и не реплицируется, но с него считывается информация о синтезе соответствующего продукта, такая трансдукция называется абортивной. Трансформация заключается в том, что ДНК, выделенная из бактерий в свободной растворимой форме, передается бактерии-реципиенту. При трансформации рекомбинация происходит, если ДНК бактерий родственны друг другу. В этом случае возможен обмен гомологичных участков собственной и проникшей извне ДНК. Впервые явление трансформации описал Ф. Гриффите (1928). Он вводил мышам живой невирулентный бескапсульный R-штамм пневмококка и одновременно убитый вирулентный капсульный S-штамм пневмококка. Из крови погибших мышей был выделен вирулентный пневмококк, имеющий капсулу убитого S-штамма пневмококка. Таким образом, убитый S-штамм пневмококка передал наследственную способность капсулообразования R-штамму пневмококка. О. Эвери, К. Мак-Леод и М. Мак-Карти (1944) доказали, что трансформирующим агентом в этом случае является ДНК. Путем трансформации могут быть перенесены различные признаки: капсулообразование, устойчивость к антибиотикам, синтез ферментов. Изучение бактериальной трансформации позволило установить роль ДНК как материального субстрата наследственности. При изучении генетической трансформации у бактерий были разработаны методы экстракции и очистки ДНК, биохимические и биофизические методы ее анализа.
№ 38 Плазмиды бактерий, их функции и свойства. Использование плазмид в генной инженерии. Плазмиды — внехромосомные мобильные генетические структуры бактерий, представляющие собой замкнутые кольца двунитчатой ДНК. По размерам составляют 0,1—5 % ДНК хромосомы. Плазмиды способны автономно копироваться (реплицироваться) и существовать в цитоплазме клетки, поэтому в клетке может быть несколько копий плазмид. Плазмиды могут включаться (интегрировать) в хромосому и реплицироваться вместе с ней. Различают трансмиссивные и нетрансмиссивные плазмиды. Трансмиссивные (конъюгативные) плазмиды могут передаваться из одной бактерии в другую. Среди фенотипических признаков, сообщаемых бактериальной клетке плазмидами, можно выделить следующие: 1) устойчивость к антибиотикам; 2) образование колицинов; 3) продукция факторов патогенности; 4) способность к синтезу антибиотических веществ; 5) расщепление сложных органических веществ; 6) образование ферментов рестрикции и модификации. Термин «плазмиды» впервые введен американским ученым Дж. Ледербергом (1952) для обозначения полового фактора бактерий. Плазмиды несут гены, не обязательные для клетки-хозяина, придают бактериям дополнительные свойства, которые в определенных условиях окружающей среды обеспечивают их временные преимущества по сравнению с бесплазмидными бактериями. Некоторые плазмиды находятся под строгим контролем. Это означает, что их репликация сопряжена с репликацией хромосомы так, что в каждой бактериальной клетке присутствует одна или, по крайней мере, несколько копий плазмид. Число копий плазмид, находящихся под слабым контролем, может достигать от 10 до 200 на бактериальную клетку. Для характеристики плазмидных реплико-нов их принято разбивать на группы совместимости. Несовместимость плазмид связана с неспособностью двух плазмид стабильно сохраняться в одной и той же бактериальной клетке. Несовместимость свойственна тем плазмидам, которые обладают высоким сходством репликонов, поддержание которых в клетке регулируется одним и тем же механизмом. Некоторые плазмиды могут обратимо встраиваться в бактериальную хромосому и функционировать в виде единого репликона. Такие плазмиды называются интегративными или эписомами. У бактерий различных видов обнаружены R-плазмиды, несущие гены, ответственные за множественную устойчивость к лекарственным препаратам — антибиотикам, сульфаниламидам и др., F-плазмиды, или половой фактор бактерий, определяющий их способность к конъюгации и образованию половых пилей, Ent-плазмиды, детерминирующие продукцию энтеротоксина. Плазмиды могут определять вирулентность бактерий, например возбудителей чумы, столбняка, способность почвенных бактерий использовать необычные источники углерода, контролировать синтез белковых антибиотикоподобных веществ — бактериоцинов, детерминируемых плазмидами бактериоциногении, и т. д. Существование множества других плазмид у микроорганизмов позволяет полагать, что аналогичные структуры широко распространены у самых разнообразных микроорганизмов. Плазмиды подвержены рекомбинациям, мутациям, могут быть элиминированы (удалены) из бактерий, что, однако, не влияет на их основные свойства. Плазмиды являются удобной моделью для экспериментов по искусственной реконструкции генетического материала, широко используются в генетической инженерии для получения рекомбинантных штаммов. Благодаря быстрому самокопированию и возможности конъюгаци-онной передачи плазмид внутри вида, между видами или даже родами плазмиды играют важную роль в эволюции бактерий.
№ 39 Медицинская биотехнология, ее задачи и достижения.
Биотехнология представляет собой область знаний, которая возникла и оформилась на стыке микробиологии, молекулярной биологии, генетической инженерии, химической технологии и ряда других наук. Рождение биотехнологии обусловлено потребностями общества в новых, более дешевых продуктах для народного хозяйства, в том числе медицины и ветеринарии, а также в принципиально новых технологиях. Биотехнология — это получение продуктов из биологических объектов или с применением биологических объектов. В качестве биологических объектов могут быть использованы организмы животных и человека (например, получение иммуноглобулинов из сывороток вакцинированных лошадей или людей; получение препаратов крови доноров), отдельные органы (получение гормона инсулина из поджелудочных желез крупного рогатого скота и свиней) или культуры тканей (получение лекарственных препаратов). Однако в качестве биологических объектов чаще всего используют одноклеточные микроорганизмы, а также животные и растительные клетки. Клетки животных и растений, микробные клетки в процессе жизнедеятельности (ассимиляции и диссимиляции) образуют новые продукты и выделяют метаболиты, обладающие разнообразными физико-химическими свойствами и биологическим действием. Биотехнология использует эту продукцию клеток как сырье, которое в результате технологической обработки превращается в конечный продукт. С помощью биотехнологии получают множество продуктов, используемых в различных отраслях: • медицине (антибиотики, витамины, ферменты, аминокислоты, гормоны, вакцины, антитела, компоненты крови, диагностические препараты, иммуномодуляторы, алкалоиды, пищевые белки, нуклеиновые кислоты, нуклеозиды, нуклеоти-ды, липиды, антиметаболиты, антиоксиданты, противоглистные и противоопухолевые препараты); • ветеринарии и сельском хозяйстве (кормовой белок: кормовые антибиотики, витамины, гормоны, вакцины, биологические средства защиты растений, инсектициды); • пищевой промышленности (аминокислоты, органические кислоты, пищевые белки, ферменты, липиды, сахара, спирты, дрожжи); • химической промышленности (ацетон, этилен, бутанол); • энергетике (биогаз, этанол). Следовательно, биотехнология направлена на создание диагностических, профилактических и лечебных медицинских и ветеринарных препаратов, на решение продовольственных вопросов (повышение урожайности, продуктивности животноводства, улучшение качества пищевых продуктов — молочных, кондитерских, хлебобулочных, мясных, рыбных); на обеспечение многих технологических процессов в легкой, химической и других отраслях промышленности. Необходимо отметить также все возрастающую роль биотехнологии в экологии, так как очистка сточных вод, переработка отходов и побочных продуктов, их деградация (фенол, нефтепродукты и другие вредные для окружающей среды вещества) осуществляются с помощью микроорганизмов. В настоящее время в биотехнологии выделяют медико-фармацевтическое, продовольственное, сельскохозяйственное и экологическое направления. В соответствии с этим биотехнологию можно разделить на медицинскую, сельскохозяйственную, промышленную и экологическую. Медицинская в свою очередь подразделяется на фармацевтическую и иммунобиологическую, сельскохозяйственная — на ветеринарную и биотехнологию растений, а промышленная — на соответствующие отраслевые направления (пищевая, легкая промышленность, энергетика и т. д.). Биотехнологию также подразделяют на традиционную (старую) и новую. Последнюю связывают с генетической инженерией. Общепризнанное определение предмета «биотехнология» отсутствует и даже ведется дискуссия о том, наука это или производство.
№ 40 Молекулярно-биологические методы, используемые в диагностике инфекционных болезней (ПЦР, рестрикционный анализ и др.). Полимеразная цепная реакция позволяет обнаружить микроб в исследуемом материале (воде, продуктах, материале от больного) по наличию в нем ДНК микроба без выделения последнего в чистую культуру. Для проведения этой реакции из исследуемого материала выделяют ДНК, в которой определяют наличие специфичного для данного микроба гена. Обнаружение гена осуществляют его накоплением. Для этого необходимо иметь праймеры комплементарного З'-концам ДНК. исходного гена. Накопление (амплификация) гена выполняется следующим образом. Выделенную из исследуемого материала ДНК нагревают. При этом ДНК распадается на 2 нити. Добавляют праймеры. Смесь ДНК и праймеров охлаждают. При этом праймеры, при наличии в смеси ДНК искомого гена, связываются с его комплементарными участками. Затем к смеси ДНК и праймера добавляют ДНК-полимеразу и нуклеотиды. Устанавливают температуру, оптимальную для функционирования ДНК-полимеразы. В этих условиях, в случае комплементарное™ ДНК гена и праймера, происходит присоединение нуклеотидов к З'-концам праймеров, в результате чего синтезируются две копии гена. После этого цикл повторяется снова, при этом количество ДНК гена будет увеличиваться каждый раз вдвое. Проводят реакцию в специальных приборах — амплификаторах. ПЦР применяется для диагностики вирусных и бактериальных инфекций. Рестрикционный анализ. Данный метод основан на применении ферментов, носящих название рестриктаз. Рестриктазы представляют собой эндонук-леазы, которые расщепляют молекулы ДНК, разрывая фосфатные связи не в произвольных местах, а в определенных последовательностях нуклеотидов. Особое значение для методов молекулярной генетики имеют рестриктазы, которые узнают последовательности, обладающие центральной симметрией и считывающиеся одинаково в обе стороны от оси симметрии. Точка разрыва ДНК может или совпадать с осью симметрии, или быть сдвинута относительно нее. В настоящее время из различных бактерий выделено и очищено более 175 различных рестриктаз, для которых известны сайты (участки) узнавания (рестрикции). Выявлено более 80 различных типов сайтов, в которых может происходить разрыв двойной спирали ДНК. В геноме конкретной таксономической единицы находится строго определенное (генетически задетерминированное) число участков узнавания для определенной рестриктазы. Если выделенную из конкретного микроба ДНК обработать определенной рестриктазой, то это приведет к образованию строго определенного количества фрагментов ДНК фиксированного размера. Размер каждого типа фрагментов можно узнать с помощью электрофореза в агарозном геле: мелкие фрагменты перемещаются в геле быстрее, чем более крупные фрагменты, и длина их пробега больше. Гель окрашивают бромистым этидием и фотографируют в УФ-излучении. Таким образом можно получить рестрикционную карту определенного вида микробов. Сопоставляя карты рестрикции ДНК, выделенных из различных штаммов, можно определить их генетическое родство, выявить принадлежность к определенному виду или роду, а также обнаружить участки, подвергнутые мутациям. Этот метод используется также как начальный этап метода определения последовательности нуклеотидных пар (секвенирования) и метода молекулярной гибридизации. Метод молекулярной гибридизации позволяет выявить степень сходства различных ДНК. Применяется при идентификации микробов для определения их точного таксономического положения. Метод основан на способности двухцепочечной ДНК при повышенной температуре (90 °С) в щелочной среде денатурировать, т. е. расплетаться на две нити, а при понижении температуры на 10 °С вновь восстанавливать исходную двухцепочечную структуру. Метод требует наличия молекулярного зонда. Зондом называется одноцепочечная молекула нуклеиновой кислоты, меченная радиоактивными нуклидами, с которой сравнивают исследуемую ДНК. Для проведения молекулярной гибридизации исследуемую ДНК расплетают указанным выше способом, одну нить фиксируют на специальном фильтре, который затем помещают в раствор, содержащий радиоактивный зонд. Создаются условия, благоприятные для образования двойных спиралей. В случае наличия комплементарности между зондом и исследуемой ДНК, они образуют между собой двойную спираль. Риботипирование и опосредованная транскрипцией амплификация рибосомальной РНК. Последовательность нуклеотидных оснований в оперонах, кодирующих рРНК, отличается консервативностью, присущей каждомувиду бактерий. Эти опероны представлены на бактериальной хромосоме в нескольких копиях. Фрагменты ДНК, полученные после обработки ее рестриктазами, содержат последовательности генов рРНК, которые могут быть обнаружены методом молекулярной гибридизации с меченой рРНК соответствующего виды бактерий. Количество и локализация копий оперонов рРНК и рестрикционный состав сайтов как внутри рРНК-оперона, так и по его флангам варьируют у различных вида бактерий. На основе этого свойства построен метод риботипирования, который позволяет производить мониторинг выделенных штаммов и определение их вида. В настоящее время риботипирование проводится в автоматическом режиме в специальных приборах. Опосредованная транскрипцией амплификация рРНК используется для диагностики смешанных инфекций. Этот метод основан на обнаружении с помощью молекулярной гибридизации амплифицированных рРНК, специфичных для определенного вида бактерий. Исследование проводится в три этапа: 1. Амплификация пула рРНК на матрице выделенной из исследуемого материала ДНК при помощи ДНК-зависимой РНК-полимеразы. 2. Гибридизация накопленного пула рРНК с комплементарными видоспецифическим рРНК олигонуклеотидами, меченными флюорохромом или ферментами. 3. Определение продуктов гибридизации методами денситометрии, иммунофермент-ного анализа (ИФА). Реакция проводится в автоматическом режиме в установках, в которых одномоментное определение рРНК, принадлежащих различным видам бактерий, достигается разделением амплифицированного пула рРНК на несколько проб, в которые вносятся комплементарные видоспецифическим рРНК меченые олигонуклеотиды для гибридизации.
№ 41 Понятие о химиотерапии. История открытия химиопрепаратов. Химиотерапия — специфическое антимикробное, антипаразитарное лечение при помощи химических веществ. Эти вещества обладают важнейшим свойством — избирательностью действия против болезнетворных микроорганизмов в условиях макроорганизма. Основоположником химиотерапии является немецкий химик, лауреат Нобелевской премии П.Эрлих, который установил, что химические вещества, содержащие мышьяк, губительно действуют на спирохеты и трипаносомы, и получил в 1910 г. первый химиотерапевтический препарат — сальварсан (соединение мышьяка, убивающее возбудителя, но безвредное для микроорганизма). В 1935 г. другой немецкий химик Г.Домагк обнаружил среди анилиновых красителей вещество — пронтозил, или красный стрептоцид, спасавший экспериментальных животных от стрептококковой инфекции, но не действующий на эти бактерии вне организма. За это открытие Г.Домагк был удостоен Нобелевской премии. Позднее было выяснено, что в организме происходит распад пронтозила с образованием сульфаниламида, обладающего антибактериальной активностью как in vivo, так и in vitro. Механизм действия сульфаниламидов (сульфонамидов) на микроорганизмы был открыт Р.Вудсом, установившим, что сульфаниламиды являются структурными аналогами парааминобензойной кислоты (ПАБК), участвующей в биосинтезе фолиевой кислоты, необходимой для жизнедеятельности бактерий. Бактерии, используя сульфаниламид вместо ПАБК, погибают. Первый природный антибиотик был открыт в 1929 г. английским бактериологом А.Флемингом. При изучении плесневого гриба Penicillium notatum, препятствующего росту бактериальной культуры, А. Флеминг обнаружил вещество, задерживающее рост бактерий, и назвал его пенициллином. В 1940 г. Г. Флори и Э. Чейн получили очищенный пенициллин. В 1945 г. А Флеминг, Г. Флори и Э. Чейн стали Нобелевскими лауреатами. В настоящее время имеется огромное количество химиотерапевтических препаратов, которые применяются для лечения заболеваний, вызванных различными микроорганизмами.
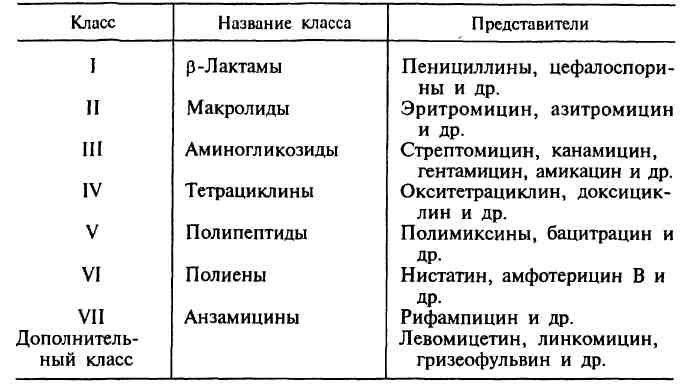
№ 42 Антибиотики. Природные и синтетические. История открытия природных антибиотиков. Классификация антибиотиков по химической структуре, механизму, спектру и типу действия. Способы получения. Антибиотики — химиотерапевтические вещества, продуцируемые микроорганизмами, животными клетками, растениями, а также их производные и синтетические продукты, которые обладают избирательной способностью угнетать и задерживать рост микроорганизмов, а также подавлять развитие злокачественных новообразований. За тот период, который прошел со времени открытия П.Эрлиха, было получено более 10 000 различных антибиотиков, поэтому важной проблемой являлась систематизация этих препаратов. В настоящее время существуют различные классификации антибиотиков, однако ни одна из них не является общепринятой. В основу главной классификации антибиотиков положено их химическое строение.
Наиболее важными классами синтетических антибиотиков являются хинолоны и фторхинолоны (например, ципрофлоксацин), сульфаниламиды (сульфадиметоксин), имидазолы (метронидазол), нитрофураны (фурадонин, фурагин). По спектру действия антибиотики делят на пять групп в зависимости от того, на какие микроорганизмы они оказывают воздействие. Кроме того, существуют противоопухолевые антибиотики, продуцентами которых также являются актиномицеты. Каждая из этих групп включает две подгруппы: антибиотики широкого и узкого спектра действия. Антибактериальные антибиотики составляют самую многочисленную группу препаратов. Преобладают в ней антибиотики широкого спектра действия, оказывающие влияние на представителей всех трех отделов бактерий. К антибиотикам широкого спектра действия относятся аминогликозиды, тетрациклины и др. Антибиотики узкого спектра действия эффективны в отношении небольшого круга бактерий, например полет-миксины действуют на грациликутные, ванкомицин влияет на грамположительные бактерии. В отдельные группы выделяют противотуберкулезные, противолепрозные, противосифилитические препараты. Противогрибковые антибиотики включают значительно меньшее число препаратов. Широким спектром действия обладает, например, амфотерицин В, эффективный при кандидозах, бластомикозах, аспергиллезах; в то же время нистатин, действующий на грибы рода Candida, является антибиотиком узкого спектра действия. Антипротозойные и антивирусные антибиотики насчитывают небольшое число препаратов. Противоопухолевые антибиотики представлены препаратами, обладающими цитотоксическим действием. Большинство из них применяют при многих видах опухолей, например митоми-цин С. Действие антибиотиков на микроорганизмы связано с их способностью подавлять те или иные биохимические реакции, происходящие в микробной клетке. В зависимости от механизма действия различают пять групп антибиотиков: 1. антибиотики, нарушающие синтез клеточной стенки. К этой группе относятся, например, β-лактамы. Препараты этой группы характеризуются самой высокой избирательностью действия: они убивают бактерии и не оказывают влияния на клетки микроорганизма, так как последние не имеют главного компонента клеточной стенки бактерий — пептидогликана. В связи с этим β -лактамные антибиотики являются наименее токсичными для макроорганизма; 2. антибиотики, нарушающие молекулярную организацию и синтез клеточных мембран. Примерами подобных препаратов являются полимиксины, полиены; 3. антибиотики, нарушающие синтез белка; это наиболее многочисленная группа препаратов. Представителями этой группы являются аминогликозиды, тетрациклины, макроли-ды, левомицетин, вызывающие нарушение синтеза белка на разных уровнях; 4. антибиотики — ингибиторы синтеза нуклеиновых кислот. Например, хинолоны нарушают синтез ДНК, рифампицин — синтез РНК; 5. антибиотики, подавляющие синтез пуринов и аминокислот. К этой группе относятся, например, сульфаниламиды. Дата добавления: 2015-02-06 | Просмотры: 984 | Нарушение авторских прав |