 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Приобретенный (адаптивный ) иммунитет
Основной количественной характеристикой приобретенного иммунитета является общее число лимфоцитов в периферической крови. У детей, начиная с 4-5 дня после рождения («первый перекрест» лейкоцитарной формулы), после нивелирования лимфопенического эффекта родового стресса отмечается физиологический лимфоцитоз. В возрасте 4-6 лет имеет место выравнивание относительного содержания лимфоцитов и нейтрофилов на уровне 40-45% («второй перекрест»). Это нашло отражение в мнемоническом правиле «четырех четверок» - относительное содержание в периферической крови лимфоцитов и нейтрофилов в 4 дня и в 4 года жизни составляет в среднем 44%. Далее физиологический относительный лимфоцитоз может сохраняться до 8-10 лет. При наличии дефицита железа, гипотрофии и рахита возрастное преобладание лимфоцитов усугубляется и затягивается. Максимальное количество лимфоцитов, как правило, в норме не должно превышать 9000/мкл у дошкольников и 7200/мкл – у детей школьного возраста. Абсолютный и относительный лимфоцитоз в крови детей вплоть до пубертатного возраста отражает физиологический процесс «обучения» множества клонов Т- и В-лимфоцитов, несущих TCR-рецепторы для распознавания чужеродных антигенов. К 5-7 годам лимфоциты по большей части обладают иммунологической памятью и уже не доминируют. Отражением созревания иммунной системы у детей является и иная по сравнению со взрослыми численность популяций и субпопуляций лимфоцитов, возрастная динамика экспрессии их мембранных маркеров, синтеза цитокинов. Т-лимфоциты и их субпопуляции. Процент СD3 Т-лимфоцитов в крови пуповины несколько ниже, чем в периферической крови старших детей и взрослых, но в силу большего общего числа лимфоцитов абсолютное количество этих клеток у новорожденных достаточно велико. Кроме того, отношение СD4- к СD8-лимфоцитам в крови пуповины выше (3,5-4:1), чем в крови детей старшего возраста и взрослых (1,5-2:1). По некоторым данным соотношение субпопуляций Т-лимфоцитов 2:1 устанавливается к 2 годам. Кроме того, имеются клетки с двойными маркерами СD4 и СD8. Функциональные исследования обнаруживают супрессорную направленность реакций иммунной системы новорожденных. Это связывают с тем, что супрессорную функцию осуществляют не только клетки СD4+ СD25+Foxp3, но и другие, в частности циркулирующие в крови незрелые тимоциты с маркерами СD1, СD10, СD11, а также естественные киллеры. Биологический смысл общей супрессорной направленности реакций клеток иммунной системы (независимо от фенотипа клеток) состоит в предупреждении тяжелой иммунопатологии при контакте с огромным числом антигенов после рождения и интенсивного развития субпопуляций лимфоцитов-хелперов, необходимого для начала синтеза собственных антител. В процессе противоинфекционного ответа у новорожденных отмечается замедленное формирование Т-зависимого антигенспецифического ответа. Частично это объясняется отсутствием у новорожденных клеток памяти. Кроме того, неонатальные Т-лимфоциты экспрессируют меньшее число молекул СD40-лиганда, необходимого для взаимодействия Т- и В-лимфоцитов и Т-лимфоцитов и макрофагов. В то же время Т-лимфоциты пуповинной крови нормально реагируют на фитогемагглютинин и конканавалин А и участвуют в смешанной лейкоцитарной реакции. Практически все Т-лимфоциты пуповинной крови несут на своей поверхности незрелую изоформу СD45 - СD45RA. Преобладание СD45 RA над СD45 RО сохраняется на протяжении 2-3 лет жизни. Соотношение Тh1 и Тh2 в разные возрастные периоды имеет определенные различия. Если у здоровых взрослых отмечается относительное преобладание Тh1 и отношение Тh2:Тh1 составляет 3:4 в периферической крови, то в пуповинной крови это отношение 10-100:1, то есть для плода и новорожденного ребенка характерна Тh2-поляризация. У новорожденных снижена продукция таких цитокинов как ИЛ-2, ИЛ-12, ИЛ-15. Тh2-поляризация чрезвычайно важна для физиологического течения беременности. Доминирование в конце внутриутробной жизни выработки Тh2 носит адаптационный характер и направлено на защиту плаценты от потенциальной токсичности Тh1. Это доминирование сохраняется еще в течение какого-то времени после рождения. В течение этого времени ребенок, с одной стороны, предуготован к развитию атопии, отмечается феномен «открытого окна» для внешней сенсибилизации и манифестации атопических заболеваний (атопический дерматит, бронхиальная астма). С другой стороны, благодаря частым вирусным и бактериальным инфекциям со стимуляцией Тh1, происходит переключение доминирующего Тh2-пути ответа на Тh1 ответ, типичный для противоинфекционного иммунитета у взрослых. В последнее время, накапливается все больше данных о возможном протективном действии различных перенесенных в грудном и раннем детском возрасте инфекций (респираторных, кишечных, гельминтозов) на развитие атопических заболеваний. Это может быть связано с конкурентным воздействием микробных антигенов на Тh1, которые вырабатывают ИФНg, переключающий потенциально атопический Тh2-ответ, свойственный детям, на Тh1-ответ взрослых. Таким образом, инфекции, перенесенные детьми в возрасте до 10 месяцев, а по некоторым данным до 3 лет жизни, являются эффективным профилактическим мероприятием развития аллергических заболеваний у детей. Данная концепция получила название «гигиенической», так как основанием для нее послужили проспективные наблюдения за детьми, проживающими в разных гигиенических условиях. Так частота аллергии была ниже в странах с низким уровнем жизни, семьях с меньшим достатком и наличием младших братьев и сестер. Нормативные показатели формулы периферической крови, лимфоцитов различных популяций и субпопуляций в зависимости от возраста представлены в таблице1. В-лимфоциты и иммуноглобулины. Процент В-лимфоцитов в пуповинной крови несколько ниже, чем в крови старших детей и взрослых, но их абсолютное число значительно выше. В-лимфоциты новорожденных имеют, как правило, незрелый фенотип с повышенной экспрессией СD38 и СD10 и снижением экспрессии СD20 и СD21. С этой незрелостью связаны особенности гуморального иммунитета у новорожденных. Имеющиеся у новорожденного антитела в основном получены от матери пренатально. Через плаценту проникают все субклассы IgG, в особенности IgG1 и IgG3, благодаря большей аффинности к ним Fc-рецепторов трофобласта, начиная с 12-й недели беременности. Слабее всего из четырех субклассов IgG проникает IgG2. Трансплацентарно поступающий плоду IgG матери выполняет ряд функций: обеспечение специфического пассивного иммунитета и торможение активности антителообразования.
Таблица 1.Нормальные показатели содержания иммуннокомпетентных клеток в зависимости от возраста.
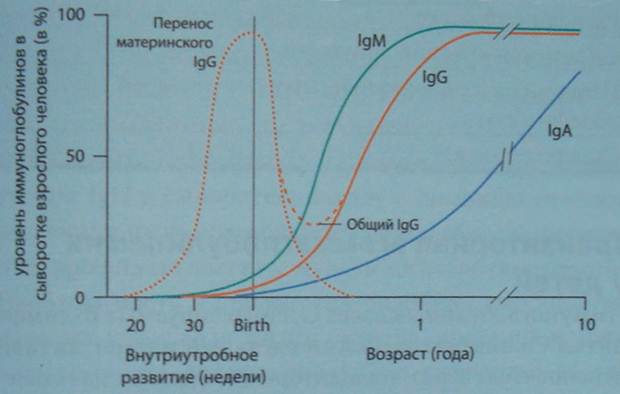
С трансплацентарным переходом в патологических условиях IgG связывают развитие таких заболеваний новорожденных как аллоиммунные, или изоиммунные цитопении (нейтропении, тромбоцитопении) у детей матерей, страдающих аутоиммунными цитопениями; гемолитической болезни новорожденных при АВ0-, резус-несовместимости или несовместимости эритроцитов по редким факторам; неонатальной красной волчанки обычно при переходе аутоантител к Rо-антигенам клеточных ядер от матерей, страдающих системной красной волчанкой; врожденного тиреотоксикоза у детей матерей с аутоиммунным диффузным токсическим зобом вследствие проникновения через плаценту тиреоидстимулирующих антител. В то же время, отсутствие свободного транспорта IgМ от матери (к данному классу принадлежат естественные материнские антитела, в том числе групповые изогемагглютинины) предотвращает гемолитическую болезнь новорожденных по системе АВ0 в случае гетероспецифической (разные группы крови матери и ребенка) беременности. Сыворотка пуповинной крови содержит также небольшое количество IgМ (10% его уровня у взрослых) и несколько нанограммов IgA, IgD и IgE. Поскольку для этих иммуноглобулинов плацента непроницаема, они, по-видимому, образуются в организме плода. В «стерильный» плод, таким образом, поступают некоторые антигены из крови матери, вызывая у него иммунные реакции. Действительно, при атопическом дерматите у грудных детей иногда обнаруживаются антитела к антигенам, с которыми ребенок ранее не сталкивался. По всей вероятности, синтез таких антител (класса IgE) индуцируется у плода антигенами пищи матери. В ряде случаев такие антигены обнаруживали в амниотической жидкости. Высокий уровень IgМ-антител в сыворотке крови является маркером внутриутробных инфекций. В течение первых месяцев происходит распад и удаление IgG, переданных трансплацентарно от матери. Период «полужизни» IgG составляет 21 день. Высокая концентрация IgG в первые месяцы жизни обуславливает защиту организма от грамположительных бактерий и вирусов, а также неэффективность вакцинации в этом возрасте – антигены вакцин связываются циркулирующими материнскими антителами. Поскольку в крови недоношенных детей к моменту рождения содержится мало IgG, опсонизирующая активность их крови снижена по отношению ко всем микроорганизмам. Этим объясняется, в частности, высокая частота сепсиса у недоношенных детей, увеличивающаяся обратно пропорционально гестационному возрасту и массе тела при рождении. Материнский IgG, прошедший через плацентарный барьер, исчезает из организма ребёнка к шестому месяцу жизни. Результатом этого является «физиологический провал» в уровне IgG, наблюдаемый между 3 и 6 месяцами жизни ребёнка, что обуславливает повышенную чувствительность детей данного возраста к инфекциям. По мере синтеза собственных IgG уровень данного иммуноглобулина начинает медленно увеличиваться. Однако у ряда детей эта физиологическая гипогаммаглобулинемия сохраняется после 6-месячного возраста. В этих случаях говорят о преходящей (транзиторной) младенческой гипогаммаглобулинемии грудных детей. Количество Т- и В-лимфоцитов, а также функция Т-лимфоцитов и специфическое антителообразование нормальны. Данное состояние, являющееся пограничным между нормой и патологией и расцениваемое еще как поздний иммунологический старт, может сопровождаться повышенным риском инфекций (среднего отита, синуситов, бронхитов). Критерии диагностики данного состояния полностью не стандартизированы. Считается, что о транзиторной гипогаммаглобулинемии свидетельствует снижение концентрации одного или более изотипов иммуноглобулина более чем на два стандартных отклонения от возрастной нормы. Во всех случаях транзиторной младенческой гипогаммаглобулинемии с возрастом происходит нормализация уровней иммуноглобулинов, что отличает данное состояние от первичных иммунодефицитов. К концу первого года жизни в норме уровень IgG составляет примерно 60% от показателей взрослых, к концу 2-го года – 80%, а к 7-8 годам он достигает средних значений взрослых. Концентрации IgG1 и IgG3 субклассов также достигают уровня взрослых к 8 годам. В отличие от них IgG2 и IgG4 субклассы синтезируются медленнее и достигают «взрослых» величин лишь к 10-12 годам. С медленным ростом количества IgG2 и IgG4 субклассов связывают повышенную чувствительность детей первых двух лет жизни к инфекциям, вызванным гемофильной палочкой, менингококком и пневмококком, так как именно эти субклассы антител синтезируются в ответ на полисахаридные антигены перечисленных микроорганизмов. Так, по некоторым данным, у 30% детей второго года жизни отсутствует гуморальный иммунитет к гемофильной палочке. При стимуляции В-лимфоциты новорожденных синтезируют менее разнообразные иммуноглобулины (в основном IgM) и в гораздо меньшем количестве, чем В-лимфоциты старших детей и взрослых. IgM-антитела представляют собой термостабильные опсонины. Низкой концентрацией их после рождения объясняется неэффективность фагоцитоза, что является причиной повышенной восприимчивости детей в данном возрасте к грамотрицательным бактериям. Концентрация IgM в сыворотке крови резко возрастает примерно к 6-му дню жизни и продолжает увеличиваться, постепенно достигая уровня взрослых к годовалому возрасту. На первом году жизни на большинство инфекционных антигенов развивается первичный иммунный ответ с преимущественным синтезом антител класса IgM, не оставляя иммунологической памяти. Такой тип иммунного ответа наступает также и при вакцинации, вторичный иммунный ответ с формированием IgG-антител и клеток иммунологической памяти развивается лишь после 2-3-й вакцинации. Преобладание первичного иммунного ответа над вторичным у детей грудного возраста, таким образом, определяет необходимость ревакцинаций на первом году жизни (вакцины против коклюша, дифтерии, столбняка, полиомиелита, гепатита В). В сыворотке пуповинной крови IgА практически отсутствует. Впервые его удается определить около 13-го дня после рождения. Далее уровень данного иммуноглобулина повышается медленно, достигая к 1 году лишь 20% от взрослых нормативов, а к концу 2-го года – 40%. Концентрация IgА достигает «взрослого» уровня к 10-12-му году. Секреторный sIgА полностью отсутствует у новорожденных, впервые появляясь в секретах на 2-м месяце жизни и достигая значений взрослых к 6-7-летнему возрасту. Данный факт позволяет говорить об относительной недостаточности системы местного иммунитета у детей первых лет жизни, чем определяется повышенная чувствительность их к респираторным и кишечным инфекциям, а также к проникающим через слизистую оболочку кишечника аллергенам. Уровень IgЕ, как правило, изменяется параллельно содержанию IgА. Нарастание концентрации IgЕ в большой степени коррелирует с началом проявлений аллергических и, гораздо реже, других заболеваний (гельминтозы, паразитозы).Иммуноглобулин D в сыворотке крови у новорожденных имеет концентрацию 0,001 г/л. Затем она нарастает после 6-й недели жизни и достигает значений, свойственных взрослым, к 5-10 годам. Возрастная динамика иммуноглобулинов разных классов представлена на табл.2 и на рис. 1.
Рис.1. Возрастная динамика иммуноглобулинов разных классов
Таблица 2.Нормальные показатели гуморального иммунитета в зависимости от возраста.
Наряду со сниженными показателями общего уровня иммуноглобулинов разных классов, крайним выражением которого является транзиторная младенческая гипогаммаглобулинемия, у ряда детей отмечается дефицит специфического антителообразования. При заболевании кишечными инфекциями (сальмонеллез, эшерихиоз, дизентерия) антитела к их возбудителям у детей первых 6 месяцев жизни обнаруживаются лишь у 1/3 больных в возрасте от 6 до 12 месяцев, а у детей на втором году жизни – почти у 60%. Аналогичным образом при заболевании острыми респираторными инфекциями (аденовирусная, парагрипп) сероконверсия у детей одного года обнаруживается лишь у 1/3 переболевших ими, а на втором году жизни – уже у 60%. Данный феномен определяет особенности течения указанных инфекций у детей грудного и раннего возраста (большая тяжесть), а также вероятность ложноотрицательных результатов серологической диагностики. Таким образом, возрастные физиологические особенности иммунитета у детей, в особенности первых лет жизни, определяют существенное повышение их чувствительности как к инфекционным факторам среды, так и к экспозиции аллергенов. Это определяет многие требования к уходу за детьми и профилактике их заболеваний. Сюда включается необходимость особого контроля за контактом с инфекционными больными (дети вплоть до 4-х-летнего возраста биологически не готовы к постоянному пребыванию в коллективе), целесообразность индивидуального или минигруппового воспитания, контроль за качеством пищевых продуктов и их переносимостью по симптоматике аллергических реакций. В этом контексте грудное вскармливание представляет собой уникальный механизм, компенсирующий физиологический иммунодефицит детей грудного возраста за счет присутствующих в молозиве и зрелом молоке факторов иммунной системы. К этим факторам относятся как растворимые компоненты (иммуноглобулины, прежде всего IgА и sIgА; цитокины – ИЛ-1, 2, 4, 5, 6, 8, 10, 12, 13, 16, 18, ИФН γ, ФНО α; хемокины и рецепторы – RANTES, CD 14, sFas, FasL; факторы роста – G-CSF, TGF, NGF, эритропоэтины; факторы врожденного иммунитета – комплемент, лактоферрин, лизоцим, пропердин, манноз-связывающий белок, альфафетопротеин, муцины, дефензины; простагландины), так и клетки (макрофаги, нейтрофилы, лимфоциты, преимущественно Т-лимфоциты). Грудное вскармливание ассоциируется со снижением частоты инфекционных, аллергических и аутоиммунных заболеваний у детей, по сравнению с детьми, получающими искусственное вскармливание. Повышение содержания иммуноглобулинов, обучение лимфоцитов и приобретение ими иммунологической памяти совпадает со снижением уровня инфекционной заболеваемости у детей к 5 годам жизни, а также с более легким и доброкачественным течением многих инфекционных заболеваний. Старение иммунной системы и связанные с ним особенности иммунитета. Изменения в иммунной системе, приводящие к старческому иммунодефициту, постепенно проявляются в течение всей жизни человека. Клинически значимые проявления иммунодефицита появляются обычно в возрасте более 70 лет или могут не проявляться вовсе. Возрастные проявления старения тесно связаны с инволюцией тимуса, которая начинается с годовалого возраста и проходит ряд этапов: 1. "Перифериализация" функций тимуса, т.е. передача части "полномочий" от тимуса перефирическому отделу иммунной системы - популяции периферических Т-лимфоцитов. В основе этого процесса лежит накопление на периферии набора Т-клеток памяти, против эпитопов основных внешних агентов (инфекционных, пищевых), часто встречающихся в данной экосистеме. Пул клеток поддерживается за счет периферических механизмов. При необходимости ответа на более экзотические иммуногены поддерживается в незначительном масштабе обычный тимусзависимый путь развития Т-клеток из костномозговых предшественников. В случае массовой гибели Т-клеток (стресс, действие радиации), функция тимуса временно усиливается до восстановления утраченного пула периферических Т-клеток. С возрастом эта "поддерживающая" функция тимуса ослабевает. 2. Снижение способности тимуса привлекать клетки-предшественники и "пропускной способности" в отношении созревающих Т-клеток. Уже в 1-ю неделю после рождения резко уменьшается способность стромы тимуса заполняться лимфоцитами в условиях сингенной трансплантации. 3. Атрофия эпителиального ретикулума происходит практически в течение всей жизни, резкое опустошение тимуса проявляется после 60 лет. При этом масса тимуса не меняется, поскольку лимфоэпителиальные структуры замещаются жировой тканью. Участки нормальной ткани тимуса сохраняются вокруг сосудов и в большей степени в мозговом слое, чем в коре. Потеря активной ткани тимуса составляет в среднем возрасте - 3 %, а в старости - 1%. Теоретически при таком темпе она должна практически полностью исчезнуть к 120 годам. 4. Снижается секреторная активность эпителия тимуса. С периода полового созревания неуклонно уменьшается секреция основного гормона тимуса - тимулина. К 60 годам гормон практически не удается обнаружить функциональными тестами. Уровень других гормонов тимуса с возрастом также снижается, хотя и несколько слабее. Функциональная недостаточность периферических Т-лимфоцитов, вследствие дефицита гормонов тимуса, может достаточно долго компенсироваться. Снижение численности Т-лимфоцитов на периферии регистрируется после 60 лет и в большей степени затрагивает CD4+, чем CD8+ - субпопуляцию, а среди хелперов в большей степени Th1, чем Th2-клетки. При этом численность В-лимфоцитов и NK-клеток существенно не изменяется, а активность фагоцитов даже повышается. Ослабление иммунной защиты, связанное с описанными изменениями, затрагивает реакции обусловленные Т-клетками (подавлены реакции на распространенные антигены и митогены). Полагают, что это служит одной из причин, способствующих повышению частоты опухолей в старости. Происходит подавление тимусзависимого гуморального ответа и в то же время повышение концентрации Ig, преимущественно классов Ig G и Ig A. Происходит снижение аффинности антител, преобладают низкоаффинные антитела. Значительно чаще наблюдаются аллергические реакции. Накапливаются аутоантитела как к органонеспецифическим (ДНК, коллаген, Ig G), так и к органоспецифическим (белки щитовидной железы) антигенам. Их титр повышен примерно у 50 % старых людей. Хотя у человека накопление аутоантител довольно редко сочетается с клиническими проявлениями аутоиммунных нарушений, отмечена положительная связь смертности старых людей (от сосудистых заболеваний, рака) с повышением уровня аутоантител. Гиперпродукцию аутоантител связывают с ослаблением контроля со стороны Т-супрессоров (вето-клеток), что в свою очередь обусловлено гипофункцией тимуса. Не вызывает сомнения ключевая роль тимуса в развитии возрастного иммунодефицита хотя нельзя исключить воздействие и неблагоприятных факторов среды (например, лучевого). Иммунологические изменения, происходящие при старении, однонаправлены, и необратимы. 1.3.Особенности функционирования иммунной системы при беременности, лактации и менопаузе. Плод как аллотрансплантат. В иммунологическом аспекте вынашивание плода с полным набором чужеродных антигенов в течение длительного времени является иммунологическим парадоксом. Действительно, у млекопитающих срок жизни аллогенных трансплантатов, несовместимых по сильным антигенам системы HLA (МНС), составляет в среднем 10—15 дней. Однако эмбрион, у которого HLA-антигены появляются уже через 96 ч после оплодотворения (8 клеточных делений), несущий полный набор антигенов отца, не только не отторгается, но и полноценно развивается в течение нужного времени. Более того, повторные беременности от того же отца не только не индуцируют отторжения плода, но и не влияют на сроки беременности. Иными словами, полностью не работают законы трансплантационного иммунитета. Хотя причины не отторжения плода остаются до конца не выясненными, есть основание полагать, что решающую роль в предотвращении реакции отторжения играют иммунологические потенции трофобласта и иммунные механизмы, регулирующие взаимоотношения плода и матери. Современная литература, посвященной этому вопросу, позволяет сформулировать ряд механизмов, обеспечивающих производство потомства. Роль трофобласта заключается в выполнении, во-первых, барьерной функции, нарушение которой (в результате травм) приводит к реакции отторжения и аборту. Вторая особенность трофобласта — это отсутствие на нем свободных для распознавания HLA-антигенов матери и плода. Скорее всего речь идет о феномене специфической блокады этих антигенов с помощью антител матери (третья функция трофобласта). Данное обстоятельство не позволяет иммунной системе развивать реакции отторжения ни со стороны матери, ни со стороны плода, так называемая «реакция трансплантат против хозяина» (РТПХ). Это положение подтверждается тем, что бесклеточные субстраты ткани трофобласта обладают способностью подавлять пролиферативный ответ лимфоцитов in vitro. Эти антитела представляют собой местно синтезируемые в матке и плаценте IgG против HLA-антигенов на клетках эмбриона и лимфоцитах матери. Рассматривается также специфическая роль так называемого отрицательно заряженного мукополисахарида, обладающего способностью маскировать антигены плаценты. Супрессивные гуморальные и клеточные факторы. Существует достаточно много сообщений о том, что в организме матери все же синтезируется некоторое число антител и сенсибилизированных лимфоцитов против антигенов плода, но они не оказывают своего патогенного действия. Однако выдвинуто убедительное предположение, что в основе развития нефропатий при беременности, осложненной поздним токсикозом, лежит нарушение способности материнского организма вырабатывать антитела, блокирующие антигенные маркеры плаценты, которые перекрестно реагируют (общие антигенные детерминанты) с антигенными компонентами почечных клубочков и тканей головного мозга. Таким образом, в норме в организме матери вырабатываются супрессирующие факторы (антитела и «отрицательно заряженный мукополисахарид»), содержание которых нарастает с увеличением срока беременности. Кроме того, в организме матери возрастает более чем в 2 раза активность Т-лимфоцитов, обладающих супрессорной функцией, что поддерживает специфическое иммунодепрессивное состояние. Большинство Т-супрессоров находится непосредственно в лимфатических узлах, дренирующих матку. Более того, имеется и второй клеточный механизм иммуносупрессии — макрофагальный, осуществляемый местно расположенными макрофагами с большим числом Fc IgG-рецепторов. Кроме механизмов, создающихся материнской иммунной системой, в процессе эмбриогенеза начинают синтезироваться (на 12— 16-й неделе) фетальные антигены. Это фетопротеины α (АФП), α2 , р-протеин и др. Данная группа, включающая примерно 10 антигенов, получила название раково-эмбриональных антигенов, поскольку они синтезируются и эмбрионом, и клетками опухолей печени. В том и другом случае синтез этих антигенов оказывает дополнительное иммуносупрессивное действие. Иммунитет и беременность. Таким образом, в организме матери при нормально протекающей беременности всегда специально создается состояние временного частичного иммунодефицита, непосредственно обеспечивающее вынашивание плода. При этом в иммунном статусе организма матери наблюдается: —снижение уровня IgG в сыворотке крови, возможно, вследствие переноса IgG через плаценту и временного, на период беременности, изменения механизмов регуляции синтеза IgG; —компенсаторно в ряде случаев может умеренно увеличиваться —значительно угнетается функциональное состояние фагоцитарных нейтрофилов крови (особенно хемотаксис и бактерицидность по отношению к грамотрицательной и кокковой флоре), а также синтез активных форм кислорода макрофагами. То есть их кислород зависимая бактерицидность; —увеличивается число Т-супрессоров, но без значительных изменений соотношения Т- и В-лимфоцитов. Интересно отметить, что при задержке в матке остатков трофобласта (после выкидышей или патологических родов) наблюдается реверсия соотношения Т- и В-клеток. Сформировавшийся при беременности иммунный статус (дефицит IgG, угнетение фагоцитоза нейтрофилов и макрофагов, гиперфункция Т-супрессоров) приводит прежде всего к повышенной восприимчивости к вирусной (грипп, гепатит, полиомиелит, краснуха, ветряная оспа) и бактериальной (особенно стрептококковая) инфекции. Несмотря на это, следует помнить, что любые попытки воздействия на иммунную систему беременных могут существенно осложнить беременность или стимулировать выкидыш и, следовательно, нецелесообразны и даже опасны. Исключением является Rh-конфликт при беременности. Гемолитическая болезнь новорожденных, или Rh-конфликт. Лечение этой патологии относится к наиболее ярким достижениям клинической иммунологии, и практически проблему Rh-конфликта можно считать решенной.
Если aнти-Rh-aнтителa не вводили профилактически, то необходимо их вводить во время беременности. Стандартная доза при однократном введении составляет 300 мкг. До внедрения иммунопрофилактики в широкую практику гемолитической болезни новорожденных внутриутробная смертность в результате Rh-конфликта составляла, по данным ВОЗ, 5—10%. Иммунология лактации. Возрастные особенности онтогенеза иммунной системы новорожденных определяются как физиологическое иммунодефицитное состояние. В создании пассивного иммунитета в этот период большую роль играет IgG, проникший через плаценту из организма матери. Концентрация IgG у новорожденных в норме значительно превышает показатели у взрослого человека, но при недостатке IgA- и IgM-антител. В раннем постнатальном периоде основные факторы иммунитета ребенок получает от матери через молозиво и молоко (табл. 19). Кроме того, в молоке содержатся лизоцим (мураминидаза), фактор резистентности к стафилококку, лактопероксидаза, лактоферрин, интерфероны, комплемент, иммуноглобулины (IgM и IgG в форме сывороточных иммуноглобулинов, a IgA в основном в виде S-IgA, причем в молозиве S-IgA в 15—40 раз больше, чем в молоке!). В молоке высокое содержание S-IgA восполняет недостаточность местного иммунитета кишечника ребенка и препятствует развитию инфекций, обусловленных Е. coli, пневмококками, стрептококками, холерным вибрионом и вирусом полиомиелита, к которым S-IgA имеет особое сродство. Аллергия к грудному молоку. К сожалению, нередко у детей наблюдается аллергия к молоку матери. Основными антигенами (аллергенами) молока являются лактоальбумины, казеин и сывороточные альбумины. Аллергия I типа, особенно в сочетании с реакциями II—IV типа, может вызвать серьезные нарушения — геморрагии, поносы и даже отек гортани и легкого. Встречаются случаи аллергии к собственному молоку у кормящих матерей. При этом развиваются тяжелые неинфекционные маститы и/или прекращается лактация. Иммунологические аспекты климактерического синдрома. Развитие менопаузы и климактерический синдром сопровождаются не только гормональными,но и иммунологическими нарушениями. Развитие климактерического синдрома (КС) и его тяжесть во многом определяются гиперактивностью аутоиммунных реакций по отношению к компонентам яичников. В качестве критериев тяжести КС еще в 1988 году акушер-гинеколог Майданник И.Л. предложила использовать величины титров антител против яичников: легкая степень тяжести — от 1:8 до 1:32; средняя степень тяжести — от 1:32 до 1128-тяжелый КС - выше 1:128. Показатели антител при тяжелом климактерическом синдроме как правило в 8-10 раз выше, чем при легком варианте течения. Механизмом поддержания аутоагрессии при КС служит снижение функции Т-супрессоров при умеренной активации В-клеток за счет гиперпродукции IgG. Климактерический синдром, осложненный ожирением, сопровождается уменьшением активности фагоцитов.Эти факты привели к успешному использованию для коррекции иммунного статуса и самих проявлений КС (наряду с заместительной гормональной терапией) тималина, или тактивина, спленина (в сочетании с витаминами Е и С, глютаминовой кислотой). Необходимо помнить, что иммунный статус у больных КС имеет некоторые отличия от такового у лиц старшего возраста (более 70 лет). Первые признаки возрастных дисфункций иммунитета иногда выявляются у лиц обоего пола в возрасте более 50 лет: гиперпродукция IgG- и IgA-антител при снижении уровня S-IgA и аутоантител, снижение функции Т-лимфоцитов, но увеличение содержания CD8+-T-клеток (цитотоксических клеток). Таким образом, снижается в целом «цензорная» функция иммунитета, что обусловливает повышенную частоту онкологических, аутоиммунных и инфекционных заболеваний у людей старшего возраста. Согласно иммунологической теории старения G.Walford, сформулированной в 1971 году, в течение жизни человека накапливаются соматические мутации и повышается вероятность изменений аутоантигенов, распознающихся как чужеродные. Это дает начало аутоагрессии, прежде всего по отношению к ДНК и клеткам эндокринных желез. Существуют еще две проблемы взаимоотношения иммунной и репродуктивной функции организма: бесплодие и предупреждение нежелательной беременности. Хорошо известно, что значительная часть (20—25%) всех случаев бесплодия относится к аутоиммунным формам. Суть аутоиммунного бесплодия заключается в продукции антител против антигенов сперматозоидов, при этом последние блокируются или погибают. В первом случае сохраняется почти неизменная подвижность сперматозоидов. У мужчин продукция аутоантител к сперматозоидам (иммунологически изолированная ткань) возможна лишь при травмах или инфекциях наружных половых органов. В подобных случаях в несколько раз увеличивается число спермальных антител. Наиболее точным методом диагностики этих нарушений является иммуноферментный анализ (ИФА) и MAR-test. Лечение заключается в санации урогенитальных инфекций, травм или элиминации условий повторения контакта с травматизирующим фактором (в том числе профессиональным). В организме женщин в ряде случаев также могут продуцироваться антиспермальные антитела, иногда даже без влияния каких-либо воспалительных или травматизирующих процессов (иммунный ответ на чужеродный антиген). Способ выявления этой формы бесплодия аналогичен предыдущему, а лечение заключается во временном прекращении непосредственного контакта с партнером при контроле титра антител. Что касается иммунологических приемов профилактики нежелательной беременности, практические результаты исследований следует ожидать в ближайшее время. Способы же иммунодиагностики беременности, начиная с 96 ч после оплодотворения, вполне доступны (специальные диагностикумы для самоконтроля и самодиагноза можно приобрести в аптеках).
1.3. Факторы врожденного иммунитета
Факторы врожденного иммунитета организма включают в себя целый ряд компонентов (таблица 3). Таблица 3. Факторы врожденного иммунитета
1. Физические (анатомические) барьеры. Кожа, слизистые оболочки респираторного и желудочно-кишечного тракта, мерцательный эпителий, секреты слизистых, слезных и потовых желез препятствуют колонизации патогенами. 2. Физиологические барьеры. Этот тип защиты включает температуру тела, кислотность желудочного сока, также препятствующие колонизации. 3. Фагоцитоз – это особый процесс поглощения клеткой крупных макромолекулярных комплексов или корпускулярных структур. Высокопрофессиональными фагоцитами у млекопитающих являются всего два типа клеток – нейтрофилы и моноциты/макрофаги. Цель фагоцитоза – полное биохимическое расщепление до мелких метаболитов содержимого фагосомы при помощи специальных ферментов. Фагоцитоз включает ряд стадий (таблица 4).
Таблица 4. Стадии фагоцитоза
Фагоцитоз занимает промежуточное место между врожденным и приобретенным иммунитетом, так как итогом фагоцитоза макрофагами является экспрессия антигенной части молекулы возбудителя для последующего развития иммунного ответа («представление антигена»). 3. Естественные киллеры (NK-клетки, от nature killer) представляют собой популяцию лимфоцитов, лишенных признаков Т- и В-лимфоцитов. Их клеточными мембранными маркерами являются молекулы CD16 и CD56. Их участие в функции врожденного иммунитета состоит в способности оказывать прямое цитотоксическое действие на злокачественные и вирусиндуцированные клетки, а также клетки, поглотившие внутриклеточные бактерии. Существует две субпопуляции NK-клеток: циркулирующие в крови и тканевые (в печени и децидуальной оболочке беременной матки). Они различаются мембранным фенотипом и функциональными обязанностями в организме. “Кровяные” NK-клетки имеют фенотип CD56+(мало)/CD16+ и несут рецептор для Fc-фрагмента IgG. Благодаря наличию этого рецептора “кровяные” NK распознают инфицированные вирусами клетки, на поверхность которых сели антитела класса IgG против вирусных антигенов, и развивают в отношении этих клеток антителзависимую клеточную цитотоксичность. Собственно механизм убийства инфицированной клетки такой же, как у ЦТЛ - выделение перфорина в месте контакта с мембраной клетки-мишени, через поры которой впрыскиваются гранзимы, обеспечивающие развитие апоптоза. NK-клетки тканевых популяций имеют другой мембранный фенотип CD56+/CD16-. Возможно, что их главная физиологическая функция – киллерная в отношении активированных лимфоцитов. В печени эти NK-клетки убивают лимфоциты, принесенные из кишечника в кровь и активированные против пищевых антигенов. 5. Гуморальные факторы секретов - лизоцим, интерфероны, пропердин, лактоферин. Лизоцим – гидролитический фермент секретов слизи – способен разрушать пептидогликаны клеточных стенок бактерий. Интерфероны – группа белков, продуцируемых вирусинфицированными или активированными клетками. Среди прочих иммунорегуляторных функций интерфероны способны прямо подавлять размножение вирусов. Пропердин – один из компонентов комплемента, обладающий цитолитическим действием на бактерии. Лактоферрин – фактор секретов, связывающий железо, необходимое для пролиферации бактерий. 6. Комплемент (to complement – дополнить) – это сложный белковый комплекс, состоящий из более 25 сывороточных белков и нескольких белков клеточных мембран. Основные компоненты комплемента получили обозначение от С1 до С9, остальные выполняют регуляторные функции (таблица 3). Компоненты комплемента синтезируются преимущественно макрофагами и гепатоцитами. Подобно белкам свертывания крови комплемент активируется за счет каскадного процесса, когда продукт предыдущей реакции выполняет роль катализатора следующей. Активация системы комплемента в основном осуществляется тремя путями: при помощи иммунных комплексов (классический путь) или без участия антител (альтернативный путь, лектиновый путь). Классический путь активации инициируется комплексами антиген-антитело. На молекулах IgM, IgG3, IgG1 есть специальные реакционно-способные участки, которые после формирования комплекса антиген-антитело способны связывать компонент С1 комплемента, а именно субкомпонент С1q. Реакция связывания С1q с антителами происходит только на поверхности микробных клеток. Альтернативный путь активации инициируется клетками микроорганизмов. В сыворотке крови всегда имеется небольшой, но значимый уровень спонтанного расщепления С3 белка на C3a и C3b. Последний способен ковалентно связываться с поверхностными молекулами не всех, но некоторых микроорганизмов. Для него же есть рецепторы на фагоцитах. Кроме того, С3b, связанный с поверхностью микробных клеток, активирует другие компоненты системы комплемента. Так расщепляется С5 до С5а и С5b. С5а и С3а являются медиаторами воспалительной реакции и являются анафилотоксинами. Для них существуют рецепторы на тучных клетках (выброс содержимого гранул), на гладких мышцах (сокращение), они повышают активность, адгезию и экстравазацию фагоцитов. С С5b начинается реакция расщепления С5 -С9, завершающаяся формированием мембраноатакующего комплекса (МАК), с последующей перфорацией и лизисом микробной клетки. Два пути действуют одновременно, потенцируя друг друга. Лектиновый путь активации начинается со связывания с углеводами поверхностных структур микробных клеток МСЛ, что катализирует активное расщепление С4. Дальнейшие реакции лектинового пути активации полностью тождественны классическому пути активации. Таблица 5. Дата добавления: 2014-12-12 | Просмотры: 1430 | Нарушение авторских прав |

 Суть феномена состоит в том, что гемолиз эритроцитов происходит у Rh+ детей, вынашиваемых Rh- матерями. Сенсибилизация у Rh- матерей может развиться в результате родов или абортов, поэтому частота абортов и родов усугубляет тяжесть Rh конфликта и повышает интенсивность гемолиза. Поскольку антигены Rh-системы расположены на поверхности эритроцитов, то повторная беременность протекает при развитии агрессии иммунной системы по отношению эритроцитов плода с их гемолизом (реакции II и III типа по P.Gell и R.Coombs). Этот процесс легко купируется введением aнти-Rh-иммуноглобулина, который образует непатогенные иммунные комплексы с антителами против эритроцитов и элиминируется из организма. Такая иммунизация необходима всем Rh-женщинам после первого аборта или сразу после рождения Rh+-pe6eнкa.
Суть феномена состоит в том, что гемолиз эритроцитов происходит у Rh+ детей, вынашиваемых Rh- матерями. Сенсибилизация у Rh- матерей может развиться в результате родов или абортов, поэтому частота абортов и родов усугубляет тяжесть Rh конфликта и повышает интенсивность гемолиза. Поскольку антигены Rh-системы расположены на поверхности эритроцитов, то повторная беременность протекает при развитии агрессии иммунной системы по отношению эритроцитов плода с их гемолизом (реакции II и III типа по P.Gell и R.Coombs). Этот процесс легко купируется введением aнти-Rh-иммуноглобулина, который образует непатогенные иммунные комплексы с антителами против эритроцитов и элиминируется из организма. Такая иммунизация необходима всем Rh-женщинам после первого аборта или сразу после рождения Rh+-pe6eнкa.