|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология
|
Сравнительная активность некоторых противовирусных препаратов в отношении синтеза ДНК HBV в клетках гепатобластомы Hep G2 2.2.15
| Препарат
| EC50 (мкМ)a
| CC50 (мкМ)b
| SIc
| Литература
| | Ацикловир
| > 100
|
|
| 6,7
| | Ганцикловир
| > 100
|
|
|
| | Пенцикловир
| 0,6 3,5 (мкг/мл) 100
|
|
| 6 8 7
| | CDG (2'-карбоциклический диоксигуанозин)
| 0,05
|
|
|
| | Лобукавир
| 0,02 2,5 (мкг/мл)
|
|
| 8 7
| | BMS-200475
| 0,00375
|
|
|
| | AZT
| > 100
|
|
|
| | d4T
| > 100
|
|
|
| | ddC
| 6,2 100
|
| –
| 9 7
| | d4C
|
|
|
|
| | L-FddC
| 0,036 0,2
|
|
| 9 7
| | L-d4C
| 0,008
|
|
|
| | L-Fd4C
| 0,002
|
|
|
| | 3TC
| 0,008 0,02 0,03 0,116 0,2 5 (мкг/мл)
| – 1722
| – 8610
| 10 11 9 7 6 8
| | -FTC
| 0,01
|
|
|
| | FIAU
| 0,9 10
|
|
| 12 7
| | L-FMAU
| 0,1
| > 200
|
|
| | ddA
| > 10
|
|
|
| | d4A
| > 10
|
|
|
| | ddI
| > 100
|
|
|
| | L-FaraA
| 1,5
| > 200
|
|
| | DXG
| 0,09 3,4 (мкг/мл)
|
|
| 16 8
| | ACPD
| 0,001
|
|
|
| | DAPD
| 4 (мкг/мл)
|
|
|
| | HPMPA
| 1,1 1,5
| 77 > 100
| 79 > 67
| 17d 18
| | HPMPDAP
| 1,3
|
|
|
| | HPMPC
| 29 14
| 193 > 100
| 7 > 7
| 17 18
| | PMEA
| 0,2 0,7 1,2 0,09 (мкг/мл)
| 107 150 > 100
| 535 200 > 83
| 17 19 18 8
| | PMEDAP
| 0,07
| 122x
|
| 17d
| | PMPA
| 1,5 0,03 (мкг/мл)
| > 100
| > 67
| 18 8
| | PMPDAP
| 0,22x
| > 100
| > 455
|
| | a EC50: 50% эффективная концентрация. b CC50: 50% цитотоксическая концентрация. c SI: индекс селективности, или коэффициент CC50/EC50. d Данные, полученные на HB 611, а не на клетках гепатобластомы Hep G2 2.2.15.
|
| Механизм действия антивирусных препаратов
Многоступенчатый механизм репликации гепаднавирусов начинается с обратной транскрипции прегеномной РНК (рис. 1). Синтез ДНК запускается стартовым белком, который непосредствено прикрепляется к первому нуклеотиду ан-тисмысловой цепи ДНК [21]. Затем на антисмысловой цепи синтезируется смысловая цепь ДНК с образованием завер-шенной двухцепочечной ДНК вируса.
Таким образом, вирусоспецифическая ДНК-полимераза гепаднавирусов обладает активностью РНК-зависимой (обратно транскриптазной) и ДНК-зависимой ДНК-полимеразы. Обсуждаемые в статье антивирусные агенты блокируют актив-ность обоих ферментов.
С этих позиций все препараты, активные против HBV, независимо от класса, к которому они принадлежат (1, 2, 3, 4 или 5-му), должны быть фосфорилированы внутри клетки с образованием трифосфатов (рис. 3, 5). Реакция фосфорилирова-ния происходит, в свою очередь, независимо от присутствия вируса или продуктов его жизнедеятельности в клетке [22].
Доказано, что клеточные ферменты катализируют реакцию фосфорилирования таких антивирусных агентов, как лами-вудин (3ТС) и пенцикловир, в гепатоцитах или клетках гепатобластомы, то есть Hep G2 2.2.15. Наиболее важными фер-ментами, вовлеченными в процесс фосфорилирования, являются диоксицитидинкиназа, dCMP-киназа и NDP (нуклеозид дифосфат)-киназа [23].
После ферментативного преобразования в трифосфатные формы 3ТС пенцикловир и другие препараты этого класса при-водят к терминации цепи ДНК и таким образом подавляют репликацию ДНК HBV [22, 24].
Теоретически за счет дополнительного эквивалента 3'-гидроксильной группы пенцикловир, как и ганцикловир, может непосредственно встраиваться в вирусную ДНК. Специфичность 3ТС, пенцикловира и других представителей этого класса значительно зависит от специфичности их трифосфатов к ДНК-полимеразе HBV, родственной человеческим ДНК-полимеразам a, b, g, d и e.
Следует отметить, что препараты не должны взаимодействовать с ДНК-полимеразами клеток человека и не влиять на синтез митохондриальной ДНК, так как в этом случае значительно повышается гепатотоксичность.
В данной ситуации обнадеживает то, что у 5'-трифосфатов таких препаратов, как L-Fd4C и L-FMAU, подавляющая активность по отношению к ДНК-полимеразам некоторых вирусов значительно выше, чем по отношению к ДНК-полимеразам человека [25, 26]. Однако специфичность 5'-трифосфатов L-Fd4C и L-FMAU в отношении ДНК-полимеразы HBV все еще является предметом изучения.
В культуре клеток L-F4dC подавляет репликацию HBV в 10 раз сильнее, чем 3ТС [27]. При этом в концентрации до 10 мкM L-Fd4C не проявлял активности в отношении синтеза митохондриальной ДНК. Более выраженная анти-HBV активность L-Fd4C в сравнении с таковой у 3ТС может объясняться более высокой внутриклеточной концентрацией 5'-трифосфатов L-F4dC, чем 3ТС. 5'-трифосфат L-Fd4C конкурентно по отношению к dCTP подав-ляет ДНК-полимеразу HBV при Кi, равной 0,07 мкM [27].
Ациклические фосфонаты нуклеозидов изначально имеют фосфатомиметическую (фосфонатную) группу. Поэтому для превращения в активный метаболит препаратам этой группы необходимо только 2 реакции фосфорилирования вместо 3 (рис. 5).
Фосфорилирование до дифосфатных форм у PMEA и, вероятно, у PMPA (PMEApp и PMPApp) происходит в один или два этапа с помощью 5-фосфорибозил- l -пирофосфатсинтетазы [28] или АМР (dАМР)-киназы соответственно.
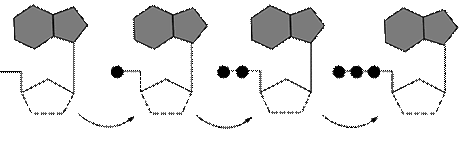
| Ациклические (или карбоциклические) аналоги гуанозина (класс I) и аналоги дидеоксинуклеозида пурина (класс IV)
| 
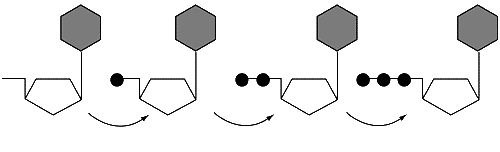
| | Аналоги дидеоксинуклеозида пиримидина (класс II) 2'-фторзамещенные арабинозилпиримидины (класс III)
| 
| | Ациклические фосфонаты нуклеозида (класс V)
| 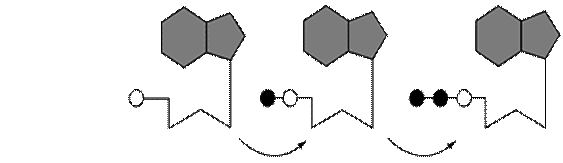
| Рис 5. Внутриклеточный метаболизм анти-HBV препаратов до их трифосфатных форм: ациклические (или карбоцикли-ческие) дидеоксинуклеозидные аналоги гуанозина и пурина. Для превращения в активные метаболиты,то есть в трифос-фатные формы, которые затем конкурируют с нормальными субстратами за ДНК полимеразу, пиримидиновые ди-деоксинуклеозиды и 2'-фторзамещенные арабинозилпиримидины нуждаются в 3 ступенчатом фосфорилировании, в то время как ациклические фосфонаты нуклеозидов нуждаются лишь в 2 ступенчатом фосфорилировании
Селективная антивирусная активность ациклических фосфонатов нуклеозидов объясняется тем, что их дифосфорили-рованные формы имеют большую аффинность (меньший Кi) к вирусной ДНК-полимеразе, то есть к ДНК-полимеразам HSV-1, CMV и HIV, чем к клеточным ДНК-полимеразам a, b, g, d и e [30, 31].
В дальнейшем необходимо оценить специфичность PMEApp и PMPApp к ДНК-полимеразе HBV. На примере реакции обратной транскрипции HIV доказано, что PMEA и PMPA вызывают терминацию цепи. PMPA является более "точным" терминатором цепи обратной транскриптазы HIV-1, чем РМЕА, так как он в меньшей степени инкорпорируется в клее-точные ДНК-полимеразы a, b и g [32].
In vivo активность антивирусных агентов на животных моделях (пекинских уток и сурков)
Подавление репликации DHBV достигнуто при лечении пенцикловиром пекинских уток с хроническим вирусным гепа-титом B - перорально 20 мг/кг или 100 мг/кг 2 раза в день в течение 21 дня или фамцикловиром – перорально 5 мг/кг или 25 мг/кг 2 раза в день в течение 21 дня.
Показателями подавления репликации были снижение уровня вирусной ДНК в плазме крови и уровня ДНК-полимеразы [33]. Через 4 дня от начала лечения указанные маркеры в крови не определялись. Однако через 2–8 дней после отмены препаратов уровни ДНК DHBV и ДНК-полимеразы возвращались к прежнему, что свидетельствует о возобновлении ре-пликации вируса.
В другом исследовании показано существенное снижение уровня внутриклеточной ДНК вируса (включая сссДНК), РНК и белка (предшественника S-антигена и сердцевинного антигена) при лечении пекинских уток, инфицированных DHBV, путем введения пенцикловира внутрибрюшинно по 10 мг/кг в день в течение 10 дней [34].Токсичности, связанной с при-менением пенцикловира, не зарегистрировано. Однако, несмотря на терапию пенцикловиром, в небольших субпопуля-циях эпителиальных клеток желчных протоков обнаруживались антигены DHBV и ДНК вируса.
При длительных курсах лечения пенцикловиром (10 мг/кг в день) в течение 12–24 нед у пекинских уток, врожденно ин-фицированных DHBV, отмечалось значительное снижение уровня всех промежуточных продуктов репликации вируса, включая сссДНК, без признаков токсичности препарата [3].
Подавление репликации DHBV отмечено при лечении экспериментально зараженных уток L-FddC в дозе 25–50 мг/кг 2 раза в день. Ингибирующий эффект L-FddC выражен сильнее, чем у ddC, и не связан с токсичностью препарата. Однако после отмены L-FddC, назначенного коротким курсом (5 дней), как и при лечении пенцикловиром, отмечалось возобнов-ление репликации вируса [35].
Значительное снижение уровня вирусемии достигнуто у экспериментально зараженных уток при назначении L-FMAU перорально короткими курсами (5–8 дней) в дозе 40 мг/кг в день, при этом признаков гепатотоксичности препарата не отмечалось [36]. В отличие от его D-формы (D-FMAU) и "классической" (D-) формы FIAU, L-FMAU не уменьшал содер-жание митохондриальной ДНК, не влиял на функцию митохондрий и не инкорпорировался в клеточную ДНК [13].
Вирус гепатита сурков (ВГС, или WHV – woodchuck hepatitis virus) является более подходящей моделью для оценки эф-фективности анти-HBV агентов, чем DHBV, по двум причинам.
В о - п е р в ы х, по генетической ультраструктуре ВГС гораздо ближе к HBV, чем к DHBV: последовательность нуклео-тидов ВГС на 70% повторяет структуру HBV.
В о - в т о р ы х, степень повреждения печени в большей степени соответствует повреждению печени пациентов, инфи-цированных HBV, чем повреждениям печени уток, зараженных DHBV (по J.M. Cullen et al.) [37].
Экспериментально активность (-)FTC в отношении ВГС подтверждена после назначения препарата внутрибрюшинно в дозе 30 и 20 мг/кг 2 раза в день и последующего определения уровня ДНК ВГС, а также активности частично ассоцииро-ванной ДНК-полимеразы [37].
Снижение уровня ДНК ВГС в плазме в 20–150 раз (в среднем в 56 раз) регистрировали в группе, где препарат вводили по 30 мг/кг дважды в день и в 6–49 раз (в среднем в 27 раз) в группе, где препарат назначали по 20 мг/кг дважды в день. Уровень ДНК-полимеразы снижался соответственно (рис. 6). Через 1 нед после отмены препарата уровни ДНК ВГС и ДНК-полимеразы стали прежними. При курсе лечения до 25 дней (-)FTC токсичности не наблюдалось [37].
У сурков, инфицированных ВГС, при длительном курсе лечения ламивудином (3ТС) медленно, но последовательно снижался титр вируса в плазме до 0,3% и менее от исходного уровня [38].

Рис 6. Эффективность назначения (-)FTC (30 мг/кг 2 раза в день интраперитонеально) на уровень виремии (панель А) и сывороточную активность вирусной ДНК полимеразы (панель В) [37]
Несмотря на продолжительность терапии от 3 до 12 мес, более 95% гепатоцитов у большинства животных оставались инфицированными, а существенное снижение уровня внутрипеченочной сссДНК отмечали только у 3 животных, из ко-торых 2 были в группе, получавшей 3ТС, и один – в группе плацебо. Более того, отмечался рост титра вируса у живот-ных, получавших 3ТС, что может свидетельствовать о распространении резистентных к препарату вирусов через 9–12 мес от начала лечения.
В исследовании W.S. Mason et al. [38] ламивудин не влиял на риск развития новообразований печени, возможно, в силу того, что его назначали животным, инфицированным ВГС более года (13–16 мес). В другом исследовании [39] ламиву-дин, назначенный животным с более ранними сроками заражения ВГС, вызвал незначительное устойчивое снижение ви-русемии и уменьшение риска развития ГЦК.
Клинические исследования анти-HBV препаратов
Некоторые авторы сообщают о положительном влиянии фамцикловира, назначенного для профилактики вирусного ге-патита В у пациентов после трансплантации печени [40, 41]. У больных ХВГ В при 10-дневном курсе лечения фамци-кловир эффективно снижал репликацию HBV [42].
Из 8 пациентов, получавших перед трансплантацией печени фамцикловир для профилактики рецидива вирусного гепа-тита В, у 2 после курса лечения не выявлялась ДНК HBV. Была продемонстрирована сероконверсия анти-HBsAg, оба па-циента оставались ДНК HBV-негативными в течение 2 лет при контрольном их посещении после трансплантации [43].
В другом исследовании доказано, что длительный курс терапии фамцикловиром (125 мг 3 раза в день в течение 3 лет, комбинированная – с интерфероном a-2b) позволял контролировать уровень ДНК HBV и уменьшать проявление симпто-мов HBV-ассоциированного узелкового полиартериита [44].
В Китае в течение года проводилось двойное слепое рандомизированное исследование, в рамках которого 358 больных ХВГ В получали ламивудин перорально 1 раз в день: 142 больным ламивудин назначали по 25 мг, 143 – по 100 мг, а 73 – плацебо [2].
Гистологическая картина (по признакам некроза и воспаления) печени улучшилась на 2 балла и более по индексу Кно-делля: у 56% пациентов, получавших 100 мг ламивудина, у 49% – 25 мг ламивудина, у 25% – плацебо (рис. 7).
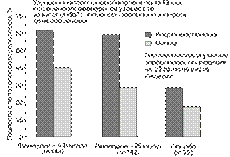
Рис 7. Улучшение или ухудшение течения воспаления и некроза до и после лечения, выявляемые при биопсии у больных хроническим вирусным гепа-титом В, получавших ламивудин (25 и 100 мг/сут в течение 1 года) и плацебо [2]
У пациентов, которым ламивудин был назначен в дозе 100 мг, уменьшилась степень фиброза, улучшились серологичес-кие показатели сероконверсии, в частности исчез HBeAg, отсутствовало развитие антител к HBeAg и не определялся уровень ДНК HBV (16%), отмечены наивысшая супрессия ДНК HBV (снижение на 98% на 52-й неделе лечения) и са-мый продолжительный период нормализации уровня активности АлАТ (72%). На рис. 8 представлен кумулятивный про-цент больных с устойчивой нормализацией уровня активности АлАТ: 65% пациентов, получавших 25 мг препарата, 72% – получавших 100 мг, 24% – получавших плацебо [2].
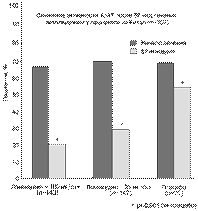
Рис 8. Кумулятивный процент больных хроническим вирусным гепатитом В с устойчивым снижением активности аланинаминотрансферазы, насту-пившим после лечения ламивудином (25 и 100 мг/сут в течение 1 года) по сравнению с плацебо [2]
В исследовании C.L. Lai et al. [2] в течение года соотношение числа пациентов с сероконверсией HBeAg (исчезновение HBeAg и появление антител к HBeAg) и снижением ДНК HBV в сывороке крови до неопределяемого уровня было сле-дующим: 13% в группе пациентов, получавших 25 мг ламивудина, 16% в группе, получавшей 100 мг ламивудина, и 4% в группе, получавшей плацебо (рис. 9).
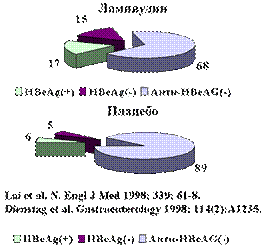
Рис 9. Соотношение частоты больных хроническим вирусным гепатитом В с сероконверсией HBeAg после лечения ламивудином (25 и 100 мг/сут в течение 1 года) и плацебо [2]
Среди причин, обусловливающих развитие иммунотолерантности у больных ХВГ В, основная роль отводится HBeAg [45]. Поэтому исчезновение HBeAg и сероконверсия от HBeAg к анти-HBeAg может быть расценена как восстановление иммунной системы, которое в дальнейшем может привести к выздоровлению от вирусного гепатита В.
Ациклические фосфонаты нуклеозидов адефовир (РМЕА) и тенофовир (РМРА) и их пролекарственные формы для перорального приема bis(POM)-PMEA (адефовир дипи-воксил) и bis(-POC)-PMPA (тенофовир дизопроксилфумарат) обладают многообещающей антивирусной активностью в отношении HIV и HBV.
В двух рандомизированных двойных слепых плацебо-контролируемых исследованиях адефовира дипивоксила у боль-ных с ВИЧ-инфекцией доказано, что при пероральном приеме препарата один раз в день в дозе 125, 250 и 500 мг в те-чение 2, 6 или 12 нед в сыворотке крови снижается уровень РНК HIV-1 и увеличивается количество CD4+-Т-лимфоци-тов [46, 47]. Bis(POM)-PMEA также был объектом I/II и II фаз клинических испытаний у HBV-инфицированных.
У пациентов, получавших адефовир в течение 4 нед по 120 мг один раз в сутки, достигнуто снижение уровня ДНК HBV в плазме на 2 log10 [48]. При увеличении продолжительности терапии адефовиром дипивоксилом до 12 нед (исследова-ние GS 96-412) у пациентов, получавших 60 или 30 мг препарата один раз в день, уровень ДНК HBV в сыворотке крови снизился на 99,99%; у 3 из 15 пациентов, получавших 60 мг препарата, и у 4 из 15 пациентов, получавших 30 мг препа-рата, исчезал HBeAg [49]. При контрольном визите через 24 нед у 27% пациентов (8 из 30) в обеих группах HBeAg не выявлялся, у 20% (6 из 30) произошла сероконверсия – появление антител к HBeAg.
У одного пациента из группы, получавшей по 30 мг препарата, также достигнута элиминация HBsAg. Ни у одного из пациентов, получавших плацебо, элиминации или сероконверсии HBeAg и HBsAg не отмечено (материал представлен Dr. J. Heathcote на 49-м ежегодном собрании Американской ассоциации по изучению болезней печени 8 ноября 1998 г. Hepatology, Oct. 1998, прил.).
Резистентность к анти-HBV препаратам
За последние несколько лет появилось множество сообщений о возможности развития резистентности к ламивудину (3ТС) у больных ХВГ В, длительное время получавших данный препарат. Механизм развития резистентности обуслов-лен специфическими точечными мутациями (М550V/I, или M552V/I, в зависимости от системы нумерации кодонов) в консервативном локусе YMDD ДНК-полимеразы HBV [50–53].
Резистентность к ламивудину развивается при замене метионина на валин в локусе YMDD ДНК-полимеразы DHBV [54].
Резистентность HIV к ламивудину (3ТС) опосредована такой же мутацией в локусе YMDD (в 184-й позиции обратной транскриптазы HIV). Замена метионина на валин или изолейцин в локусе YMDD уменьшает репликацию ДНК более чем в 100 раз по сравнению с таковой у вируса дикого типа, но дополнительные мутации вне локуса YMDD, например мута-ция Y(M(V>I)DD, увеличивают репликативную способность вируса. Таким образом, мутации Y(M>V/I)DD можно наз-вать " компенсаторными " [55].
Одной из таких "компенсаторных" мутаций, возникающих при длительном курсе лечения ламивудином, является мута-ция L526M (или L528M, в зависимости от системы нумерации кодонов). Данный тип мутации обнаруживается исключи-тельно у пациентов с локусом Y(M>V)DD [56]. У пациентов с мутацией L526M выявляется снижение содержания HBV на 10% по сравнению с контрольной группой. Комбинация мутаций L526M и M550V увеличивает содержание вируса в 5 раз по сравнению с одиночной мутацией М550V. Более того, у пациентов с комбинированной мутацией (L526V, M550V) отмечается дальнейший рост резистентности к ламивудину примерно в 300 раз [55].
Следует отметить, что мутация M550V (или M552V) ДНК-полимеразы HBV (см. выше) эквивалентна мутации M539V, снижающей продукцию вируса и чувствительность к ламивудину в 7 и 330 раз соответственно [57]. Разновидность поли-меразы, содержащей мутацию M539V, снижает чувствительность к (-)FTC, ddC и AZT [58].
Мутация L526M обнаружена также у пациента с развившейся резистентностью к пенцикловиру (фамцикловиру) [59]. В течение 4 лет этот больной рецидивирующим ХВГ В, возникшим после трансплантации печени, получал ганцикловир, фоскарнет и фамцикловир. Было выявлено снижение чувствительности вирионассоциированной ДНК-полимеразы к три-фосфату пенцикловира. Снижение чувствительности к пенцикловиру (фамцикловиру) обусловлено тремя мутациями (V519, P523 и L526) в гене HBV-полимеразы, находившемся в В участке ДНК-полимеразы (рис. 10) [59].
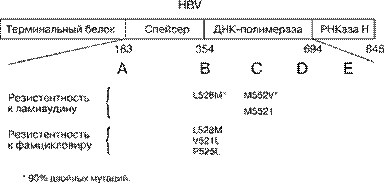
Рис 10. Локализация мутаций ДНК полимеразы HBV,ответственных за резистентность к анти-HBV препаратам. Данные мутации располагаются в пределах В и С домена ДНК полимеразы HBV и характеризуются как V519L, P523L, L526M и M550V/I. В зависимости от системы кодирования эти мутации могут также обозначаться как V521L, P525L, L528M и M552V/I соответственно.
У больных ХВГ В, получавших лечение РМЕА [bis(POM)-PMEA или адефовир дипивоксил], резистентность к препарату не развивалась. При длительном назначении адефовира дипивоксила больным ВИЧ-инфекцией по 120 мг/сут в течение 12 мес у 8 из 29 пациентов развились отсутствовавшие ранее мутации обратной транскриптазы.
Появление мутаций трудно отнести только к результатам лечения адефовиром дипивоксилом, так как больные принима-ли и другие антивирусные препараты [60]. У 2 из 8 пациентов развилась мутация К70Е, но ни у одного из них не отме-чена мутация K65R (развитие мутаций К70Е и K65E доказано in vitro при применении адефовира дипивоксила).
В результате мутаций отмечено соответственно 16- и 9-кратное снижение чувствительности к адефовиру. Несмотря на развитие мутаций обратной транскриптазы, у всех 8 больных устойчиво снижался уровень вирусной нагрузки (> 0,7 log10 копий/мл по сравнению с началом лечения) [60]. Эти данные свидетельствуют о том, что развитие резистентности к РМЕА не является проблемой даже у больных ВИЧ-инфекцией, получающих терапию РМЕА [или bis(POM)-PMEA].
Перспективы лечения вирусного гепатита В
Исключительно высокой антивирусной активностью в отношении HBV обладает препарат РМЕА и его пролекарствен-ная форма для перорального приема bis(POM)-PMEA. Ввиду предпочтительных фармакокинетических параметров, до-казанной антивирусной активности и низкой токсичности необходимо дальнейшее изучение применения bis(POC)-PMPA и bis(изопропилоксикарбонилметилового) эфира РМРА для лечения как больных вирусным гепатитом В, так и ВИЧ-инфекцией [61].
Уровень РМРАрр в покоящихся и активированных лимфоцитах периферической крови был в 1000 раз выше при лече-нии bis(POC)-PMPA, чем при лечении РМРА. Кроме того, bis(POC)-PMPA обеспечивал в 100 раз большую активность в отношении HIV установленных линий Т-лимфоцитов и лимфоцитов периферической крови.
Период полужизни РМРАрр, образовавшегося из bis(POC)-PMPA или РМРА, был равен 12–15 ч в активированных лим-фоцитах и 33–50 ч – в покоящихся лимфоцитах. Длительный период полужизни, уникальный для РМРАрр, позволяет снизить частоту приема данного препарата [62].
Продемонстрирована способность РМРА предотвращать развитие инфекции, обусловленной вирусом иммунодефицита обезьян (ВИО, или SIV) у макак, даже если лечение было начато через 24 ч после заражения. В этом отношении эффек-тивность РМРА значительно превосходит таковую у AZT [63, 64]. В дальнейшем исследовании было доказано преду-преждение инфицирования новорожденных макак при назначении РМРА по 30 мг/кг подкожно за 4 ч до перорального заражения ВИО и через 24 ч после него.
На основании приведенных данных можно предположить, что кратковременное назначение РМРА ВИЧ-инфицирован-ным роженицам в начале родовой деятельности, а затем новорожденным сразу после рождения позволит снизить часто-ту ВИЧ-инфицирования в родах. Принимая во внимание высокую активность РМРА в отношении HBV in vitro, необхо-димо дальнейшее изучение эффективности РМРА или bis(POC)-PMPA коротким курсом для профилактики интранаталь-ной передачи HBV.
Очевидно, что для эффективного подавления репликации HIV необходимо применять комбинации антивирусных пре-паратов, например аналоги нуклеозидов, такие, как AZT и 3ТС, с ингибиторми протеаз, например с индинавиром [66]. Комбинирование различных анти-HBV препаратов также может оказаться эффективнее, чем монотерапия.
Так, в эксперименте продемонстрировано синергидное действие in vitro комбинации РМЕА и пенцикловира, РМЕА и ламивудина в отношении HBV [67]. Флаваноид робустафлавон обладает синергизмом в комбинации с пенцикловиром и ламивудином [68]. L(-)Fd4C в комбинации с AZT, d4T, ddC и ddI действует не только как синергист, но и снижает мито-хондриальную токсичность d4T, ddC и ddI [69].
3ТС (ламивудин) и пенцикловир при комбинированном их применении действуют синергидно против DHBV в широком диапазоне клинически допустимых концентраций. Доказано также преимущество этой комбинации по сравнению с мо-нотерапией по дестабилизации связей ковалентно замкнутой циркулярной ДНК данного вируса [70]. На основании полученных данных высказано предположение, что 3ТС и пенцикловир будут также проявлять синергизм in vivo [70].
Можно утверждать, что будущее химиотерапии больных вирусным гепатитом В принадлежит использованию комбина-ций лекарственных средств, как это уже практикуется при лечении таких болезней, как туберкулез, онкозаболевания и СПИД. РМЕА и РМРА скорее всего будут играть важную роль в таких комбинациях.
В связи с этим необходимо заметить, что дифосфатная форма РМЕА (РМЕАрр) одинаково эффективна в отношении му-тантной М552/I- и ДНК-полимеразы HBV дикого типа [71]. Более того, доказана одинаковая активность РМЕАрр в отно-шении ДНК-полимеразы HBV с двойной мутацией (L528M/L552V) ДНК-полимеразы (Кi =0,079 мкМ) и в отношении ДНК-полимеразы HBV дикого типа (Кi =0,10 мкМ).
В то же время 5'-трифосфат 3ТС значительно слабее ингибирует ДНК-полимеразу HBV с данной двойной мутацией (Кi =6,3 мкМ) по сравнению с ДНК-полимеразой HBV дикого типа (Кi =0,2 мкМ). Это означает, что РМЕА может быть с успехом использован для лечения инфекций, резистентных к 3ТС, обусловленных штаммами HBV и HBV с двойной му-тацией L528M/М552V.
Эффективность РМЕА в отношении вариантов HBV, несущих мутации, ответственные за развитие резистентности к ла-мивудину и/или фамцикловиру (пенцикловиру), оправдывает применение РМЕА в качестве монотерапии инфекции HBV, вызванной мутантными штаммами HBV, а также комбинированное использование РМЕА в сочетании с ламивуди-ном или фамцикловиром до появления резистентности к двум последним препаратам.
Недавно предложена новая стратегия лечения ХВГ В,которая может использоваться в комбинации с препаратами, предс-тавленными в статье [72]. Данная стратегия базируется на нарушении метаболизма и транспорта гликопротеинов гепад-навирусов. В опыте доказано дозозависимое снижение концентрации ВГС у сурков, больных хроническим вирусным ге-патитом при лечении N -нонил-деоксиножиримицином (ингибитор a-глюкозидаз), нарушающим метаболизм и транспорт гликопротеинов [72].
В концентрациях, подавляющих образование WHV, N -нонил-деоксиножиримицин не влиял на гликозилирование боль-шинства гликопротеинов сыворотки крови, что указывает на вирусоспецифические свойства препаратов этого класса. Однако необходимы исследования переносимости и влияния этих препаратов при назначении их длительным курсом на элиминацию вируса из гепатоцитов.
Заключение
Первоначально некоторые препараты, являвшиеся случайными находками при поиске эффективных анти-HBV и анти-HIV агентов, такие, как фамцикловир (пенцикловир), BMS-200475, ламивудин (3ТС), (-)FTC, L(-)Fd4C, L-FMAU, DAPD (DXG), bis(POM)-PMEA и bis(POC)-PMPA, в настоящее время считаются многообещающими средствами терапии боль-ных вирусным гепатитом В. Все эти препараты в концентрациях, значительно меньше токсических, подавляют реплика-цию HBV в клетках Нер G2 2.2.15. Эти аналоги нуклеозидов, за исключением PMEA (адефовира) и РМРА (тенофовира), перед превращением в активную форму трифосфата, ингибирующего ДНК-полимеразу HBV, должны пройти три этапа фосфорилирования.
Для превращения в активные формы (РМЕАрр и РМРАрр соответсвенно), вызывающие терминацию цепи ДНК-полиме-разы, ДНК, РМЕА (адефовир) и РМРА (тенофовир) проходят только два этапа фосфорилирования. Эффективность неко-торых препаратов, например фамцикловира, ламивудина и адефовира, подтверждена на животных моделях при исследо-вании вирусных гепатитов пекинских уток и сурков.
Доказано также влияние лечения фамцикловиром, ламивудином и адефовиром на снижение уровня ДНК HBV у больных ХВГ В. Однако при длительных курсах лечения фамцикловиром и ламивудином в ДНК-полимеразе HBV развивались мутации, приводящие к развитию резистентности (L528M и M552/I). Данные пенцикловиро- и ламивудинорезистентные штаммы HBV оставались чувствительными к адефовиру.
При лечении адефовиром развития резистентных штаммов HBV не отмечено. Очевидно, что будущее терапии нфекции, вызванной HBV, как и в случае с ВИЧ-инфекцией, принадлежит использованию комбинированного лекарственного ле-чения. Это позволит не только добиться элиминации вируса, но и уменьшить вероятность развития резистентных штам-мов HBV.
Дата добавления: 2015-01-18 | Просмотры: 782 | Нарушение авторских прав
1 | 2 | 3 | 4 |
|








