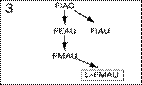|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология
|
Введение. В настоящее время в мире инфицированы вирусом гепатита В (HBV) 350 млн человек
В настоящее время в мире инфицированы вирусом гепатита В (HBV) 350 млн человек. Все носители HBV подвержены высокому риску развития цирроза печени и первичной гепатоцеллюлярной карциномы (ГЦК).Наибольшая частота но-сительства HBV отмечается в странах Юго-Восточной Азии и Африки, 20% населения этих регионов хронически инфи-цированы HBV. Несмотря на существование вакцины, HBV в настоящее время остается важнейшим инфекционным агентом, вызывающим заболевания у человека, особенно в развивающихся странах.
a-Интерферон является единственным препаратом, одобренным во всем мире для лечения хронического вирусного гепатита (ХВГ) В [1]. Однако терапия a-интерфероном нередко приводит к развитию нежелательных лекарственных реакций, а результаты лечения, как правило, оказываются неудовлетворительными. Среди причин неэффективности лечения интерферонами называют:
1) иммунологическую толерантность к HBV в случае перинатального инфицирования и заражения в раннем детстве [2];
2) персистирование ковалентно замкнутой циркулярной ДНК вируса (сссДНК) в печени [3].
Генетический аппарат HBV представлен двухцепочечной кольцевидной молекулой ДНК, состоящей из 3200 пар нуклео-тидов. В геноме находятся 3 перекрывающиеся рамки считывания, кодирующие вирусную ДНК-полимеразу, сердцевин-ный антиген (НВсАg), поверхностный антиген (HВsAg) и активирующий экспрессию всех генов вируса белок Х.
После заражения при помощи ДНК-полимеразы одноцепочечные участки короткой цепи ДНК HBV достраиваются с образованием РНК-репликативного прегенома. Образовавшийся пренуклеотид включает в себя прегеномную РНК- и ДНК-полимеразу.
Следующий этап репликации, происходящий в цитоплазме инфицированного гепатоцита, – обратная транскрипция, то есть синтез полной антисмысловой цепи ДНК на РНК матрице при помощи вирусоспецифичной ДНК-полимеразы, обладающей свойствами обратной транскриптазы (ревертазы) с последующим разрушением прегеномной РНК. Затем на антисмысловой цепи синтезируется смысловая цепь ДНК HBV [4].
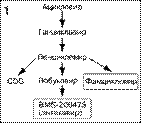
Образовавшаяся кольцевидная структура ДНК HBV вместе с ДНК-полимеразой включается в нуклеокапсид вируса и формируется наружная оболочка вируса, состоящая из HBsAg и НВеAg. На этом процесс репликации генома HBV за-канчивается и новая вирусная частица выходит из гепатоцита (рис. 1). Наряду со вновь образованными полноценными вирусными частицами из инфицированной клетки высвобождаются также "пустые" вирусные частицы, содержащие HBsAg и HBeAg.
Серологическими маркерами ХВГ В являются HBsAg, анти-HBcAg, ДНК HBV, HBeAg, а также повышение активности АлАТ (рис. 2). Определение ДНК HBV в крови особенно важно для оценки качества антивирусной терапии. Если в кро-ви сохраняется ДНК HBV, в качестве показателей эффективности антивирусной терапии может служить нормализация активности АлАТ, иногда HBeAg-сероконверсия – исчезновение HBeAg и появление антител к HBeAg.
Рис 1. Жизненный цикл вируса гепатита В и механизм действия ингибиторов обратной транскриптазы
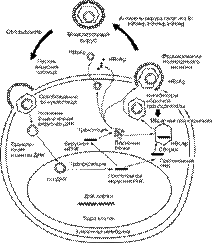
Рис 2. Хроническая HBV-инфекция: серологические маркеры

Основное направление создания новых препаратов для терапии вирусного гепатита В – поиск средств, подавляющих функцию специфической ДНК-полимеразы HBV, так как этому ферменту отводится решающая роль в синтезе вирусной частицы. Кроме того, ингибиторы вирусных ДНК-полимераз уже успешно используются для лечения инфекций, вызванных вирусами простого герпеса (HSV), опоясывающего лишая (VZV), цитомегаловирусом (CMV) и ретровируса-ми (вирус иммунодефицита человека – ВИЧ, или HIV).
В настоящее время проводится оценка возможного использования для лечения вирусного гепатита В аналогов нуклеози-дов (и нуклеотидов), эффективность которых уже доказана: либо против HSV, VZV, CMV, либо против HIV. Причем не-которые из этих препаратов в отношении HBV оказались даже эффективнее, чем в отношении HSV или HIV.
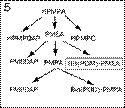
В зависимости от препарата-предшественника можно выделить 5 групп аналогов нуклеозидов:
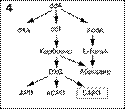
1) ацикловир – для ациклических (или карбоциклических) аналогов гуанозина;
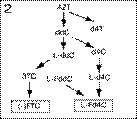
2) азидотимидин (AZT) – для аналогов дидеоксинуклеозида пиримидина;
3) 1-(2'-дезокси-2'-фтор-b-D-арабинофуранозил)-5-иодцитозин (FIAC) – для аналогов 2'-фторзамещенных арабинозилпи-римидинов;
4) дидезоксиаденозин (ddA) – для аналогов пуриновых дидезоксинуклеозидов;
5) (S)-9-(3-гидрокси-2-фосфонил-метоксипропил)аденин (HPMPA) для ациклических нуклеозидных фосфонатов (рис. 3).
Рис 3. Генеалогия основных аналогов нуклеозидов (или нуклеотидов), которые могут играть роль (или быть предшествен-никами) анти-HBV препаратов. Ациклические (или карбоциклические) аналоги гуанозина. Аналоги дидеоксинуклеозида пиримидина. 2'-фторзамещенные арабинозилпиримидина. Аналоги дидеоксинуклеозида пурина. Ациклические фосфонаты нуклеозидов. В рамки помещены наиболее интенсивно исследуемые и перспективные субстанции.
На рис. 4 изображены структурные формулы основных представителей (и/или наиболее часто используемых) анти-HBV препаратов для каждой из 5 категорий:
1-й класс – пенцикловир и его пролекарственные формы фамцикловир, лобукавир и BMS-200475 (энтекавир);
2-й класс – 3ТС (ламивудин), (-)FTC и L(-)Fd4C;
3-й класс – L-FMAU;
4-й класс – DXG (и его пролекарственные формы DAPD, APD и ACPD);
5-й класс – PMEA (адефовир) и PMPA (тенофовир), а также их пролекарственные формы bis(POM)-PMEA (адефовир дипи-воксил) и bis(POC)-PMPA (тенофовир дисопроксил фумарат).
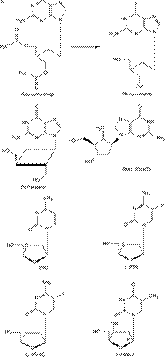
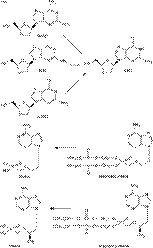
Рис 4. Структурная формула наиболее репрезентативных анти-HBV препаратов (и их пролекарств): пеницикловир (фамцикловир), лобукавир, BMS-200475 (энтекавир), 3ТС, (-)FTC, L-FMAU, DXG (APD, ACPD, DAPD), PMEA [bis(POM)-PMEA] и [bis(POC)-PMPA]
Сравнительная активность in vitro некоторых анти-HBV препаратов
Клеточная линия НВ 611 гепатобластомы человека, особенно Hep G2 2.2.15, несущих геном HBV, наиболее часто ис-пользуется для определения ингибирующих эффектов антивирусных препаратов на репликацию HBV. Подавление син-теза промежуточных продуктов внутриклеточной ДНК HBV и/или продукции внеклеточной ДНК вируса можно исполь-зовать в качестве маркеров антивирусной активности [5, 6].
При оценке клинической эффективности аналогов нуклеозидов, проводившейся в различных лабораториях, условия в которых могли различаться [6–18], хорошие результаты получены для следующих препаратов, селективно ингибирую-щих репликацию HBV (см. таблицу): пенцикловир [6], BMS-200475 [7], 3TC [6, 10, 11], (-)FTC [10], L-FddC, L-d4C и L-FdC [9], L-FMAU [13], DXG и его предшественник ACPD [16], а также для ациклических фосфонатов нуклеозидов HPMPA, PMEA, PMEDAP, PMPA и PMPDAP [5, 17, 18].
При сравнении действия BMS-200475, пенцикловира и ламивудина (3TC) в одинаковых условиях [7] оказалось, что BMS-200475 значительно эффективнее, чем 3ТС (ЕС50 составляет 0,00375 и 0,116 мкМ соответственно), а пенцикловир неактивен в отношении HBV (ЕС50 равна 100 мкМ).
В то время как 2',3'-дидезоксиаденозин (ddA) и 2',3'-дидегидро-2',3'-дидезоксиаденозин (d4A) оказались мало- или неак-тивны в отношении HBV, их арилоксифосфорамидатпроизводные Cf1093 и Cf1001 подавляли репликацию HBV в клет-ках Hep G2 2.2.15 при ЕС50 0,1–0,01 мкМ [14], равной ЕС50 для 3ТС. Арилоксифосфорамидатпроизводный 3ТС (Cf1109) подавлял репликацию HBV при такой же ЕС50, что и у 3ТС [11].
Из всех аналогов L-нуклеозидов L-FMAU является первым аналогом L-тимидина, который специфически подавляет ре-пликацию ДНК HBV [13]. Все остальные аналоги L-нуклеозидов, активные в отношении HBV, то есть L-FddC, L-d4C, L-Fd4C, 3TC и (-)FTC, представляют собой аналоги L-цитидина.
Из нециклических фосфонатов нуклеозидов наибольшие надежды в отношении активности против HBV возлагают на PMEA, PMPA и их 2,6-диаминопуриновые аналоги PMEDAP и PMPDAP. Подавление репликации вируса гепатита B пекинских уток (DHBV – duck hepatitis B virus) препаратами доказана in vitro [18, 20].
Дата добавления: 2015-01-18 | Просмотры: 774 | Нарушение авторских прав
1 | 2 | 3 | 4 |
|