|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Основы систематики ЛТ.Система лучевой терапии онкозаболеваний. Современная лучевая терапия злокачественных опухолей является высокоэффективным научно обоснованным методом противоопухолевого воздействия, интегрирующим достижения экспериментальной и клинической онкологии, радиобиологии, физики и реализующим возможности радиотерапевтической аппаратуры последнего поколения.
Основы систематики ЛТ.
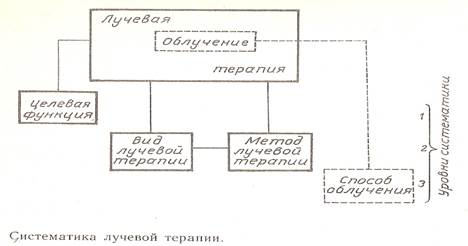
Главной структурной и терминологической особенностью систематики лучевой терапии является разграничение понятий и терминов «лучевая терапия» и «облучение больного». Это вовсе не синонимы (как считают многие у нас и за рубежом). На основе этих общих представлений в этой системе раздельно рассматриваются: а) виды и методы лучевой терапии, б) способы и методики облучения больного. Она имеет три уровня систематики (см. табл.1). Таблица 1
На первом уровне систематики определяется стратегическая задача, т. е. целевая функция или ожидаемые результаты лучевого лечения (табл. 2).
Выбор целевой функции определяется прежде всего стадией развития злокачественного процесса, наличием сопутствующих заболеваний, общим клиническим состоянием больного. Второй уровень систематики — виды и методы лучевой терапии — состоит из двух подуровней, различающихся по принципу построения и основному признаку. Подуровень 2 .1 связан с видом используемого ионизирующего излучения, подуровень 2.2 — с решением клиническими и радиобиологическими средствами тактической задачи формирования терапевтического эффекта в мишени и сдерживания лучевых реакций и осложнений в окружающих мишень органах и тканях. Третий уровень систематики — способы и методики облучения больного — также состоит из двух подуровней: к первому (3.1) относятся технические приемы благоприятного распределения (на этапе планирования облучения) поглощенной энергии в мишени, окружающих ее тканях и органах, во всей облучаемой части тела; ко второй (3.2) —технологические приемы и средства подготовки и выполнения с минимальными погрешностями индивидуально выбранного для больного плана сеанса (или процедуры) облучения. В отличие от методов лучевой терапии способы облучения больного связаны не со всем курсом облучения, а с проведением его отдельных сеансов и процедур.
Виды ЛТ. В зависимости от применяемого излучения ЛТ разделяют на множество видов, объединенных в группы (см. табл.3А).
Указанные виды могут применяться различными способами: поверхностное, внутриполостное, внутритканевое; статическое и подвижное; одно- и многопольное облучение; открытым и закрытым источником и т.д.. Среди контактных методов облучения важное место занимает коротко-дистанционная рентгенотерапия, которая высокоэффективна при некоторых неопухолевых заболеваниях кожи, доброкачественных опухолях (гемангиомы) и злокачественных новообразованиях. Этот метод отличается простотой, удобством, экономичен и почти полностью исключает осложнения. При радиорезистентных опухолях новые возможности открывает применение корпускулярного нейтронного излучения (источники 252Cf). Идет постоянный поиск оптимальных м применения этого нового метода внутритканевой лучевой терапии в сочетании с наружным облучением, гипертермией и лекарственным (радиосенсибилизаторы) противоопухолевым лечением. В настоящее время, да и в перспективе, дистанционная гамма-терапия с применением излучения 60Со остается основной в практической радиологии. Это обусловлено надежностью технических средств, низкими эксплуатационными расходами наряду с особенностями распределения дозы излучения. Дистанционная гамма-терапия применяется как самостоятельно, так и в сочетании с хирургическим лечением (например рак гортани, легкого, пищевода, молочной железы, шейки и тела матки, предстательной железы, прямой кишки и др.) либо в комплексе с химиотерапией (опухолевые заболевания кроветворной и лимфоидной ткани, рак легкого, молочной железы, предстательной железы, яичников и др.). Поглощение максимума энергии электронов на малой глубине оправдывает применение электронного излучения при злокачественных опухолях языка, дна полости рта, слизистой щеки, гортани, влагалища, прямой кишки, иногда при поражении периферических лимфатических узлов, раке кожи и подкожных метастазах. Как показала многолетняя клиническая практика, используемые в настоящее время в онкологии предельные суммарные дозы тормозного рентгеновского, электронного или гамма-излучений не всегда гарантируют полную клиническую регрессию опухоли. В этом отношении в ряде случаев определенную перспективу имеет облучение протонами, заданная энергия которых от 70 до 1000 МэВ (в медицинском диапазоне) создается в ускорителе элементарных частиц.
Методы ЛТ.
Облучение организма больного, в зависимости от расположения поврежденного органа или ткани, специфики протекания и вида заболевания, проводят по соответствующей методике. I. Тотальная ЛТ – облучение всего тела. ІI. Единовременная ЛТ – на сегодняшний день применяется довольно редко, так как требует единоразового облучения терапевтически эффективной дозой. ІІI. Фракционированная ЛТ. В последние годы в практике лучевой терапии применяется большое число методик различных режимов фракционирования дозы. В настоящее время в большинстве случаев лучевую терапию осуществляют по методике традиционного мелкофракционного облучения — ежедневно по 2 Гр 5 раз в неделю до суммарной очаговой дозы (СОД) 60—70 Гр. В отдельных случаях используется методика крупнофракционного облучения — по 5 Гр ежедневно или 2—3 раза в неделю до СОД 35— 45 Гр в зависимости от преследуемой цели. В одних случаях эта методика может применяться с паллиативной или даже симптоматической целью при распространенных раковых процессах для снятия болей или других отягощающих симптомов. В других она оправдана в предоперационном периоде, например при раке молочной железы, костных саркомах и некоторых других опухолях. В дальнейшем стала применяться и методика суперфракционирования (некоторые авторы называют ее гиперфракционированием или мультифрак-ционированием — единой классификации пока нет). При этом разовая доза составляет 1,25 Гр, облучение проводят 2 раза в день с интервалом от 2 до 6 ч 5 раз в неделю до СОД 60—70 Гр. Кроме того, существует вариант ускоренного фракционирования, при котором сокращается общая продолжительность облучения за счет ежедневного подведения 2—3 фракций по 1,6— 2,3 Гр до СОД также 60—70 Гр. Считается, что интервалы между фракциями в 3—6 ч достаточны для восстановления сублетальных повреждений здоровых клеток, тогда как опухолевые клетки за это время не успевают оправиться от радиационных повреждений. ІV. ЛТ с использованием радиосенсибилизаторов. В качестве модификаторов радиочувствительности опухолей и нормальных тканей применяют гипербарическую оксигенацию (ГБО), метронидазол (МЗ), сочетание ГБО и МЗ, противоопухолевые лекарственные препараты, гипертермию, кратковременную индуцированную гипергликемию, турникетную и общую газовую гипоксию, другие сенсибилизаторы и протекторы. Установлено, что радиочувствительность аноксичных злокачественных клеток в 3 раза меньше, чем полностью оксигенированных. Электронакцепторные соединения принимают электрон со свободных гзпикалов молекул-мишеней, возбужденных облучением, и, окисляя их, перезолят в такое состояние, когда они не способны к восстановлению. Клинические наблюдения за различными по генезу опухолями и при разных способах облучения показали, что применение метронидазола внутрь при мелкофракционном облучении заметно не отражается на эффективности лечения, однако выраженная токсичность при этом наблюдается у 15—20 % больных. Основной причиной неудач является недостаточная концентрация радиосенсибилизатора в опухоли. Более перспективным считается введение метронидазола непосредственно в опухоль в сочетании с неоднократным ежедневным облучением. Новым направлением в клинической онкологии является применение локальной или тотальной гипертермии, которая повышает чувствительность гипоксических клеток к действию радиации и лекарственных агентов, а также клеток, находящихся в радиорезистентной фазе клеточного цикла. V. ЛТ с использованием радиопротекторов. Почти 20-летний опыт гипоксирадио-терапии злокачественных новообразований, т. е. облучения опухолей в условиях кислородного голодания всего организма, вызываемого пониженным содержанием кислорода в крови при запланированном уменьшении его во вдыхаемом воздухе во время облучения (больной дышит из баллона газовой смесью, содержащей 8—10 % кислорода), показал, что данная методика дает возможность преодолеть резистентность гипоксических клеток опухоли. Последнее обеспечивается возможностью увеличения дозы излучения от 20 до 40 % при уменьшении лучевых реакций окружающих нормальных тканей без заметного ослабления противоопухолевого действия радиации. Также в качестве радиопротекторного средства используют пониженную температуру – гипотермия. VI. Совместное применение ЛТ и цитокининов. Активно исследуются вопросы комбинированного действия ЛТ и интерферонов. Их действие напрямую связано с ингибированием опухолевого роста, стимуляцией противоопухолевого ответа и индукцией клеточной смерти. Кроме того интерфероны активны как агенты против канцерогенных вирусов.
Дата добавления: 2015-11-25 | Просмотры: 534 | Нарушение авторских прав 12 |