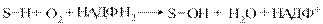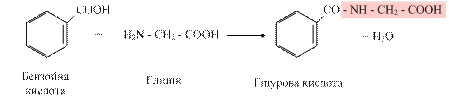|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
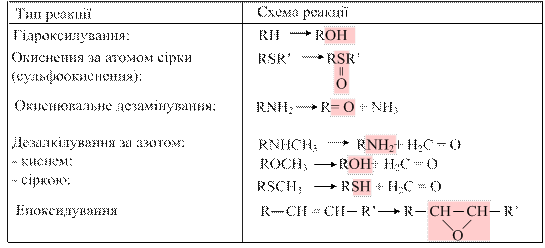
Знешкодження токсичних речовин у печінціВелике значення для збереження життєдіяльності організму має детоксикаційна функція печінки, завдяки якій відбувається знешкодження низки отруйних для організму речовин, які або утворюються в процесі метаболізму (білірубін, аміак, продукти гниття амінокислот тощо), або потрапляють в організм ззовні (чужорідні сполуки, у тому числі, лікарські препарати). Механізм процесу детоксикації полягає в перетворенні токсичної хімічної сполуки на таку молекулярну форму, яка є менш токсичною, або втрачає токсичні властивості зовсім. Так, знешкодження білірубіну відбувається в печінці шляхом кон’югації з глюкуроновою кислотою з утворенням диглюкуроніду білірубіну, який виводиться в складі жовчі; аміак використовується в орнітиновому циклі і включається в молекулу сечовини, котра виділяється в складі сечі; скатол, який утворюються при розпаді триптофану в товстій кишці, деметилується з утворенням індолу, який шляхом гідроксилування та кон’югації перетворюється на тваринний індикан, виводиться в складі сечі та може слугувати показником інтенсивності процесів гниття білків у травному тракті та функціонального стану печінки. Чужорідні речовини, які можуть потрапляти в організм різними шляхами (через шкіру, дихальні шляхи, травний тракт, кров) теж надходять у печінку, де підлягають модифікації. У залежності від хімічної природи гормонів їх інактивація у печінці забезпечується різними шляхами. У печінці відбувається гідроліз пептидних гормонів протеазами. Катехоламіни (адреналін, норадреналін) підлягають у гепатоцитах окисному дезамінуванню за участю моноаміноксидази (МАО), потім метилюванню за гідроксильними групами та кон’югації з сульфатою або глюкуроновою кислотами. Продукти катаболізму виводяться з сечею. Стероїдні гормони гідроксилюються за участю гідроксилаз та кон’югують з глюкуроновою чи сульфатною кислотою і також виводяться з сечею. Тироксин у гепатоцитах підлягає реакції трансамінування, перетворюючись у кетопохідне, яке кон’югує з тими ж кислотами і виводиться з організму. Продукти гниття амінокислот всмоктуються з товстої кишки у кровоплин і затримуються у печінці. У гепатоцитах крезол та фенол утворюють кон’югати з глюкуроновою або сульфатною кислотою. Скатол перетворюється на індол, останній підлягає гідроксилюванню з утворенням індоксилу. Цей метаболіт кон’югує з тими ж кислотами. Виведення з сечею калієвої солі індоксилсульфату (тваринного індикану) пропорційне інтенсивності процесів гниття у кишечнику та швидкості реакцій знешкодження у печінці. Вміст індикану в сечі може використовуватися як показник функціонального стану печінки. Речовини, які потрапляють в організм із навколишнього середовища (з продуктами харчування, вдихуваним повітрям, через шкіру) і не використовуються ним для побудови тканин організму або як джерела енергії називають чужорідними речовинами, або ксенобіотиками. Вони є об’єктом детального вивчення ксенобіохімії – напрямку досліджень, що вивчає закономірності перетворення ксенобіотиків, до яких належать тяжкі метали, нафтопродукти, фреони, пластмаси, пестициди, миючі засоби, парфумерні вироби, лікарські препарати, харчові добавки тощо. Гідрофільні ксенобіотики виводяться з організму в незміненому вигляді в складі сечі, тоді як гідрофобні, зв’язуючись з білками або утворюючи комплекси з ліпідами клітинних мембран затримуються в тканинах і спричинюють виникнення алергійних реакцій, зниження імунітету, порушення обміну речовин, розвиток специфічних захворювань (у тому числі, професійних хвороб, новоутворів). Біотрансформація ксенобіотиків – це перетворення токсичних речовин екзогенного чи ендогенного походження на полярні водорозчинні метаболіти, які легко виводяться з організму. У метаболізмі ксенобіотиків беруть участь понад 30 ферментів. Цей складний процес складається з двох фаз: мікросомального окиснення та реакцій кон’югації, послідовне функціонування яких забезпечує знешкодження десятків тисяч чужорідних речовин усіх хімічних класів. Метаболізм ксенобіотиків відбувається у найвіддаленіших від ядра та мітохондрій ділянках клітини – ендоплазматичному ретикулумі та гіалоплазмі, а їх виведення з клітини забезпечується р-глікопротеїном, який являє собою транспортну АТФазу. Більш гідрофільні ксенобіотики далі поступають у плазму, а звідти виводяться через нирки у складі сечі; більш гідрофобні, а також ті, що мають велику молекулярну масу, потрапляють у кишку в складі жовчі та виділяються з каловими масами. Реакції знешкодження токсичних речовин та інактивація біологічно активних речовин відбуваються, головним чином, у печінці. Процес знешкодження токсичних речовин поділяють на дві фази. 13.2.1. Реакції мікросомального окиснення. Перша фаза біотрансформації ксенобіотиків відбувається в мембранах ендоплазматичного ретикулуму гепатоцитів за допомогою мікросомальних ферментів (мікросоми – це уламки мембран ендоплазматичного ретикулуму), які каталізують реакції окиснення, відновлення, окиснювального дезамінування, сульфоокиснення, епоксидування, С-гідроксилування, О-, N-, S-дезалкілування тощо з утворенням або вивільненням груп -OH, -COOH, -SН, -NH2 (табл. 13.2). Найпоширенішим є окиснювальне гідроксилування.
Таблиця 13.2. Типи реакцій мікоросомального окиснення
Наприклад, гідроксилування карбоциклічних і гетероциклічних сполук відбувається за схемою:
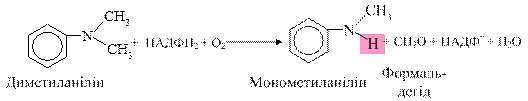
окиснення диметиланіліну:
N-окиснення з утворенням N-оксидів і N-гідроксил амінів:
Сульфоокиснення:
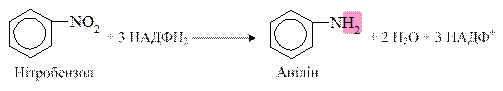
Відновлення нітросполук:
Ферменти, які локалізуються в мембранах ендоплазматичного ретикулуму та формують мікросомальну систему називаються мікросомальними оксидазами. Ті з них, які каталізують відновлення одного атома молекули О2 з утворенням води і включенням другого атома кисню в окиснювальну сполуку, отримали назву мікросомальних монооксигеназ:
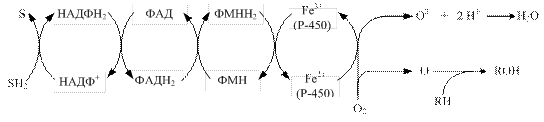
На відміну від мітохондріального окиснення, в якому важливу роль відіграють реакції дегідрування (молекулярний кисень є кінцевим акцептором електронів і протонів лише для утворення води, а виділена енергія акумулюється у вигляді АТФ), у реакціях мікросомального окиснення активний кисень використовується як пластична речовина. Молекули АТФ в цьому процесі не утворюються, енергія використовується для окиснення субстратів, тому роль мікросомального окиснення полягає в гідроксилуванні субстрату, а не в окиснювальному фосфорилуванні. 13.2.2. Електронно-транспортні ланцюги ендоплазматичного ретикулуму. У процесі мікросомального окиснення беруть участь два електронно-транспортні ланцюги: перший складається з двох ферментів – НАДФН-Р450-редуктази та цитохрому Р-450, а другий містить фермент НАДН-цитохром-b5-редуктазу, цитохром b5 і стеароїл-КоА-десатуразу. Донором електронів для першого ланцюга слугує НАДФН2, який окиснюється НАДФН-Р450-редуктазою. Цей фермент у якості простетичної групи містить 2 коферменти – ФАД і ФМН, які, своєю чергою, окиснюються цитохромом Р-450 (рис. 13.3).
Рис. 13.3. Схема електронно-транспортного ланцюга ендоплазматичного ретикулуму, донором електронів у якому слугує НАДФН2
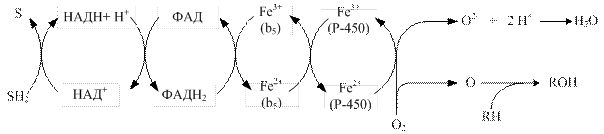
Донором електронів для другого ланцюга слугує НАДН2. Коферментом НАДН-цитохром-b5-редуктази є ФАД, який передає електрони на цитохром b5, що містить у своєму складі залізо. Від нього електрони можуть передаватися на цитохром Р-450 або на стеароїл-КоА-десатуразу, яка, переносячи електрони на кисень з утворенням води, каталізує утворення подвійних зв’язків у жирних кислотах (рис. 13.4).
Рис. 13.4. Схема електронно-транспортного ланцюга ендоплазматичного ретикулуму, донором електронів у якому слугує НАДН2
НАДН-цитохром b5-редуктаза та цитохром b5 не фіксуються на строго визначених ділянках мембрани ендоплазматичного ретикулуму і можуть змінювати свою локалізацію. 13.2.3. Індуктори та інгібітори мікросомальних монооксигеназ. Регуляція активності мікросомальної системи в цілому здійснюється на рівні транскрипції. Шляхом індукції можна збільшити кількість ферментів у відповідь на надходження чи утворення в організмі речовин, виведення яких не може відбуватися без участі мікросомального окиснення. Численні індуктори мікросомальних монооксигеназ можна поділити на два класи: до першого належать лікарські препарати (у тому числі, фенобарбітал та інші барбітурати), гормони (кортизол, тироніни, статеві гормони) та інсектициди, а до другого – в основному, поліциклічні вуглеводні бензпірен, метилхолантрен, найпотужнішим серед яких є 2,3,7,8-тетрахлордибензо-р-діоксин (ТХДД). Його ефективна доза становить 1 мкг/кг маси, тоді як інші індуктори діють у значно вищих концентраціях (понад 10 мг/кг). Фенобарбітал спричинює виражену проліферацію гладкого ендоплазматичного ретикулуму в гепатоцитах і зростання активності цитохрому Р-450, у результаті чого підвищується активність таких процесів як деметилування, гідроксилування та епоксидування ксенобіотиків. Індукція, викликана поліциклічними вуглеводнями, не супроводжується проліферацією гладкого ендоплазматичного ретикулуму, але при цьому суттєво зростає активність цитохрому Р-450, трансфераз і гідроксилаз. Інгібітори синтезу білка (пуроміцин, метіонін, циклогексимід) та інгібітори синтезу РНК (актиноміцин Д) блокують індукцію мікросомальних ферментів. Інгібувати дію ферментів мікросомального окиснення за конкурентним механізмом, виступаючи в ролі «альтернативних субстратів», можуть етиловий спирт і нікотинамід, а також реакційноздатні проміжні метаболіти, які одночасно пригнічують активність ферментів кількох типів у місці їх утворення (чотирихлористий вуглець, дихлоретан), недоокиснені продукти обміну, кініни, катехоламіни, альдегіди, кетони, біогенні аміни, низькомолекулярні пептиди, сечовина, сечова кислота, креатинін, левоміцетин і бутадіон, антихолінестеразні засоби. Мікроелемент кобальт пригнічує дію цитохром Р-450-залежних оксидаз шляхом інгібування синтезу гему, який слугує їх простетичною групою. Поєднання з терапевтичною метою кількох лікарських препаратів, які метаболізуються одним мікросомальним ферментом, може призвести до модифікації, посилення або зниження фармакологічного ефекту одного з них або обох одночасно. 13.2.4. Генетичний поліморфізм та індуцибельність синтезу цитохрому Р-450. цитохром P-450 – головний компонент мікросомальної системи – належить до гемопротеїнів (молекулярна маса коливається в межах 44 000 – 60 000 Да), у якості простетичної групи містить гем і має ділянки зв’язування для кисню та субстрату (ксенобіотики, стероїди, жирні кислоти тощо). Описана велика кількість генів цитохрому P-450, які кодують різні ізоформи цього фермента. Ізоформи поділяють на сімейства (1, 2, 3 тощо) та підсімейства A, B, C, D, E, у межах яких ізоформи позначають порядковими номерами. У залежності від виконуваних функцій усі ізоформи поділяються на три основних класи: до першого належать цитохроми, що беруть участь у метаболізмі лікарських препаратів і ксенобіотиків (Р-450 1А1, Р-450 1А2, Р-450 1В1 тощо), до другого – ті, ще беруть участь у синтезі стероїдів (Р-450 19А1, Р-450 21А2 тощо), до третього – ті, що беруть участь в інших важливих ендогенних процесах організму (Р-450 27А1, Р-450 1В1 тощо). Незалежно від структури та хромосомної локалізації цитохроми Р-450 поділяють на конститутивні та індуцибельні. Конститутивні ізоформи постійно продукуються клітинами, тоді як експресія індуцибельних може контролюватися різними хімічними сполуками. Індукція цитохрому Р-450 нерідко стає наслідком різних звичок (прийом алкоголю, паління), професійного та екологічного контакту з речовинами (органічні розчинники, діоксини, інсектициди тощо), тривалого прийому лікарських препаратів (барбітурати, антибіотики тощо). Так, деякі цитохроми Р-450 є високо індуцибельними, наприклад, експресія Р-450 1А1 зростає в печінці у понад 100 разів під впливом поліциклічних ароматичних вуглеводнів, Р-450 2Е1 – під впливом етанолу, ацетону, ізоніазиду, імідазолу, Р-450 3А – під впливом синтетичних стероїдів і фенобарбіталу. Слід також зазначити, що в організмі людини абсолютна більшість канцерогенів утворюється з проканцерогенів за участі, основним чином, цитохрому Р-450 1 сімейства, а розвиток псоріазу пов’язують із поліморфізмом цитохрому Р-450 2С19. Система цитохрому р-450 перетворює хлороформ (засіб для загального наркозу) на бойову отруйну речовину фосген, знеболювальний і жарознижуючий препарат парацетамол – на метаболіт N-ацетилімідохінон, який у великих дозах ушкоджує клітини печінки та нирок, тому вказаний препарат з обережністю призначають людям з патологією цих органів. 13.2.5. Реакції кон’югації в гепатоцитах. Друга фаза детоксикації включає в себе реакції кон’югації з різними сполуками, які каталізуються відповідними трансферазами (табл. 13.3). При цьому токсичні сполуки стають полярнішими, менш ліпідорозчинними, втрачають свої властивості та швидше виводяться з організму.
Таблиця 13.3. Основні ензими та метаболіти, які беруть участь у реакціях кон’югації
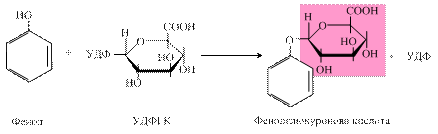
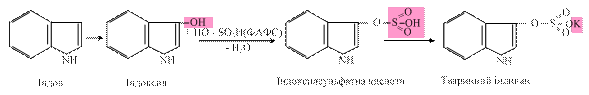
Реакції глюкуронування – основний тип кон’югації в організмі людини та тварин як ксенобіотиків, так і ендогенних субстратів, у яких бере участь активна форма глюкуронату – УДФ-глюкуронова кислота (УДФГК). Вона утворюється шляхом окиснення УДФ-глюкози (УДФГ) НАД-залежною УДФГ-дегідрогеназою: УДФГ + 2 НАД+ ® УДФГК + 2 НАДН2 R-OH + УДФГК ® R-O-глюкуронід + УДФ Фермент, що каталізує реакції глюкуронування – УДФ-глюкуронілтрансфераза, локалізується в мембранах ендоплазматичного ретикулуму гепатоцитів і деяких інших органів (нирок, травного тракту, шкіри), що також беруть участь в реакціях детоксикації. У результаті утворюються глюкуроніди білірубіну, стероїдних гормонів, продуктів гниття білків (фенолу, крезолу), вітаміну Д тощо. Залежно від хімічної природи субстрату, розрізняють реакції O-, N- та S-глюкуронування. наприклад, під впливом ферментів бактерій у товстій кишці з тирозину шляхом руйнування бічних ланцюгів можуть утворюватися токсичні сполуки фенол і крезол, які з током крові надходять у печінку, де знешкоджуються, вступаючи в реакцію кон’югації з глюкуроновою кислотою:
Утворені продукти реакції добре розчиняються у воді і виводяться в складі сечі. У реакціях сульфування донором сульфатних радикалів є біологічно активна форма сульфатної кислоти – 3’-фосфоаденозин-5’-фосфосульфат (ФАФС). так, вільний індол, який утворюється в товстій кишці в результаті дії ферментів мікроорганізмів на L-триптофан, далі шляхом мікросомального окиснення (І фаза біотрансформації) у печінці перетворюється на індоксил і вступає в реакцію кон’югації з ФАФС (ІІ фаза біотрансформації). Утворений у ході реакції індоксилсульфат, виводиться в складі сечі у вигляді калієвої солі, яка отримала назву “тваринного індикану”:
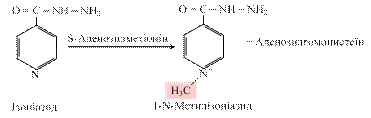
Індиканурію спостерігають при інтенсивному гнитті білкових речовин у кишці (коліт, закрепи, непрохідність кишок, рак, абсцес, перитоніт). Реакції метилування та ацетилування – поширений тип кон’югації, у цих реакціях беруть участь S-аденозилметіонін та ацетил-KoA: R-OH + S- аденозилметіонін ® R-O-СН3 + S-Аденозилгомоцистеїн Шляхом метилування відбувається біотрансформація ізоніазиду (похідного ізонікотинової кислоти), який широко застосовують для лікування туберкульозу:
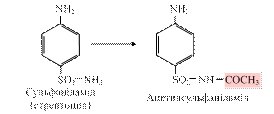
Ацетилування – основний шлях метаболізму сульфаніламідів, поширених хіміотерапевтичних препаратів і ароматичних амінів: R- NH2 + СН3-CO-SKoA ® R-NH-CO-CH3 + HS-KoA
У реакціях кон’югації з гліцином відбувається утворення гіпурової кислоти:
Швидкість цієї реакції відображає функціональний стан печінки. У клінічній практиці з метою дослідження детоксикаційної функції печінки проводять пробу Квіка: кількість гіпурової кислоти, яка екскретується у складі сечі через 4 години після введення per os стандартної дози натрію бензоату за умов норми повинна становити 2,0 – 2,5 г. Система знешкодження за участі глутатіону відіграє унікальну роль у формуванні резистентності організму людини до найрізноманітніших впливів і є одним із найважливіших захисних механізмів клітини. R + GSH → GSRH У ході біотрансформації деяких ксенобіотиків із глутатіоном під впливом глутатіонтрансферази шляхом низки послідовних перетворень утворюються токсичні сполуки – меркаптани, проте більшість кон’югованих із глутатіоном ксенобіотиків менш реакційно здатні, більш гідрофільні порівняно з вихідними речовинами і тому легко виводяться з організму. Альбумін – основний білок плазми крові, який зв’язує різноманітні гідрофобні речовини. Він може функціонувати як білок-переносник білірубіну, ксенобіотиків, лікарських речовин. Крім альбуміну, ксенобіотики можуть транспортуватися по крові в складі ліпопротеїдів, а також у комплексі з кислим a1-глікопротеїном, який інактивує ці ксенобіотики і переносить їх у печінку, де білковий комплекс розпадається. Крім того, функціонування Р-глікопротеїну (транспортна АТФаза) за умов норми забезпечує екскрецію іонів хлору та гідрофобних токсичних речовин з клітини з затратами енергії. Дата добавления: 2015-11-25 | Просмотры: 3882 | Нарушение авторских прав |