|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
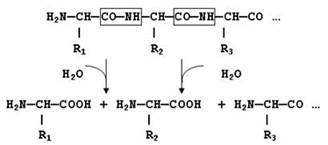
Переваривание белков.10.1.1. Переваривание белков, то есть расщепление их до отдельных аминокислот, начинается в желудке и заканчивается в тонком кишечнике. Переваривание происходит под действием желудочного, панкреатического и кишечного соков, которые содержат протеолитические ферменты (протеазы или пептидазы). Протеолитические ферменты относятся к классу гидролаз. Они катализируют гидролиз пептидных связей СО—NН белковой молекулы (рисунок 10.1):
Рисунок 10.1. Гидролиз пептидных связей. 10.1.2. Все протеолитические ферменты можно разделить на две группы: экзопептидазы – катализируют разрыв концевой пептидной связи с освобождением N- или С-концевой аминокислоты; эндопептидазы – гидролизуют пептидные связи внутри полипептидной цепи, продуктами реакции являются пептиды с меньшей молекулярной массой. 10.1.3. Большинство протеолитических ферментов, участвующих в переваривании белков и пептидов, синтезируются и выделяются в полость пищеварительного тракта в виде неактивных предшественников – проферментов (зимогенов). Поэтому не происходит переваривания белков клеток, вырабатывающих проферменты. Активация проферментов осуществляется в просвете желудочно-кишечного тракта путём частичного протеолиза – отщепления части пептидной цепи зимогена. 10.1.4. Характеристика важнейших протеолитических ферментов приводится в таблице 10.1. Примечание. Х – любая аминокислота.
Дата добавления: 2015-11-26 | Просмотры: 496 | Нарушение авторских прав |