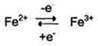|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Участие в окислительно-восстановительных реакцияхИоны металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон:
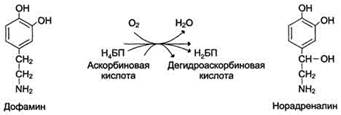
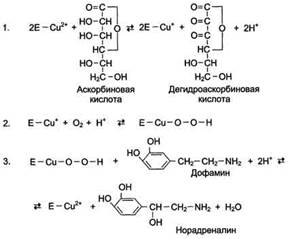
Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях. Другой пример участия ионов металлов в окислительно-восстановительных реакциях - работа фермента дофамингидроксилазы, катализирующего реакцию образования норадреналина при участии витамина С (см. схему Б). За окислительно-восстановительные свойства у дофамингидроксилазы отвечает ион меди. Фермент, содержащий ион Сu2+, не вступает в реакцию с молекулой кислорода. При восстановлении Си2+ до Си+ с помощью аскорбиновой кислоты образуется ион меди, способный взаимодействовать с кислородом с образованием перекисного соединения. Далее гидроксильная группа переносится на молекулу дофамина с образованием норадреналина. 4. Роль металлов в регуляции активности Иногда ионы металлов выступают в роли регуляторных молекул. Например, ионы Са2+ служат активаторами фермента протеинкиназы С,
Схема А
Схема Б
Рис. Участие иона меди в активации молекулы кислорода при функционировании дофамингидроксилазы. 1 - восстановление Сu2+, входящего в состав активного центра дофамингидроксилазы, до Сu+ с помощью аскорбиновой кислоты; 2 - взаимодействие Сu+ с кислородом с образованием перекисного соединения; 3 - перенос гидроксильной группы на молекулу дофамина с образованием норадреналина, катализирующего реакции фосфорилирования белков.
Внутри и внеклеточные ферменты Экзоферменты не связаны со структурой протоплазмы, легко выделяются в субстрат при жизни микробной клетки (гидролитические ферменты), растворимы в питательной среде и проходят через бактериальные фильтры. Гидролитические ферменты катализируют и другие реакции, в результате которых образуются новые пептидные связи. К ним относятся превращения, названные трансамидированием и транс-пептидированием. Гидролитические ферменты, субстратом которых являются эфиры фосфорных кислот, называются фосфатазами. Сюда относятся фосфомо-но - и диэстеразы, действующие на эфиры ортофосфорной кислоты, пиро-фосфатазы, гидролизующие эфиры пирофосфорной кислоты, метафос-фатазы, превращающие метафосфаты в ортофосфаты. К этой группе относится и важный фермент, гидролизующий аденозитрифосфорную кислоту, АТФ-фосфатаза. При этом отщепляется молекула ортофосфорной кислоты. Реакция замечательна значительным энергетическим эффектом, благодаря которому она представляет собой один из наиболее существенных процессов в энергетике организма. Гидролитические ферменты, расщепляющие гликозидные связи, - гл икозидазы (гидролазы) - проявляют высокую специфичность к определенному типу гликозидных связей. По характеру действия они разделяются на экзо - и эндо-гидролазы. Гидролазы отщепляют однотипные остатки с одного - конца полимерной цепи. Например, (3-мальта-за превращает амилозу почти количественно в мальтозу. Гидро-лазы гидролизуют гл икозидные связи беспорядочно и дают набор гомологичных серий олигосахаридов. Однако разные типы гликозидных связей расщепляются эндо-гидролазами с различной скоростью, что может быть использовано для направленного гидролиза лишь одного типа гликозидных связей. Гидролазы используют для получения олигосахаридов из декстрана. Гидролитические ферменты составляют основную часть содержимого макрофагальных лизосом и гранул у нейтрофилов. Они участвуют в процессах гидролитического расщепления фагоцитированного материала. Гидролитические ферменты катализируют присоединение элементов воды. Например, щелочные и кислые фосфатазы гидроли-зуют фосфорные зфиры в щелочной и кислой среде соответственно. Внутриклеточные гидролитические ферменты осуществляют, по-видимому, одновременно как распад, так и синтез всех указанных выше сложных веществ. Обратимость действия гидролитических ферментов доказана на примере липаз. Примеромгидролитического фермента может служить химо-грипсин, который получается при воздействии особого вещества - трипсиногена (трипсиноген синтезируется в поджелудочной железе) на трипсин. Химотрипсин ускоряет гидролиз пептидных связей в слабощелочной среде, он катализирует также и гидролиз некоторых сложных эфиров. Предполагают, что активный участок молекулы химотрипсина состоит из четырех остатков аминокислот: серина, изолейцина и двух остатков гистидина. Составные части активного центра должны быть очень точно расположены относительно друг друга и молекулы субстрата. Ингибированиегидролитических ферментов может быть вызвано непосредственным воздействием ПАВ путем блокирования функциональных групп фермента или нарушения его третичной структуры либо вследствие блокирования субстрата в результате сорбции на нем ПАВ, что определяет его недопустимость для действия фермента. К тому же присутствие ПАВ вызывает нарушение энергетических соотношений на поверхности раздела между бактериальной клеткой и средой, что приводит при определенных концентрациях к подавлению активных обменных процессов бактерий, и в первую очередь метановых. Последнее подтверждается накоплением в иловой жидкости летучих жирных кислот и снижением фактического выхода газа по сравнению с расчетным, определяемым по распаду жиров, белков и углеводов. Действиегидролитических ферментов неоднократно исследовалось, однако полученные результаты неполны, как и следовало ожидать. В процессе, обусловленном гидролитическим ферментом, например в инверсии тростникового сахара инвертазой, нужно принимать во внимание три главных фактора: вещество, которое гидролизуется, фермент и воду. Из этих факторов только два первых могут изменяться, в то время как третий, вода, остается всегда постоянным, и его количественное участие в процессе не может быть определено, ибо процесс протекает в водном растворе. Однако едва ли необходимо указывать, что вода играет при этом существенную роль и что все ферментативные гидролитические процессы следует рассматривать только как активацию воды соответственными ферментами. Так, например, тростниковый сахар инвертируется одной водой, хотя и чрезвычайно медленно, инвертаза же только неизмеримо ускоряет этот процесс. Если количественное участие воды в гидролитическом процессе остается неопределимым, то действие ферментов выявляется чрезвычайно односторонне. Угидролитических ферментов активные центры находятся на поверхности самого белка. Средиразличных гидролитических ферментов, выделенных из термофильных микроорганизмов, развивающихся при 55 - 65 С, наиболее изучена а-амилаза. Она не инактивируется после 24-часовой выдержки при 65 - 70 С. Адениндезамнназа - гидролитический фермент, осуществляющий дезаминирование аденина с превращением его в гипоксантин. АРГИНАЗА - гидролитический фермент, относящийся к группе дезаминаз, мол. L-аргинин на орнитин и мочмину (D-аргинин практически А.
Эндоферменты прочно связаны с бактериальной клеткой и действуют только внутриклеточно, осуществляя дальнейшее разложение питательных веществ и превращение их в составные части клетки. К таким ферментам можно отнести, например, дегидрогеназы, оксидазы. 1. Оксидоредуктазы — ферменты, катализирующие окислительно-восстановительные реакции. 2. Трансферазы — ферменты, катализирующие перенос отдельных радикалов, частей молекул или целых атомных группировок (не водорода) от одних соединений к другим. 3. Гидролазы — ферменты, катализирующие реакции гидролиза (расщепления) белков, жиров и углеводов с участием воды. 4. Лиазы — ферменты, катализирующие отщепление от субстратов определенных химических групп с образованием двойных связей или присоединение отдельных групп или радикалов по двойным связям. 5. Изомеразы— ферменты, осуществляющие превращение органических соединений в их изомеры. 6. Лигазы (синтетазы) — ферменты, катализирующие процессы синтеза связей за счет энергии распада АТФ.
Дата добавления: 2015-12-15 | Просмотры: 766 | Нарушение авторских прав |