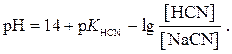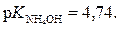|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Матеріали для самоконтролю. Тема 7. Властивості буферних розчинівТема 7. Властивості буферних розчинів Актуальність теми Одним з найважливіших аспектів гомеостазу організму людини є підтримування постійного значення рН, що здійснюється буферними системами та фізіологічними механізмами. Буферні системи регулюють концентрацію іонів Гідрогену та гідроксид - іонів а також перебіг реакцій, що залежать від величини рН. Знання про буферні системи необхідні при вивченні біохімії, фізіології, фармакології та клінічних дисциплін. Конкретні цілі Пояснювати механізм дії буферних систем. Базові знання, вміння, навички, необхідні для вивчення теми Мати уявлення про сильні й слабкі електроліти, водневий показник, шкалу рН. Вміти визначати рН розчинів. 4.Завдання для самостійної роботи під час підготовки до заняття 4.1. Теоретичні питання до заняття: 1. Класифікація буферних розчинів. 2. Механізми дії буферних систем. 3. рН буферних розчинів (рівняння Гендерсона - Гассельбаха).
Практична робота (завдання), що виконується студентами на занятті Визначення впливу розведення на рН буферних розчинів У першу пробірку налити 6 мл буферного розчину, в другу ̶ 2 мл цього ж розчину та 4 мл дистильованої води. У кожну пробірку додати по 2 краплі індикатора метилового червоного. Вміст пробірок перемішати й порівняти забарвлення. Визначення впливу кислоти та лугу на рН буферного розчину У три пробірки налити по 4 мл буферного розчину з відомим значенням рН. Потім додати в одну пробірку 2 краплі розчину НСl (С = 0,1 моль/л), у другу ̶ 2 краплі розчину NaOH (С = 0,1 моль/л), у третю ̶ 2 краплі дистильованої води і в кожну ̶ по 2 краплі індикатора метилового червоного. Розчини перемішати й порівняти забарвлення.
Оформлення протоколу лабораторної роботи За результатами спостережень зробити висновок про вплив кислот, лугів та розведення на рН буферних розчинів.
Матеріали для самоконтролю 1. Вибрати правильну формулу для розрахунку рН буферної системи HCN – NaCN: а)
б)
2. Розрахувати рН буферного розчину, що був приготований з 0,04 л розчину аміаку з концентрацією 0,15 моль/л та 0,02 л розчину амоній хлориду з концентрацією 0,25 моль/л; а) 4,67; б) 6,42; в) 9,33; г) 10,12.
3. Пояснити, чому при додаванні невеликої кількості сильної кислоти до гідрогенкарбонатної буферної системи її рН практично не змінюється: а) підвищується ступінь дисоціації натрій гідрогенкарбонату; б) рівновага зміщується в бік утворення катіонів Гідрогену: CO2 + H2O ⇄ H+ + НСО3- в) під впливом сильних кислот розкладається карбонатна кислота; г) сильна кислота замінюється еквівалентною кількістю слабкої карбонатної кислоти.
4. Вказати, від яких факторів залежить рН буферної системи: а) від природи слабкого електроліту (кислоти чи основи); б) від співвідношення концентрацій компонентів буферної системи; в) від концентрації слабкого електроліту (кислоти чи основи); г) від концентрації солі. Дата добавления: 2015-12-15 | Просмотры: 625 | Нарушение авторских прав 12 |
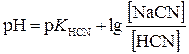 ; в)
; в) 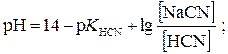
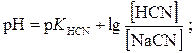 г)
г)