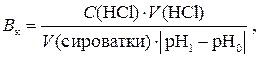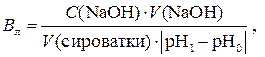|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Потенціометричне визначення буферної ємності сироватки кровіТема 8. Роль буферних розчинів у біосистемах Актуальність теми Рідини живого організму – кров, сеча, внутрішньоклітинна рідина, лімфа та інші містять буферні системи для підтримування постійного значення рН. При багатьох захворюваннях спостерігається зміщення рН або в кислу область (ацидоз), або в лужну (алкалоз). Відомо, що тривале зміщення рН крові на 0,3 - 0,4 одиниці рН може призвести до смерті хворого. Тому буферна ємність є дуже важливою характеристикою буферної системи або сукупності систем, бо характеризує здатність до нейтралізації речовин, що можуть змінити величину рН. Для точного визначення буферної ємності застосовується потенціометричний метод, який дає змогу чітко зафіксувати зміну рН. Конкретні цілі Пояснювати роль буферних систем у підтриманні кислотно - основної рівноваги в біосистемах.
Базові знання, вміння, навички, необхідні для вивчення теми Знати класифікацію та механізми дії буферних систем. Характеризувати шкалу рН та знати норми рН біологічних рідин організму. Вміти визначати рН розчинів потенціометричним методом.
4.Завдання для самостійної роботи під час підготовки до заняття 4.1. Теоретичні питання до заняття: 1. Буферні системи крові: а) гідрогенкарбонатна (бікарбонатна) буферна система; б) фосфатна буферна система; в) білкові буферні системи. 2. Буферна ємність та фактори, від яких вона залежить. 3. Поняття про кислотно - основний стан (КОС) крові.
Практична робота (завдання), що виконується студентами на занятті Потенціометричне визначення буферної ємності сироватки крові проводиться на приладі іономірі, що заздалегідь настроєний по стандартних буферних розчинах.
1. Підготовка приладу до роботи: - натиснути кнопки “t” і “ ̶ 1 ̶ 19”. Прогріти прилад протягом 30 хв.; - зібрати гальванічне коло з електрода визначення й електрода порівняння. Електродом визначення є скляний електрод з Н+ функцією, електродом порівняння (допоміжним) – хлорсрібний електрод (ЭВЛ - ІМ) із сталим значенням потенціалу 0,201 В. Електроди підключити в відповідні гнізда на задній панелі приладу; - встановити електроди в спеціальний утримувач над магнітною мішалкою. Титрування проводити в стаканчику місткістю 50 мл, де знаходиться магнітна мішалка для перемішування; - натиснути кнопки “аніони/катіони”, “рХ” та кнопку діапазону рН“4 – 9”.
2. Визначення буферної ємності по кислоті (Вк) Піпеткою відібрати 20 мл сироватки крові, перенести в стаканчик з магнітною мішалкою. Бюретку заповнити титрованим розчином хлоридної кислоти. Визначити первинне значення рНо. При перемішуванні додати розчин кислоти до зміни рН на одиницю. Визначити на приладі точне значення рН1, що встановилося, а по бюретці – точний об’єм кислоти, що був витрачений. Буферну ємність розрахувати за формулою:
де С (НСl) – молярна концентрація еквівалента розчину хлоридної кислоти, моль/л, V (НСl) – об’єм розчину хлоридної кислоти, мл, V (сироватки) – об’єм сироватки крові, мл, |рН1 – рН0| – різниця значень рН по абсолютній величині.
3. Визначення буферної ємності по лугу (Вл) Відібрати піпеткою 20 мл сироватки крові. Бюретку заповнити титрованим розчином натрій гідроксиду. Титрування проводити аналогічно попередньому. Визначити нове значення рН1 сироватки крові та витрачений об’єм розчину натрій гідроксиду. Виконати розрахунок за формулою:
де С (NaOH) – молярна концентрація еквівалента розчину натрій гідроксиду, моль/л, V (NaOH) – об’єм розчину натрій гідроксиду, мл, V (сироватки) – об’єм сироватки крові, мл, |pH1 – рН0| – різниця значень рН по абсолютній величині.
Дата добавления: 2015-12-15 | Просмотры: 1012 | Нарушение авторских прав |