 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ВИЗНАЧЕННЯ УНІВЕРСАЛЬНОЇ ГАЗОВОЇ СТАЛОЇЛабораторна робота № 161 Мета роботи: визначити величину універсальної газової сталої. Прилади та обладнання: установка з вакуумметром, скляний балон з краном, терези з важками, барометр, термометр. Теоретичні відомості Універсальна газова стала – одна з фундаментальних фізичних сталих, що широко використовується в молекулярно - кінетичній теорії та термодинаміці, в інженерних дисциплінах, де вивчають процеси в газових середовищах (аеро - та гідродинаміка, тепломасообмін, енергетичне обладнання). Універсальна газова стала входить до багатьох фізичних формул, які використовують для обчислення процесів у газах, зокрема в рівнянні Клапейрона - Менделєєва:
де V – об'єм газу, м3; m – маса газу, кг; μ – молярна маса, кг/кмоль або кг/моль; T – абсолютна температура, К. Значення універсальної газової сталої в СІ: R = 8,31 Дж/(моль·К) = 8,31·103 Дж/(кмоль·К)
(в інженерних обчисленнях більше використовують друге значення). Для того, щоб визначити фізичний зміст універсальної газової сталої знайдемо елементарну роботу, яку виконує газ при зміні об'єму на dV: δA = pdV. (161.2) Для ізобаричного процессу (p = const) продиференціюємо рівняння (161.1):
З формул (161.2) та (161.3) зробимо висновок, що
Отже, універсальна газова стала чисельно дорівнює роботі, яку виконує один моль ідеального газу при його ізобаричному нагріванні на один градус. Фізичний зміст універсальної газової сталої можна також встановити з рівняння Майєра: Cp = CV + R, де Ср, СV – відповідно ізобарна та ізохорна молярні теплоємності ідеального газу. Тобто R вказує, на скільки молярна теплоємність при ізобаричному нагріванні більша, ніж при ізохоричному. Існує ще одна стала k – стала Больцмана: k = R / NA= 1,38·10-23Дж/К де NA = 6,23·1023 моль-1 – число Авогадро. Фізичний зміст числа Авогадро: це число структурних одиниць (молекул, атомів, іонів) в одному молі будь-якої речовини. Стала Больцмана входить в усі закони, які містяться в класичній або квантовій функції розподілу частинок за енергіями. З рівняння Клапейрона - Менделєєва знаходимо основне рівняння молекулярно - кінетичної теорії ідеального газу. Для одного моля газу рівняння (161.1) має вигляд pVμ = RT, де Vμ – об’єм одного моля газу, або
де n – концентрація молекул – число молекул в 1 м3; n = NA/Vμ. Дата добавления: 2016-06-05 | Просмотры: 675 | Нарушение авторских прав |
 , (161.1)
, (161.1) – кількість молей в даній масі гізу, моль
– кількість молей в даній масі гізу, моль , (161.3)
, (161.3) або
або  , (161.4)
, (161.4)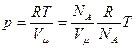 ; p = nkT,
; p = nkT,