 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Правильні відповіді. 1. Правильна відповідь г).1. Правильна відповідь г). Згідно з сучасною теорією ПЕШ, його будова відрізняється від розподілу зарядів у конденсаторі тим, що заряджені частинки в розчині (катіони металу або протиіони) входять до складу щільної та дифузійної частини ПЕШ.
2. Правильна відповідь б). У загальному вигляді процес на металічному електроді записується як процес
відновлення: катіон металу приймає електрони, утворюючи не заряджений атом.
3. Правильна відповідь а). Тому що на нікелевому електроді відбувається процес, що може бути в загальному вигляді записаний як: Ni2+ + 2e- ⇄ Ni, тобто кількість електронів (n – у рівнянні Нернста) дорівнює двом.
4. Правильна відповідь в). Стандартний потенціал металічного електрода залежить лише від природи металу, отже, тиск і температура повинні бути стандартними, а концентрація катіонів металу дорівнювати одиниці. За таких умов величина потенціалу металічного електрода в рівнянні Нернста буде дорівнювати стандартному потенціалу.
5. Правильна відповідь в). Інертний метал (платина, золото, паладій тощо) повинен знаходитися в розчині, що є окисно - відновною системою. Метал виконує роль провідника електронів: він із зовнішньої мережі передає електрони окисненій формі в розчині, або приймає електрони від відновленої форми і передає у зовнішню мережу. Таким чином, метал не обмінюється електронами й іонами з компонентами розчину.
6. Правильна відповідь г). Найбільш сильним окисником буде окиснена форма тієї системи, яка має більше значення окисно - відновного потенціалу.
7. Правильна відповідь б). Самодовільно буде йти такий окисно - відновний процес, для якого φ ок > φ відн і ЕРС > 0; (ЕРС = φ ок – φ відн). Окисником буде Сl2, а відновником – Fе2+: 2 Fе2+ + Cl2 = 2 Сl- + + 2Fе3+. 2 FeSO4 + Cl2 + Na2SO4 → 2 NaCl + Fе2(SО4)3. ЕРС = 1,36 – 0,771 = 0,589 В. Отже, ЕРС > 0. Таким чином, самодовільно реакція буде йти в напрямку справа наліво.
8. Правильна відповідь б). Самодовільно будуть іти за стандартних умов реакції 2 і 3, тому що самодовільно проходить реакція, в якій відновником є метал, що має менше значення потенціалу. За стандартних умов такими будуть метали, що в ряді стандартних потенціалів розташовані лівіше. Так, наприклад, стандартний потенціал магнію (–2,363 В) менший, ніж стандартний потенціал олова (–0,136 В); стандартний потенціал кадмію
(–0,403 В) менший, ніж стандартний потенціал кобальту (–0,277 В). Але реакції 1) та 4) йти за стандартних умов не будуть, тому що стандартний потенціал міді (0,337 В) – а це відновник, більший за стандартний потенціал цинку (–0,763 В). А стандартний потенціал срібла (0,799 В) (відновник) більший, ніж стандартний потенціал свинцю (–0,126 В). 9. Правильна відповідь а). Кращим окисником буде окиснена форма редокс - системи, потенціал якої буде в більшій мірі перевищувати 0,771 В. Такою системою буде система, окиснена форма якої – КМnО4 у кислому середовищі.
10. Правильна відповідь а). Гальванічне коло для визначення рН повинно складатися з електрода визначення, потенціал якого залежить від рН розчину, й електрода порівняння, потенціал якого є сталим і не залежить від рН розчину. Із вказаних чотирьох пар електродів тільки перша пара не може бути застосована для визначення рН, бо складається з двох електродів, визначення потенціалу яких залежить від рН. У всіх інших парах один електрод буде електродом визначення (відповідно – водневий, скляний, хінгідронний), а другий – електродом порівняння (відповідно – нормальний водневий, хлорсрібний і каломельний).
11. Правильна відповідь б). Спочатку визначаємо молярну концентрацію еквівалента кислоти за результатами титрування:
Звідси концентрація (активність) катіонів Гідрогену, припускаючи повну дисоціацію молекул хлоридної кислоти, буде дорівнювати: [Н+] = 0,145 моль/л. За рівнянням Нернста для водневого електрода знаходимо значення потенціалу (за стандартної температури):
Дата добавления: 2015-12-15 | Просмотры: 537 | Нарушение авторских прав |
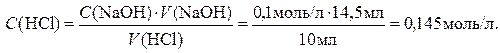
 = 0,059 lg [Н+] = 0,059 . lg 0,145 = 0,059 · (–0,839) = –0,0495 В.
= 0,059 lg [Н+] = 0,059 . lg 0,145 = 0,059 · (–0,839) = –0,0495 В.