 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Матеріали для самоконтролю. 1. Пояснити будову подвійного електричного шару (ПЕШ), що утворюється при зануренні металу в розчин солі цього металу:
1. Пояснити будову подвійного електричного шару (ПЕШ), що утворюється при зануренні металу в розчин солі цього металу: а) внаслідок переходу іонів металу в розчин або з розчину на метал відбувається розподіл зарядів між зовнішнім і внутрішнім шарами металу й виникає ПЕШ, подібний розподілу зарядів у конденсаторі; б) внаслідок переходу іонів металу в розчин або з розчину на метал на межі поділу фаз метал - розчин утворюється ПЕШ, що складається із зарядів на поверхні металу (іони або електрони) і зарядів у суміжному шарі розчину (іони), подібно до зарядів у конденсаторі; в) внаслідок переходу іонів металу в розчин або з розчину виникає ПЕШ за рахунок різниці концентрації катіонів металу в суміжному з поверхнею поділу шарі розчину й у масі розчину; г) внаслідок переходу іонів металу в розчин або з розчину на поверхні поділу виникає ПЕШ, що утворений іонами металу (електронами) на поверхні металу й протиіонами (іонами) частково в суміжному шарі розчину, а частково на деякій відстані від поверхні розподілу.
а) Zn ─ 2е- ⇄ Zn2+ ; в) Zn + 2е- ⇄ Zn2- ; б) Zn2+ + 2е- ⇄ Zn; г) Zn2+ ─ 2е- ⇄ Zn4+.
3. Вказати рівняння Нернста для нікелевого електрода при 298 К: а)
б)
4. Вказати правильне визначення стандартного потенціалу металевого електрода: а) стандартним називається потенціал електрода, якщо концентрації всіх речовин, що беруть участь у електродному процесі, дорівнюють одиниці; б) стандартним називається потенціал електрода, якщо концентрації всіх речовин, що беруть участь у електродному процесі, є однаковими; в) стандартним називається потенціал електрода, якщо концентрація катіонів металу дорівнює одиниці, а температура й тиск є стандартними; г) стандартним називається потенціал електрода, що виміряний відносно стандартного водневого електрода.
5. Вибрати правильну характеристику окисно - відновного електрода: а) це метал, що занурений у розчин електроліту й обмінюється з ним іонами та електронами; б) це інертний метал, що зануренийу розчин електроліту йобмінюється з ним електронами; в) це інертний метал, що занурений у окисно - відновну систему й є лише провідником електронів; г) це інертний метал, що занурений у окисно - відновну систему й обмінюється з нею іонами та електронами.
6. Вказати, окиснена форма якої окисно - відновної системи буде найбільш сильним окисником за стандартних умов:
а) НВrО + H+ + 2e– = Вr– + H2O; φ 0 = 1,34; б) СrО42– + 4 Н2О + 3е– = Сr(ОН)3 + 5 ОН–; φ 0 = - 0,13; в) 2 IО3– + 12 Н+ + 10e– = I2 + 6 H2O; φ 0 = 0,19; г) H2O2 + 2 Н+ + 2е- = 2 H2O; φ 0 = 1,78.
7. Пояснити, в якому напрямку за стандартних умов буде самодовільно йти реакція: 2 NaCI + Fе2(SO4)3 ⇄ 2 FeSO4 + Cl2 + Na2SO4, якщо
а) зліва направо; в) реакція взагалі не буде йти; б) справа наліво; г) реакція буде йти в обох напрямках.
8. Користуючись електрохімічним рядом напруг металів, вказати, яка з реакцій буде йти самодовільно за стандартних умов: 1) Zn2+ + Cu → Cu2+ + Zn; 3) Cd + Co2+ → Cd2+ + Co; 2) Mg + Sn2+ → Sn + Mg2+; 4) 2Ag + Pb2+ → Pb + 2Ag+. а) 1, 2, 3; б) 2, 3; в) 4; г) 2.
9. Вибрати кращий окисник для перетворення Fе2+ ─ іона за стандартних умов у Fе3+ ─ іон, якщо стандартний потенціал а) KMnО4 у кислому середовищі (φ 0 = 1,51В); в) НNO2 (φ 0 = 1,0 В); б) КМnО4 у нейтральному середовищі(φ 0 = 0,58 В); г) CuSO4 (φ 0 = 0,153 В).
10. Вказати пари електродів, що можуть бути застосовані в гальванічному колі для визначення рН: 1) скляний – хінгідронний; 2) водневий – нормальний водневий; 3) скляний – хлорсрібний; 4) хінгідронний – каломельний. а) 2, 3, 4; б)1, 3; в)1, 2, 3; г)1, 4.
11. Розрахувати потенціал водневого електрода, що занурений у розчин хло- ридної кислоти, на титрування 10 мл якого витрачається 14,5 мл розчину з концентрацією натрій гідроксиду: а) 0,0685 В; б) –0,0435 В; в) 0,0495 В; г) –0,00985 В. Дата добавления: 2015-12-15 | Просмотры: 553 | Нарушение авторских прав |
 2. Вказати, яка форма запису прийнята для рівноважного процесу на цинковому електроді Zn Zn2+ у загальному вигляді:
2. Вказати, яка форма запису прийнята для рівноважного процесу на цинковому електроді Zn Zn2+ у загальному вигляді: в)
в) 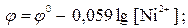
 г)
г) 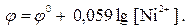
 = 1,36 B, a
= 1,36 B, a  = 0,771B:
= 0,771B: