 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Обробка результатів та оформлення протоколу лабораторної роботи1) Розрахувати практичні значення окисно - відновних потенціалів для трьох систем за формулою: φ пр = Е + φ доп , де Е – значення ЕРС, В (визначене на приладі); Е = φ пр – φ доп; φ доп = 0,201 В – потенціал хлорсрібного електрода. 2) Розрахувати теоретичні значення окисно - відновних потенціалів для двох систем з урахуванням концентрацій окисненої та відновленої форм за рівняннями:
Концентрації речовин наведені в таблиці. 3) Результати визначень та розрахунків занести в таблицю 15:
Таблиця 15
4)Користуючись значеннями стандартних окисно - відновних потенціалів систем φ 0 (з таблиці), визначити можливість самодовільного перебігу реакцій: а) Fе3+ + І- → б) Fe2+ + I2 → за формулою: E = φ ок - φ відн . Самодовільно буде йти такий окисно - відновний процес, для якого: φ ок > φ відн , Е > 0. Дата добавления: 2015-12-15 | Просмотры: 577 | Нарушение авторских прав |
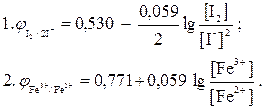
 Pt I2, 2I-
Pt I2, 2I-
 Pt Fe3+, Fe2+
Pt Fe3+, Fe2+