 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
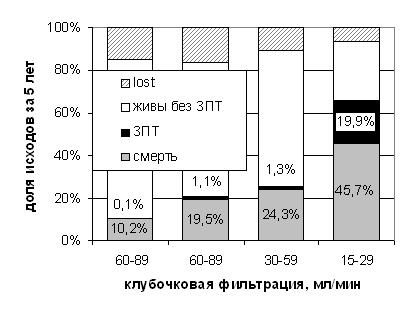
Показания к гемодиализуЗаместительную почечную терапию (гемодиализ, перитонеальный диализ и трансплантация почки) следует рассматривать как единый комплекс лечебных методов. Наилучшие результаты долгосрочного лечения пациентов с ХПН достигаются при последовательном применении оптимальных для каждого периода заболевания метода лечения с учетом объективного состояния пациента, доступности методов и информированного предпочтения пациента. В мире и в России очень редко аллотрансплантация почки становится первым методом лечения, хотя для некоторых групп пациентов (и особенно – детей) пересадка почки до развития существенных осложнений почечной недостаточности была бы оптимальной. В таких случаях речь обычно идет о родственной пересадке (от живого донора). Поэтому на практике выбор остается между перитонеальным диализом (ПД) и гемодиализом (ГД). Многочисленные наблюдения за результатами применения тактики начала диализа с ПД при наличии относительно сохранной функции почек (~ 8 - 10 мл/мин) в центрах, где равнодоступны оба метода, убеждают в том, что формула, высказанная Норбертом Ламером: «начинать лечение с перитонеального диализа, где это возможно, переводить на гемодиализ, когда это необходимо, и выполнять трансплантацию почек насколько возможно рано» – удивительно справедлива. Данный подход делает ненужными сравнения эффективности двух методов диализа. Каждый метод имеет свои преимущества и ограничения. Сравнительные показания к выбору в качестве первого того или иного метода заместительной почечной терапии представлены в разделе «Перитонеальный диализ при хронической почечной недостаточности». К сожалению, в большинстве диализных центров отсутствует возможность проводить перитонеальный диализ, или доступ к нему ограничен. Если рассматривать ГД как единственную возможность заместительной почечной терапии, то рассмотрение вопроса о показаниях к диализу сводятся к определению срока своевременного начала гемодиализа и крайне ограниченного перечня оснований для отказа от начала диализа. Всеми современными рекомендациями установлен диапазон снижения остаточной функции почек, когда мероприятия по подготовке к началу заместительной почечной терапии, безусловно, должны быть начаты. Предоставить пациенту достаточную информацию о предстоящей заместительной терапии, ее вариантах, предположительных сроках начала необходимо на стадии IV ХБП (СКФ 15-29 мл/мин). После осознанного выбора ГД как первого метода заместительной почечной терапии (если выбор возможен) на уровне СКФ 15 мл/мин следует подготовиться и сформировать сосудистый доступ для гемодиализа; для абсолютного большинства пациентов им должна стать артерио-венозная фистула. Созревание фистулы потребует срок не менее месяца. Более раннее использование фистулы неблагоприятно скажется на сроках ее эффективного функционирования. На уровне клубочковой фильтрации 6-8 мл/мин следует начать лечение гемодиализом. В последние месяцы перед достижением этого уровня у пациента может резко ускориться прогрессирование почечной недостаточности, дополнительным толчком к ухудшению состояния может стать любая интеркурентная инфекция, небольшое кровотечение, разбалансировка сахарного диабета или ухудшение течения любого хронического заболевания. Следует помнить, что большинство пациентов с ХБП IV – V погибают от осложнений почечной недостаточности, не доживая до начала диализа (Рисунок 1), и частота этих осложнений (в первую очередь, сердечно-сосудистых) быстро увеличивается по мере приближения к потребности в диализе.
Рисунок 1. 5-летнее наблюдение за исходами I - IV стадий ХБП (28 тысяч пациентов)
Поэтому ожидание достижения пациентом определенного уровня остаточной функции почек (например, 6 мл/мин) может стать опасным. Принятие решения о начале диализа должно основываться не только на уровне СКФ (и, тем более, не на уровне креатинина), но и на клинических свидетельствах ухудшения течения почечной недостаточности: · неудовлетворительный контроль артериальной гипертензии; · гипергидратация, угрожающая отеком легких; · снижение показателей нутриционного статуса (стБВА< 0,8 г/кг/сут); · нарастание анемии, несмотря на адекватные запасы железа (ферритин не менее 100 мкг/л); · гиперкалиемия; · неконтролируемый уровень фосфатов, несмотря на диетические ограничения и прием фосфат-биндеров; · утяжеление течения хронических инфекционных и неинфекционных заболеваний. От более раннего начала диализа могут выиграть пациенты с сахарным диабетом. При СКФ в 6 мл/мин все пациенты должны начать заместительную почечную терапию. Основаниями для отказа от заместительной почечной терапии могут служить крайне ограниченный перечень состояний: · крайне тяжелое соматическое состояние, связанное с сопутствующей патологией (не почечной недостаточностью) · IV стадия онкологического заболевания, определяющего неблагоприятный ближайший прогноз · тяжелое психическое заболевание (NB: острый психоз может быть следствием уремии и не является основанием от отказа от ЗПТ) · информированный отказ пациента от заместительной почечной терапии Начало заместительной почечной терапии должно осуществляться в стационарных условиях. В течение первой недели (и дольше при тяжелом состоянии пациента) сеансы гемодиализа желательно выполнять ежедневно, постепенно увеличивая их продолжительность от 2 часов, используя небольшие диализаторы. Это правило должно соблюдаться тем более строго, чем выше исходный уровень мочевины – для предотвращения выраженного дизэквилибриум-синдрома, связанного с неравномерностью удаления мочевины из различных водных секторов тела; замедленное ее выведение из ткани головного мозга может привести к тяжелому отеку головного мозга. Доза диализа Диализ не может заместить функцию почек полностью, сколь бы мощным он не был, поскольку диффузией и конвекцией не исчерпываются почечные функции. Тем не менее, существует, по-видимому, некоторый минимальный объем диализа (доза диализа) который требуется для оптимизации выживаемости и качества жизни пациентов. Хотя удаление уремических токсинов – главная задача диализа, объем удаления (mass removal) какого-нибудь отдельного вещества не может служить удовлетворительной оценкой функции диализа, поскольку зависит, главным образом, от исходной концентрации, и в стабильном состоянии объем удаления растворенного вещества – просто мера скорости его генерации, которая (говоря в общем) не зависит от диализа. Концентрация токсина (или его суррогата, представителя) в крови также не может служить мерой эффективности диализа, поскольку также зависима от скорости генерации. Лучшим примером может служить относительно низкий уровень мочевины у пациентов с тяжелой уремией и низким потреблением белка, когда низкий уровень мочевины свидетельствует о тяжелом состоянии и плохом прогнозе. Клиренс же не зависит от скорости генерации или концентрации растворенного вещества; более того, для оценки эффективности диализа избранное вещество необязательно должно обладать токсичностью. Идеальный маркер должен легко измеряться, накапливаться при ХПН и удаляться диализатором. Поскольку универсального представителя всех разнообразных уремических токсинов быть не может, мочевина, первой избранная в качестве маркера уремических токсинов, остается основой для расчета клиренсов и в настоящее время. Итак, производительность диализатора оценивается его клиренсом – отношением скорости удаления вещества к его концентрации в крови. С увеличением кровотока и потока диализирующего раствора по диализатору клиренс его увеличивается, но – по мере их роста – во все снижающейся степени, выходя постепенно на плато. Для оценки максимального достижимого клиренса при неограниченном потоке крови и диализирующего раствора введено понятие коэффициента массопереноса K0A, который определяется как K0A = (Qb´ Qd)/(Qb – Qd) ´ ln [(1–Kd/Qb)/(1–Kd/Qb)], где Qb - скорость кровотока (в мл/мин); Qd - поток диализата (в мл/мин); Kd - клиренс мочевины диализатора. K0A прямо пропорционален площади мембраны и обратно пропорционален средней длине пор мембраны, через которые происходит диффузия. Зная K0A диализаторов можно сравнивать их между собой и рассчитывать ожидаемый клиренс при заданных скоростях кровотока и потока диализата:
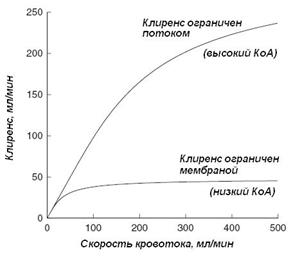
Кроме обозначения пределов максимальной эффективности диализатора практический смысл использования K0A состоит в рациональном выборе скорости кровотока: диализаторы с малым K0A (300-500) дают незначительную прибавку клиренса при увеличении скорости кровотока выше 250 мл/мин; напротив применять диализаторы с очень высоким K0A (~1000) при скорости кровотока менее 400 мл/мин не имеет смысла: их потенциальная производительность остается неиспользованной.
Рисунок 2. Клиренсы диализаторов при различных КоА
Диализанс – более устойчивая, чем клиренс, характеристика производительности диализатора, поскольку в ней учитывается накопление вещества в диализате. Если для расчета клиренса скорость удаления относят к концентрации вещества в крови, то при расчете диализанса знаменателем служит градиент концентрации между кровью и диализатором. При однократном прохождении растворов клиренс и диализанс равны. Но если концентрации при определенных условиях успевают выравниваться, то клиренс снижается (уменьшается скорость удаления при снижении градиента концентраций), а диализанс остается на исходной величине (уменьшенная скорость удаления делится на уменьшенный градиент). Это актуально для веществ, присутствующих по обе стороны мембраны, например, для натрия, диализанс которого используется в on-line устройствах оценки клиренса диализатора. Клиренс диализатора можно рассчитать по непосредственным измерениям концентраций во входящей в диализатор и выходящей крови, разделив скорость удаления на входящую концентрацию: Kd = Qbw (Cвх – Свых) / Свх (2) где Qbw – поток воды крови через диализатор. Заметим, что ту же формулу можно рассматривать как произведение входящего потока воды крови на долю экстракции вещества (Cвх – Свых) / Свх. Если при медленном потоке происходит почти полное выведение вещества в диализат (как в продолжительных методах заместительной почечной терапии), клиренс диализатора приближается к скорости потока крови. В зависимости от распределения вещества по секторам крови клиренсы цельной крови, плазмы или воды крови для отдельных веществ могут сильно разниться; например, фосфаты не проникают в эритроциты, и клиренс цельной крови для них будет существенно ниже, чем для мочевины, тогда как клиренс плазмы для фосфатов и мочевины в современных высокопроницаемых диализаторах сопоставим. Подобный расчет относится лишь к клиренсу в данный момент времени. В ходе диализа клиренс неизбежно снижается из-за снижения градиента концентраций и возможного частичного тромбирования волокон диализатора, а также колеблется вместе с эффективной скоростью крово(плазма)тока, эпизодами гипотонии с централизацией кровообращения и другими факторами. Эффективность сеанса гемодиализа в целом (суммарный клиренс) обычно измеряется по снижению концентрации растворенного вещества в крови за время диализа. В упрощенном случае, когда скорость генерации растворенного вещества за время сеанса диализа принимается равной нулю, а объем его распределения не меняется (G=0, dV=0), скорость удаления (dC) пропорциональна снижающейся концентрации, и отношение dC/C во времени (t) не меняется: (dC/C)/dt = –k = –K/V, (3) где k – константа скорости (фракционное удаление), которая прямо зависит от клиренса диализатора (K) и обратно – от объема распределения растворенного вещества в теле пациента. В линейной системе координат концентрация-время Интегрируя вышеприведенное выражение по времени, получаем: С=С0 e–Kt/V. (4) или Kt/V = –ln(С/C0) (5) Последняя формула – фундаментальное выражение, позволяющее измерять суммарный клиренс при меняющейся в ходе диализа концентрации. Однако формула эта необоснованно упрощена, поскольку не учитывает ультрафильтрацию в ходе диализа (которая может добавлять к диффузионному клиренсу 10-30% за счет конвекции) и генерацию мочевины в течение сеанса диализа. Однопуловая модель кинетики мочевины, включающая эти факторы, выглядит следующим образом. Мочевина с концентрацией (С) равномерно распределена по объему Vurea, равному общему объему воды тела. Мочевина поступает в этот сектор только из печени, где образуется в результате катаболизма аминокислот (G). Ее удаление происходит непрерывно за счет (остаточного) почечного клиренса (Kr) и прерывистого диализного клиренса, которые составляют суммарный клиренс (K). Тогда эквивалентом формулы (3) становится: dCVurea/dt = G – KC (6) Интегрирование этого равенства дает детально разработанную, но несравненно более сложную версию формулы(4):
где В – скорость изменения объема распределения мочевины (отрицательная во время диализа – ультрафильтрация, и положительная вне диализа – набор веса). Это уравнение, строго говоря, нельзя привести к простой формуле, подобной (5), но, используя итерацию (повторные пересчеты), можно рассчитать объем распределения мочевины и скорость генерации, а по ним – обеспеченную дозу диализа – однопуловый Kt/Vurea (spKt/Vurea). Такой способ расчета назван моделированием мочевины. Хотя кинетическое моделирование мочевины реализовано в ряде компьютерных программ и имеет некоторые преимущества (возможности расчета скорости генерации мочевины и, соответственно, потребления белка, расчета реального клиренса диализатора для сопоставления его с табличным и поиска причин расхождения), широкого распространения оно не получило. Вместо него были разработаны значительное количество эмпирических аппроксимаций с теми же переменными для расчета spKt/Vurea, наиболее общепризнанной из которых явилась формула Дж. Догирдаса, предложенная в 1993 году: spKt/Vurea = –ln(R – 0,008t) + (4 – 3,5R) ´ UF/BW, (8) где R – отношение концентраций мочевины после и до диализа (С/С0), UF – объем ультрафильтрации за сеанс (л), BW – вес тела (кг), t – длительность сеанса (час). В сравнении с формулой (5) значение Kt/V увеличилось за счет учета ультрафильтрации (вклад конвективного транспорта) и уменьшения объема распределения. Дата добавления: 2015-11-28 | Просмотры: 594 | Нарушение авторских прав |
 (1)
(1)
 , (7)
, (7)