 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Кинетика ренатурации ДНК
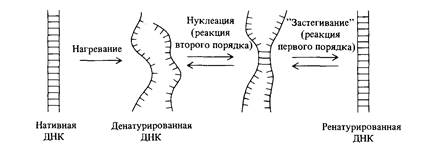
Если комплементарные цепи нативной двухцепочечной ДНК разделить посредством нагревания или в щелочной среде, то при правильно выбранной температуре и концентрациях солей в растворе, они довольно легко снова образуют двойную спираль. Мы уже встречались с несколькими примерами такой реассоциации при обсуждении образования гетеродуплекса ДНК в главах 7 и 8. В реакции ренатурации, как показано на рис. 9.1, можно выделить две отдельные стадии. Первая стадия -нуклеация- заключается в образовании водородных связей между несколькими, принадлежащими двум раз-
262 Организация и передача генетического материала
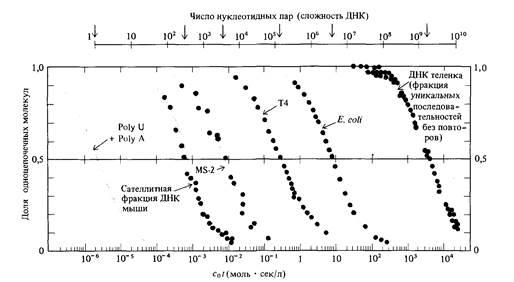
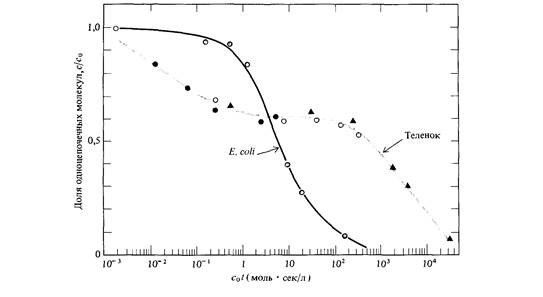
ным цепям комплементарными основаниями; остальные взаимно комплементарные основания выстраиваются друг против друга. На данной стадии происходит образование связи между двумя разными одноцепочечными молекулами. Это реакция второго порядка, ее скорость пропорциональна квадрату концентрации ДНК. Вторая стадия -реакция «застегивания молнии», при которой устанавливаются водородные связи между выстроенными друг против друга комплементарными нуклеотидами. Эта стадия представляет собой мономолекулярную реакцию; скорость образования водородных связей пропорциональна концентрации ДНК, т. е. кинетически является реакцией первого порядка. Какая из этих двух стадий идет медленнее и, следовательно, определяет общую скорость ренатурации ДНК, должен решать эксперимент. Показано, что лимитирующей является стадия образования первых связей между цепями. Зависимость концентрации одноцепочечной ДНК от времени в процессе реакции ренатурации описывается гиперболической функцией (вывод формулы приводится в дополнении 9.1). График зависимости концентрации от времени при k2 = 1 изображен на рис. 9.2. С помощью этого уравнения по времени (t1/2), необходимому для ренатурации половины исходного количества ДНК (с/с0 = 0,5), можно определять показатель реакции ренатурации (c0t1/2). Эта величина прямо пропорциональна числу нуклеотидов в неповторяющейся последовательности ДНК. Эта закономерность иллюстрируется на рис. 9.3 для нуклеиновых кислот, полученных из различных объектов. Другими словами, мы можем определить общий объем уникальной генетической информации, кодируемой ДНК, измеряя значение c0t1/2! Более того, экспериментально определяя кривые ренатурации ДНК, мы можем установить присутствие в геноме повторяющейся генетической информации. На рис. 9.4 сравниваются кинетика ренатурации ДНК прокариот и эукариот. Обратите внимание на то, что кривая ренатурациии ДНК Е. coli
9. Методы работы с ДНК 263
264 Организация и передача генетического материала
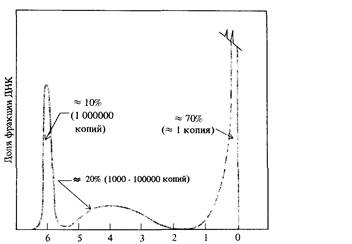
почти тождественна теоретической кривой, представленной на рис. 9.2. Так как теоретическая кривая получена на основе предположения о том, что скорость реакции второго порядка k2 неизменна, это означает, что ренатурация фрагментированной ДНК Е. coli характеризуется определенным значением k2. Что касается ДНК теленка, то, напротив, некоторые фрагменты ренатурируют со скоростью, много большей скорости ренатурации фрагментированной ДНК Е. coli, тогда как остальная ДНК (около 60%) ренатурирует много медленнее. На основе этих наблюдений можно заключить, что геном эукариот (в данном случае геном теленка) содержит как нуклеотидные последовательности, представленные в геноме лишь в единственном экземпляре, так и различные нуклеотидные последовательности, каждая из которых многократно повторена в геноме. Так, например, основываясь на кривой ренатурации, можно показать, что геном мыши содержит сложный набор нуклеотидных последовательностей, частота представленности которых в геноме схематически изображена на рис. 9.5. Организация и возможные функции многократно повторяющихся нуклеотидных последовательностей в геноме эукариот были в 60-х годах, после их открытия, предметом активного обсуждения. Около 10% генома мыши составляет совокупность тандемно расположенных последовательностей примерно из 10 нуклеотидов, повторенных 106 раз (рис. 9.5). Эти последовательности ДНК локализованы преимущественно в окружающем центромеры гетерохроматине. Подавляющее большинство этих последовательностей, по-видимому, играют какую-то роль в структурной организации хромосом, поскольку они не транскрибируются в последовательности РНК. С другой стороны, большинство последовательностей с не столь высокой повторностью распределены по всему геному и транскрибируются в РНК. Природа этих последовательностей активно изучается методами рекомбинантных ДНК, о которых мы расскажем в этой главе.
9. Методы работы с ДНК 265 Дата добавления: 2015-12-16 | Просмотры: 1104 | Нарушение авторских прав |

 log 10 числа повторов
log 10 числа повторов