 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
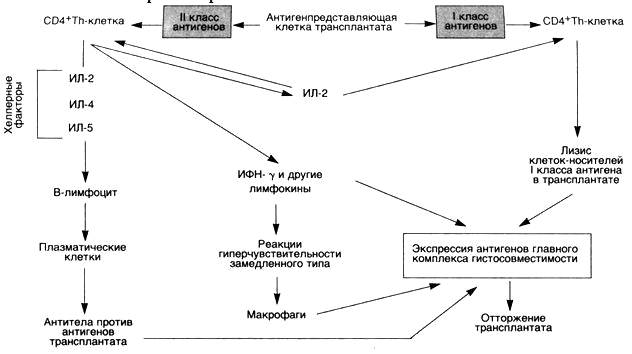
СD4,СD8В зависимости от особенностей антигенпредставляющей клетки, функ-ционирующей в комплексе с тимоцитами, на их мембране экспрес-сируется либо маркер CD4, комплементарно реагирующий с молекулами МНС-II, ли-бо CD8, связывающийся с собственными МНС-I. В последующем из CD4-лимфоцита в периферических тканях образуются Т-хелперы, а из CD8-тимоцитов образуются цитотоксические Т-лимфоциты. Таким образом, для CD4- и СD8-Т-лимфоцитов характерно распознавание чужеродного антигена лишь в комплексе с аутологичным мембранным бел-ком, кодируемым главным комплексом гистосовместимости. Подобные клет-ки, способные к одновременному распознаванию чужеродного антигена в комплексе с продуктами собственных МНС-генов, подвергаются положи-тельной селекции в тимусе. Эти клетки мигрируют из тимуса в кровь, а также в ткани. После встречи Т-лимфоцитов в периферических тканях с антигеном начинается 2-й этап дифференцировки Т-лимфоцита-иммуногенез. Контакт лимфоцитов с антигеном может происходить в регионарных лимфатических узлах при проникновении антигена через покровные барьерные ткани, а так-же в селезенке при проникновении антигенов в кровоток. В случае энтераль-ного поступления антигена его взаимодействие с лимфоцитами осуществля-ется в брыжеечных лимфатических узлах. Миграция лимфоцитов из крови в ткани происходит преимущественно через кубовидный эндотелий постка-пиллярных венул при участии адгезивных молекул, экспрессируемых на их поверхности, в частности, L-селектинов. Основными функциональными субпопуляциями CD4 лимфоцитов явля-ются Т-хелперы (Th0, Th1, Th2, Th3), выделена также минорная субпопуля-ция цитотоксических лимфоцитов с мембранным маркером CD4. CD8 Т-лимфоциты распознают чужеродный антиген только в его связи с молекулами МНС-I на поверхности клеток. Антигенпредставляющими клет-ками для CD8Т-лимфоцитов может быть любая клетка, поскольку антигены МНС-I экспрессируются на всех клетках организма с различной степенью интенсивности.
B-лимфоци́ты — функциональный тип лимфоцитов, играющих важную роль в обеспечении гуморального HYPERLINK "http://ru.wikipedia.org/wiki/Гуморальный_иммунитет"иммунитета. У эмбрионов человека и других млекопитающих B-лимфоциты образуются в печени и костном мозге из стволовых клеток, а у взрослых млекопитающих — в красном костном мозге. Экспрессия всеми В-клетками мембранных иммуноглобулинов позволяет осуществляться клональному отбору под действием антигена. При созревании, антиген-стимулировании и пролиферации существенно меняется набор маркеров В-клеток. По мере созревания В-клетки переключаются от синтеза и IgD на синтез IgG, IgA, IgE (при этом у клеток сохраняется способность синтезировать также IgM и IgD- вплоть до трёх классов одновременно). При переключении синтеза изотипов антигенная специфичность антител сохраняется. Различают: ·Собственно В-клетки - неактивированные В-лимфоциты, не контактировавшие с антигеном.Полиспецифичны и имеют слабое сродство к многим антигенам. ·В-клетки памяти - активированые В-лимфоциты. Являются долгоживущим клоном В-клеток, обеспечивая быстрый иммунный ответ и выработку большого количества иммуноглобулинов при повторном введении того же антигена. позволяют иммунной системе «помнить» антиген на протяжении многих лет после прекращения действия антигена. ·Плазматические клетки - являются последним этапом дифференцировки активированных В-клеток, провзаимодействовавшими с антигеном. В отличие от остальных В-клеток несут мало мембранных антител и способны секретировать растворимые антитела. Являются короткоживущими клетками (2-3 дня) и быстро элиминируются при отсутствии антигена, вызвавшего иммунный ответ.
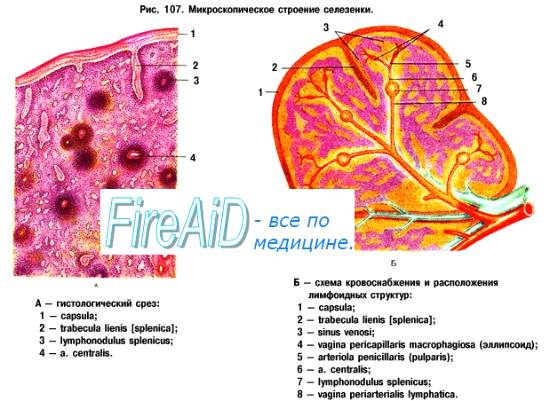
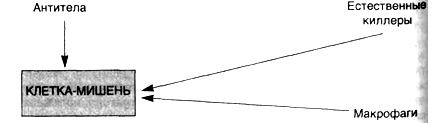
К популяции В-клеток можно отнести две субпопуляции: B-2 и В-1 клетки. В-1— это большая группа В-клеток у человека и мышей. Они могут составлять около 5% от общей популяции B-клеток. Такие клетки появляются в течение эмбрионального периода. На своей поверхности они экспрессируют IgM и небольшое количество (или вовсе не экспрессируют) IgD. Маркером этих клеток является CD5. Однако он не является обязательным компонентом клеточной поверхности. У животных В-1 клетки находятся в лимфоузлах и селезёнке. В эмбриональном периоде В-1 клетки появляются из стволовых клеток костного мозга. B1–лимфоциты поддерживают свою физиологическую регенерацию в течение всей жизни из отдельной клетки–предшественницы, пул которой у взрослых не пополняется за счёт общей стволовой кроветворной клетки костного мозга. Эта отдельная клетка–предшественница отселяется из кроветворной ткани на свою анатомическую территорию — в брюшную и плевральную полости — ещё в эмбриональном периоде. Итак, место обитания B1–лимфоцитов — прибарьерные полости. B1–лимфоциты значительно отличаются от B2–лимфоцитов по антигенраспознавательным способностям продуцируемых антител. Антитела, синтезированные B1–лимфоцитами, не имеют значительного разнообразия вариабельных участков молекул иммуноглобулинов, но, напротив, ограничены в репертуаре распознаваемых антигенов, и эти антигены — наиболее распространённые соединения клеточных стенок бактерий. Все B1–лимфоциты — как бы один не слишком специализированный, но определённо ориентированный (антибактериальный) клон. Антитела, продуцируемые B1–лимфоцитами, почти исключительно IgM, переключение классов иммуноглобулинов в B1–лимфоцитах не «предусмотрено». Таким образом, B1–лимфоциты — «отряд» противобактериальных «пограничников» в прибарьерных полостях, предназначенных для быстрой реакции на «просачивающиеся» через барьеры инфекционные микроорганизмы из числа широко распространённых. В сыворотке крови здорового человека преобладающая часть иммуноглобулинов — продукт синтеза как раз B1–лимфоцитами, т.е. это относительно полиспецифичные иммуноглобулины антибактериального назначения. Естественные киллеры, натуральные киллеры — большие гранулярные лимфоциты, обладающие цитотоксичностью против опухолевых клеток и клеток, зараженных вирусами. В настоящее время NK-клетки рассматривают как отдельный класс лимфоцитов. NK выполняют цитотоксические и цитокин-продуцирующие функции. NK являются одним из важнейших компонентов клеточного врождённого иммунитета.
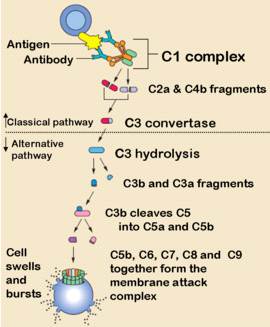
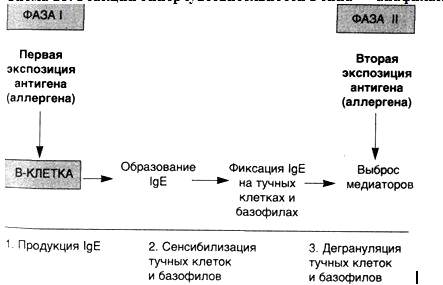
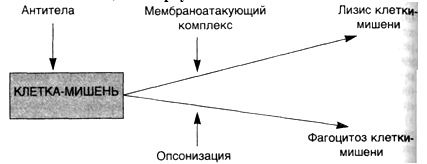
Иммуноглобулины всех изотипов бифункциональны. Это означает, что иммуноглобулин любого типа ·распознает и связывает антиген, а затем ·усиливает киллинг и/или удаление иммунных комплексов, сформированных в результате активации эффекторных механизмов. Одна область молекулы антител (Fab) определяет ее антигенную специфичность, а другая (Fc) осуществляет эффекторные функции: связывание с рецепторами, которые экспрессированы на клетках организма (например, фагоцитах); связывание с первым компонентом (C1q) системы комплемента для инициации классического пути каскада комплемента. · IgG является основным иммуноглобулином сыворотки здорового человека (составляет 70-75 % всей фракции иммуноглобулинов), наиболее активен во вторичном иммунном ответе и антитоксическом иммунитете. Благодаря малым размерам (коэффициент седиментации 7S, молекулярная масса 146 кДа) является единственной фракцией иммуноглобулинов, способной к транспорту через плацентарный барьер и тем самым обеспечивающей иммунитет плода и новорожденного. В составе IgG 2-3 % углеводов; два антигенсвязывающих Fab-фрагмента и один FC-фрагмент. Fab-фрагмент (50-52 кДа) состоит из целой L-цепи и N-концевой половины H-цепи, соединённых между собой дисульфидной связью, тогда как FC-фрагмент (48 кДа) образован C-концевыми половинами H-цепей. Всего в молекуле IgG 12 доменов (участки, сформированные из β-структуры и α-спиралей полипептидных цепей Ig в виде неупорядоченных образований, связанных между собой дисульфидными мостиками аминокислотных остатков внутри каждой цепи): по 4 на тяжёлых и по 2 на лёгких цепях. · IgM представляют собой пентамер основной четырехцепочечной единицы, содержащей две μ-цепи. При этом каждый пентамер содержит одну копию полипептида с J-цепью (20 кДа), который синтезируется антителообразующей клеткой и ковалентно связывается между двумя соседними FC-фрагментами иммуноглобулина. Появляются при первичном иммунном ответе B-лимфоцитами на неизвестный антиген, составляют до 10 % фракции иммуноглобулинов. Являются наиболее крупными иммуноглобулинами (970 кДа). Содержат 10-12 % углеводов. Образование IgM происходит ещё в пре-B-лимфоцитах, в которых первично синтезируются из μ-цепи; синтез лёгких цепей в пре-B-клетках обеспечивает их связывание с μ-цепями, в результате образуются функционально активные IgM, которые встраиваются в поверхностные структуры плазматической мембраны, выполняя роль антиген распознающего рецептора; с этого момента клетки пре-B-лимфоцитов становятся зрелыми и способны участвовать в иммунном ответе. · IgA сывороточный IgA составляет 15-20 % всей фракции иммуноглобулинов, при этом 80 % молекул IgA представлено в мономерной форме у человека. Секреторный IgA представлен в димерной форме в комплексе секреторным компонентом, содержится в серозно-слизистых секретах (например в слюне, слезах, молозиве, молоке, отделяемом слизистой оболочки мочеполовой и респираторной системы). Содержит 10-12 % углеводов, молекулярная масса 500 кДа. · IgD составляет менее одного процента фракции иммуноглобулинов плазмы, содержится в основном на мембране некоторых В-лимфоцитов. Функции до конца не выяснены, предположительно является антигенным рецептором с высоким содержанием связанных с белком углеводов для В-лимфоцитов, еще не представлявшихся антигену. Молекулярная масса 175 кДа. · IgE в свободном виде в плазме почти отсутствует. Способен осуществлять защитную функцию в организме от действия паразитарных инфекций, обуславливает многие аллергическиереакции. Механизм действия IgE проявляется через связывание с высоким сродством (10−10М) с поверхностными структурами базофилов и тучных клеток, с последующим присоединением к ним антигена, вызывая дегрануляцию и выброс в кровь высоко активных аминов (гистамина и серотонина — медиаторов воспаления). 200 кДа.
· Иммунология — это наука о строении и закономерностях функционирования иммунной системы, её заболеваниях и способах иммунотерапии. Иммунология изучает ·Строение иммунной системы; ·Закономерности и механизмы развития иммунных реакций; ·Механизмы контроля и регуляции иммунных реакций; ·Болезни иммунной системы и её дисфункции; ·Условия и закономерности развития иммунопатологических реакций и способы их коррекции; ·Возможность использования резервов и механизмов иммунной системы в борьбе с инфекционными и неинфекционными заболеваниями; ·Иммунологические проблемы трансплантации органов и тканей. Иммунитет — невосприимчивость, сопротивляемость организма инфекциям и инвазиям чужеродных организмов, а также воздействию чужеродных веществ, обладающих антигенными свойствами. Иммунные реакции возникают и на собственные клетки организма, измененные в антигенном отношении Имму́нная систе́ма — подсистема, существующая у позвоночных животных и объединяющая органы и ткани, которые защищают организм от заболеваний, идентифицируя и уничтожая опухолевые клетки и патогены.Конечной целью иммунной системы является уничтожение чужеродного агента, которым может оказаться болезнетворный микроорганизм, инородное тело, ядовитое вещество или переродившаяся клетка самого организма. Этим достигается биологическая индивидуальность организма. ИММУННАЯ РЕАКЦИЯ, взаимодействие антитела с соответствующим антигеном. Дает возможность идентифицировать антиген (напр., выявить возбудителя болезни), определить степень иммунитета организма. Иммунный ответ — это сложная многокомпонентная, кооперативная реакция иммунной системы организма, индуцированная антигеном и направленная на его элиминацию. Явление иммунного ответа лежит в основе иммунитета. Иммунный ответ зависит от: ·антигена — свойства, состав, молекулярная масса, доза, кратность попадания, длительность контакта); — состояния организма (иммунологическая реактивность); ·условий внешней среды
·2. Эмпирический этап иммунологии начался в глубокой древности. 3000 лет назад индийские врачеватели одевали здоровых детей в рубахи выздоравливающих оспенных больных; в IХ веке до н. э. в Китае пользовались вдуванием в нос здоровым людям высушенных струпьев оспенных больных. ·Древнегреческий историк Фукидид в 5 веке до н. э. отмечал, что при эпидемиях никто из переболевших не заболевал повторно. ·Вершиной эмпирического периода явился удачный эксперимент Эдуарда Дженнера по созданию искусственного иммунитета все к той же оспе в 1776 году. ·Увертюрой к научной иммунологии явилась работа Луи Пастера по предупреждению куриной холеры путем введения ослабленного штамма возбудителя (вакцинация). Пастер пытался дать теоретическое обоснование своему открытию, но считать это началом иммунологии, как науки нельзя. «Отцами основателями» иммунологии явились Илья Ильич Мечников и группа учеников Р. Коха во главе с Паулем Эрлихом. ·В 1882 году И. Мечников формулирует клеточную трактовку иммунитета: в организме имеются специализированные клетки — фагоциты, которые поглощают микробы и уничтожают их. В это же время (80-е годы) немецкие исследователи обнаруживают мощный бактерицидный эффект плазмы крови, справедливо предположив наличие в ней антимикробных факторов (Рудольф Эммерих в 1887 при краснухе, Эмиль Беринг при дифтерии). Эти гипотетические антимикробные факторы Эрлихом были названы антителами. ·Около 20 лет происходило напряженное противостояние клеточной и гуморальной теорий иммунитета. Постепенно споры стали стихать: поняли, что единая система иммунной защиты состоит из нераздельных составляющих клеточного и гуморального звена. В 1908 году И. Мечников и П. Эрлих были удостоены Нобелевской премии за выдающийся вклад в разработку теории иммунитета. ·Чуть позже Сидней Портер и Джеральд Эдельман установили структуру антител (Нобелевская премия 1972 года). В 60-х годах исследованиями Джека Миллера и Дж. Ф. Митчела была установлена роль и место тимуса в иммунном процессе. · Последние десятилетия накапливают наши знания в области медиаторов, осуществляющих «связь» внутри системы иммунитета. · 3. Вторая половина XX в. характеризуется бурным развитием иммунологии. Иммунная система была определена как комплекс биологических механизмов организма, направленных на поддержание структурного и функционального гомеостаза. Элементы иммунной системы распознают «свои» и «чужие» Аг и удаляют всё генетически отличное от него как чужеродное. Биологическая цель иммунных реакций — поддержание индивидуальности конкретного организма и отдельного вида; защита его от различных инфекционных и неинфекционных болезней. В настоящее время иммунология — биомедицинская дисциплина, включающая общие и частные направления. Общая иммунология изучает молекулярные и клеточные основы иммунных реакций, их регуляцию, генетический контроль, а также принципы наследования клеточных Аг и роль иммунных механизмов в процессах индивидуального развития. Частная иммунология носит прикладной характер; основные направления — вакцинология, иммуноонкология, иммунопатология, аллергология, трансплантационная иммунология. Вакцинология изучает методы искусственного создания невосприимчивости к инфекционным агентам и принципы разработки новых вакцинных препаратов. Трансплантационная иммунология изучает иммунную несовместимость тканей, отторжение трансплантатов, условия и способы преодоления несовместимости. Иммуноонкология — наука, изучающая роль иммунной системы в развитии злокачественных заболеваний. Иммунопатология и аллергология изучают нарушения иммунных реакций и механизмы развития извращённых реакций на Аг. Разработка новых методов иммунодиагностики заболеваний, создание средств и способов коррекции иммунных нарушений — не менее актуальные направления современной иммунологии. задачи иммунологии: 1. выяснение биохимических механизмов иммуногенеза (образование иммунитета и ИКК) 2. исследование структуры, свойств, функций лимфоидных клеток. 3 исследование физ-хим процессов на мембранах клеток.
5. Иммунитет — невосприимчивость, сопротивляемость организма инфекциям и инвазиям чужеродных организмов (в том числе — болезнетворных микроорганизмов), а также воздействию чужеродных веществ, обладающих антигенными свойствами. Иммунные реакции возникают и на собственные клетки организма, измененные в антигенном отношении[1]. Биологический смысл иммунитета — обеспечение генетической целостности организма на протяжении его индивидуальной жизни[2]. Развитие иммунной системы обусловило возможность существования сложно организованных многоклеточных организмов[3]. Врождённый (неспецифический, конституционный) иммунитет обусловлен анатомическими, физиологическими, клеточными или молекулярными особенностями, закрепленными наследственно. Как правило, не имеет строгой специфичности к антигенам, и не обладает памятью о первичном контакте с чужеродным агентом[4]. Например: ·Все люди невосприимчивы к чуме собак. ·Некоторые люди невосприимчивы к туберкулёзу. ·Показано, что некоторые люди невосприимчивы к ВИЧ. Приобретенный иммунитет делится на активный и пассивный. · Приобретенный активный иммунитет возникает после перенесенного заболевания или после введения вакцины. · Приобретенный пассивный иммунитет развивается при введении в организм готовых антител в виде сыворотки или передаче их новорожденному с молозивом матери или внутриутробным способом. Также иммунитет делится на естественный и искусственный. · Естественный иммунитет включает врожденный иммунитет и приобретенный активный (после перенесенного заболевания). А также пассивный при передаче антител ребёнку от матери. · Искусственный иммунитет включает приобретенный активный после прививки (введение вакцины) и приобретенный пассивный (введение сыворотки)
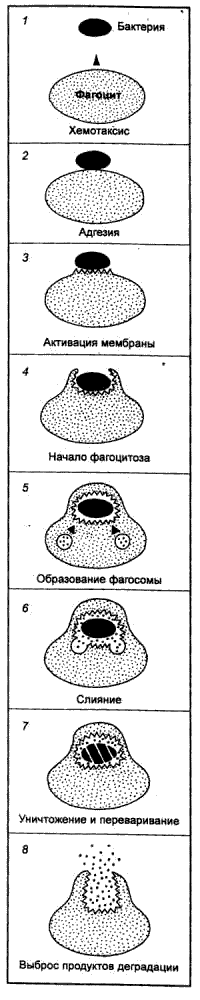
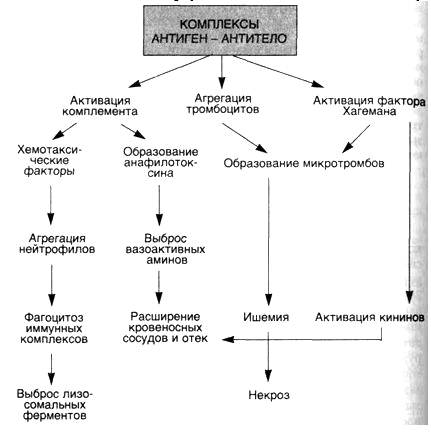
6. Под естественной резистентностью организма понимается иммунологически неспецифическая реакция распознавания и подавления размножения одноклеточных и многоклеточных паразитов, клеток (нормальных, повреждённых, мутантных, стареющих, опухолевых, инфицированных вирусами), микробов, вирусов и др. Наряду с иммунитетом организм человека обладает неспецифической сопротивляемостью, которая зависит от многочисленных факторов. К ним относится непроницаемость здоровой кожи и слизистых оболочек для микроорганизмов; непроницаемость гистогематических барьеров; наличие бактерицидных веществ в биологических жидкостях организма (слюна, слеза, спинномозговая жидкость, кровь); выделение вирусов почками; фагоцитарная система (HYPERLINK "http://medbiol.ru/medbiol/immunology/imm-gal/000bd465.htm"макрофаги, нейтрофилы); гидролитические ферменты;интерферон; лимфокины; система комплемента и др. Неспецифические защитные факторы обеззараживают даже вещества, с которыми организм ранее не встречался. Специфические начинают действовать после первичного контакта с антигеном. У позвоночных фагоцитоз осуществляется лейкоцитами крови и лимфы, а также фиксированными купферовыми клетками печени, гистиоцитами селезёнки, костного мозга, лимфатических узлов (клетками РГС), эндотелием кровеносных и лимфатических сосудов, гистиоцитами рыхлой соединительной ткани, которые на основании единства их происхождения, морфологии и функции объединены в систему мононуклеарных фагоцитов – СМФ Главная функция тканевых макрофагов – распознавание чужеродного материала, его поглощение, обезвреживание и переваривание в соответствующих внутриклеточных ультраструктурах. В распознавании чужеродных частиц и макромолекул важную роль играют рецепторы цитоплазматической мембраны макрофага. Многочисленные рецепторы, выявленные на их поверхности, принимают участие в процессах адгезии, эндоцитоза, межклеточных взаимодействий К системе мононуклеарных фагоцитов можно отнести и нейтрофилы периферической крови человека и животных, причём по функциональным свойствам. У них, так же как и у макрофагов, на поверхности обнаружены рецепторы для факторов комплемента, иммуноглобулинов и хемотаксически активных пептидов, а также рецепторы для гормонов. Выявлено наличие контактов между лимфоцитами и нейтрофилами. Одновременно показано, что стимулированные эндотоксином моноциты человека, секретируют моноцитарный фактор, стимулирующий случайную миграцию нейтрофилов Отметим, что уничтожение живых объектов, или завершенный фагоцитоз, - одна из основных функций нейтрофила. Переваривание осуществляется при помощи многочисленных ферментов гранул, которые гидролизуют практически любые биологические структуры – белки, нуклеиновые кислоты, липиды. Кислородные радикалы вместе с перекисью водорода, миелопероксидазой и галогенами составляют эффекторное звено аппарата цитотоксичности нейтрофила. Гуморальные факторы ЕР. Естественную резистентность млекопитающих к патогенным микроорганизмам и чужеродным агентам определяют неспецифические клеточные и гуморальные факторы. К этим факторам относят защитные свойства кожи и слизистых оболочек, бактерицидную активность сыворотки крови, слезной жидкости, слюны, молока и других жидкостей организма, которые обеспечиваются наличием в них неспецифических гуморальных факторов – лизоцим, комплемент, пропердин, интерферон, бета – лизин, естественные антитела и другие Лизоцим – фермент, обладающий свойством лизировать целый ряд, в основном грамположительных, микроорганизмов. Основными продуцентами лизоцима являются гранулоциты и моноциты крови, макрофаги костного мозга и селезёнки. Много его в слёзной жидкости, секретах слизистой ротовой полости и верхних дыхательных путей, то есть в тех органах, которые являются первым барьером на пути проникновения микробов в организм животного. Комплемент – сложный комплекс белков сыворотки крови глобулиновой природы. В его составе 9 компонентов разных по своему химическому составу, физиологическим и биологическим свойствам. Активным является весь комплемент в целом, а не отдельные его компоненты. Наиболее высокое содержание комплемента выявлено в сыворотке крови морских свинок. Он способствует лизису сенсибилизированных бактерий в присутствии бактериолизинов, лизису сенсибилизированных эритроцитов и опсонизации бактерий к фагоцитозу. В отсутствие комплемента активность некоторых антител полностью утрачивается, поэтому содержание и активность комплемента служит характеристикой состояния естественной резистентности. Интерферон – рассматривается как один из неспецифических факторов, участвующих в противовирусной защите. Он образуется в клетке сразу после проникновения в нее вируса и является продуктом клетки хозяина. Кроме того, интерферон представляет собой универсальную регуляторную молекулу, способную модулировать чуть ли не все функции мононуклеарных фагоцитов Существуют 3 класса интерферонов – α, β и γ. При экспозиции с интерфероном мононуклеарные фагоциты выделяют интерлейкин – 1. Это лимфоидный рострегулирующий фактор, участвующий в начальных этапах активации лимфоцитов при воздействии антигенов Пропердин – Содержится в нормальной сыворотке крови, обладает бактерицидным действием и способен убивать большинство грамположительных и грамотрицательных бактерий. Точнее следует говорить о действии не самого, а системы пропердина, поскольку активность его проявляется лишь в присутствии других факторов сыворотки – комплемента, а также ионов магния Бета – лизин – является термостабильным белком с молекулярной массой 6000Д, который обеспечивает лизирующие свойства сыворотки крови в отношение грамположительных микробов. Предполагается, что продуцентами бета – лизинов являются тромбоциты, из которых он переходит в сыворотку во время свёртывания крови Итак, представления о системе естественной резистентности и составляющих её компонентах претерпели значительную эволюцию: фагоциты перестали считать фактором исключительно противомикробной резистентности. Современная позиция отражает представления более общего плана, согласно которым фагоцитарная система рассматривается как важный эффектор структурного гомеостаза. Фагоцитарная система является филогенетически самой древней системой защиты организма от чужеродных агентов. Все живые организмы на любой ступени эволюции от простейших одноклеточных до млекопитающих способны к фагоцитозу. Основные фагоцитирующие клетки позвоночных – моноциты крови, тканевые макрофаги и нейтрофилы – участвуют в процессах поддержания гомеостаза организма, воспаления и регенерации, в неспецифической противомикробной защите, в иммуногенезе и реакциях специфического иммунитета. Именно поэтому естественной резистентности, эффекторами которой являются макрофаги, нейтрофилы и моноциты, клетки – естественные киллеры и неспецифические гуморальные факторы (комплемент, интерферон, лизоцим и др.) отводится существенная роль в защите организма, включая и противоопухолевую защиту.
7. Нормальная микрофлора — неспецифический стимулятор («раздражитель») иммунной системы; отсутствие нормального микробного биоценоза вызывает многочисленные нарушения в иммунной системе. Другая роль микрофлоры была установлена после того, как были получены безмикробные животные-гнотобионты Было показано, что нормальная микрофлора оказывает постоянное антигенное «раздражение» иммунной системы, а у гнотобионтов его отсутствие вызывает недоразвитие основных иммунокомпетентных органов (например, тимуса, лимфоидной ткани кишечника). Аг представителей нормальной микрофлоры вызывают образование AT в низких титрах. Они преимущественно представлены IgA, выделяющимися на поверхность слизистых оболочек. IgA составляют основу местной невосприимчивости к проникающим возбудителям и не дают возможности комменсалам проникать в глубокие ткани. Дата добавления: 2014-12-12 | Просмотры: 1574 | Нарушение авторских прав |


 Иммунология — наука о факторах и механизмах, обуславливающих невоспреимчивость человека и животных к инфекционным микроорганизмам.
Иммунология — наука о факторах и механизмах, обуславливающих невоспреимчивость человека и животных к инфекционным микроорганизмам.